RNA干擾抑制IL-23表達對感染后內臟高敏感小鼠腸黏膜固有層DC活化Th17細胞功能的影響*
汪之沫 王文峰 龍艷芹 汪 歡 錢 偉 侯曉華
華中科技大學同濟醫學院附屬協和醫院消化內科(430022)
感染后腸易激綜合征(postinfectious irritable bowel syndrome,PI-IBS)系指急性胃腸道感染治愈后,部分患者仍存在腸道動力和感覺異常,出現腹痛、腹瀉、便秘等腸道相關癥狀。研究發現PI-IBS患者腸黏膜固有層T細胞浸潤增多,伴炎性細胞因子如白細胞介素-1β(IL-1β)等表達增加[1,2];T 細胞數量減少后,IBS癥狀隨之減輕[3]。本課題組的前期研究[4]通過建立旋毛蟲感染后內臟高敏感小鼠模型模擬人類PI-IBS的自然過程,發現模型小鼠腸黏膜固有層樹突細胞(DC)誘導活化Th17細胞與腸道感染消退后腸黏膜免疫系統的持續激活有關,源自模型小鼠腸黏膜固有層的DC與脾臟CD4+T細胞共培養能誘導其分化為Th17細胞,使IL-17分泌增多。關于DC活化Th17細胞的具體機制,目前仍不甚清楚,推測可能與DC分泌IL-23有關。本研究應用RNA干擾(RNAi)技術抑制DC分泌IL-23,通過觀察經小鼠IL-23小發夾RNA(shRNA)干擾的DC誘導CD4+T細胞分化為Th17細胞功能的變化,探討感染后內臟高敏感小鼠腸黏膜固有層DC活化Th17細胞的機制,以進一步明確DC在腸道感染消退后腸黏膜免疫系統持續激活中的作用。
材料與方法
一、實驗動物分組和造模
雄性SPF級NIH小鼠由武漢生物制品研究所提供,6~8 周齡,體質量(25.0±2.3) g,飼養于華中科技大學同濟醫學院實驗動物學部。旋毛蟲幼蟲由華中科技大學同濟醫學院寄生蟲學教研室提供。
12只NIH小鼠隨機分為兩組,每組6只。對照組以0.2 mL 0.9%NaCl溶液灌胃;模型組以0.2 mL含300條旋毛蟲幼蟲的0.9%NaCl溶液灌胃[5]。8周后處死兩組小鼠,取腸道和脾臟進行實驗。飼養過程中無動物死亡。
小鼠處死前行結腸氣囊擴張腹壁回撤反射(AWR)評分,處死后取空腸、末端回腸、近端結腸、遠端結腸標本行組織病理學檢查,判斷模型組小鼠感染后內臟高敏感模型建立是否成功。具體步驟參照本課題組前期研究[4]。
二、腸黏膜固有層DC和脾臟CD4+T細胞的分離純化
模型組小鼠處死后浸泡于75%乙醇中3 min,于超凈臺內取全部空腸、回腸和結腸,PBS充分沖洗,剪成0.5 cm×0.5 cm左右的片狀,參照本課題組前期研究[4]步驟獲取腸黏膜固有層單個核細胞,以MACS?CD11c 免疫磁珠(Miltenyi Biotec)分選DC,操作按試劑盒說明書進行。所獲細胞懸浮于含10%胎牛血清的RPMI1640完全培養基中。流式細胞術檢測顯示CD11c陽性率為78.85%±10.11%,臺盼藍拒染實驗顯示細胞活性≥90%。
另取脾臟研碎,參照本課題組前期研究[4]步驟獲取單個核細胞,以MACS?CD4免疫磁珠(Miltenyi Biotec)分選CD4+細胞,操作按試劑盒說明書進行。所獲細胞懸浮于含10%胎牛血清的RPMI1640完全培養基中。流式細胞術檢測顯示CD4陽性率為98.40%±1.82%,臺盼藍拒染實驗顯示細胞活性≥99%。
三、小鼠IL-23 shRNA干擾質粒的構建和鑒定
設計、合成能產生小鼠IL-23 shRNA的兩條互補單鏈DNA模板(A鏈和B鏈),A鏈序列為5′-CACCAGCAGCTCTCTCGGAATCTTTCAAGACG AGATTCCGAGAGAGCTGCT TTTTTT G-3′,B 鏈序列為 5′-AGCT C AAAAAA AGCAGCTCTCTCGGAATCT CGTCTTGAA AGATTCCGAGAGAGCTGCT-3′,由武漢晶賽生物工程技術有限公司合成。A鏈與B鏈互補結合后形成雙鏈DNA模板,結構為CACC+正義序列+發夾環序列+反義序列+終止信號序列+SacⅠ,其中正義序列AGCAGCTCTCTCGGAATCT與小鼠IL-23基因p19亞基的一段序列同源,經BLAST同源序列比對,不與小鼠基因組其他基因序列同源。模板兩端引入酶切位點黏端序列以便于與載體連接。同時設計、合成能產生與小鼠IL-23基因無同源序列的無關序列shRNA的兩條互補單鏈DNA模板作為對照。
分別以30 μL退火緩沖液溶解合成的1 OD(1 OD DNA=50 ng/μL DNA)A 鏈和 B 鏈基因片段,各取 2 μL,加入 16 μL 退火緩沖液混勻,94 ℃水浴退火,自然冷卻至室溫。取1 μL退火連接產物,加入99 μL H2O作100倍稀釋,-20℃保存備用。
以Eco31Ⅰ酶切線性化pGenesil-1.1質粒表達載體,1%瓊脂糖凝膠電泳回收大片段。將上述稀釋退火片段與質粒pGenesil-1.1連接,連接反應體系內含稀釋退火片段1 μL、質粒pGenesil-1.11 μL、10×連接緩沖液 1 μL、T4 DNA 連接酶 1 μL 和 H2O 6 μL,37℃水浴反應過夜。取5 μL連接產物轉化DH5α感受態細胞,涂布于含Kanar抗性(終濃度30 μg/mL)的LB平板上,37℃恒溫箱培養過夜。挑取單克隆菌落接種于5 mL含Kanar抗性(終濃度30 μg/mL)的 LB 培養液中,37 ℃恒溫搖床(7×g)培養過夜。
以質粒小提試劑盒[天根生化科技(北京)有限公司]小量提取質粒,SacⅠ酶切鑒定,酶切反應體系內含質粒 DNA 8.5 μL、10×酶切緩沖液 1 μL 和SacⅠ 0.5 μL,37 ℃水浴反應 3 h,1%瓊脂糖凝膠電泳。如酶切鑒定顯示切下預期大小的片段,則送含有轉化質粒的菌液測序(華大基因)。如測序正確,以質粒大提試劑盒[天根生化科技(北京)有限公司]大量提取質粒,測定濃度后-20℃保存備用。
四、DC轉染實驗
實驗設置IL-23 shRNA組(A組)、空脂質體組(B組)和無關序列shRNA組(C組),每組設2個復孔。分離純化得到的腸黏膜固有層DC培養于含10%胎牛血清的RPMI1640完全培養基中,接種于6孔板,待細胞匯合率達90%時,以LipofectamineTM2000轉染試劑(InvitrogenTM,Life Technologies Corporation)轉染相應干擾質粒脂質體復合物或空脂質體,操作按試劑盒說明書進行。轉染后24 h收獲細胞,以細胞計數板計數后備用。收集各組DC轉染前和轉染后24 h培養上清液,以備檢測IL-23水平。此步驟重復3次。
五、轉染后DC與CD4+T細胞共培養
A、B、C 三組分別計數 5×105個 DC,與 1.5×106個CD4+T細胞接種于12孔板,以含10%胎牛血清的RPMI1640完全培養基定容至1 mL,另設置CD4+T細胞單獨培養組(D組),每組設2個復孔。共培養120 h后收集各組培養上清液,以備檢測IL-17水平。此步驟進行3次,分別使用3次轉染實驗的DC。
六、IL-23、IL-17 水平檢測
步驟四、步驟五收集的細胞培養上清液中IL-23、IL-17水平的檢測采用ELISA方法(BioSourceTM,Life Technologies Corporation),操作按試劑盒說明書進行,每一標本設2個復孔。
七、統計學分析
結 果
一、感染后內臟高敏感小鼠模型建立
模型組小鼠感染旋毛蟲后8周,肉眼觀未見腸道水腫,光學顯微鏡下未見腸黏膜破壞和明顯炎性細胞浸潤。結腸氣囊擴張壓力為40和60 mm Hg(1 mm Hg=0.133 kPa)時,模型組 AWR均分顯著高于對照組(40 mm Hg:2.41±0.26 對 1.39±0.16,P<0.01;60 mm Hg:3.23±0.37 對 2.72±0.23,P<0.05),個體最低AWR均分(40 mm Hg:2.28±0.19,60 mm Hg:3.15±0.18)亦顯著高于對照組(P<0.05)。 表明腸道感染消退后,小鼠內臟敏感性持續增高,提示造模成功。
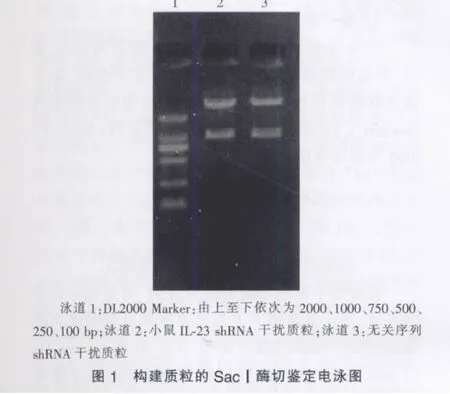
二、構建質粒的酶切鑒定
質粒pGenesil-1.1的多克隆位點為:-MluⅠ-hU6 promoter-Insert DNA-SacⅠ-,本研究在插入的目的基因片段里設計有一個SacⅠ酶切位點,且質粒pGenesil-1.1本身就有一個SacⅠ酶切位點,如插入正確,質粒就能被SacⅠ酶切出一條約1000 bp的DNA片段。經SacⅠ酶切鑒定,所構建的小鼠IL-23 shRNA干擾質粒和無關序列shRNA干擾質粒均符合設計要求(見圖1)。
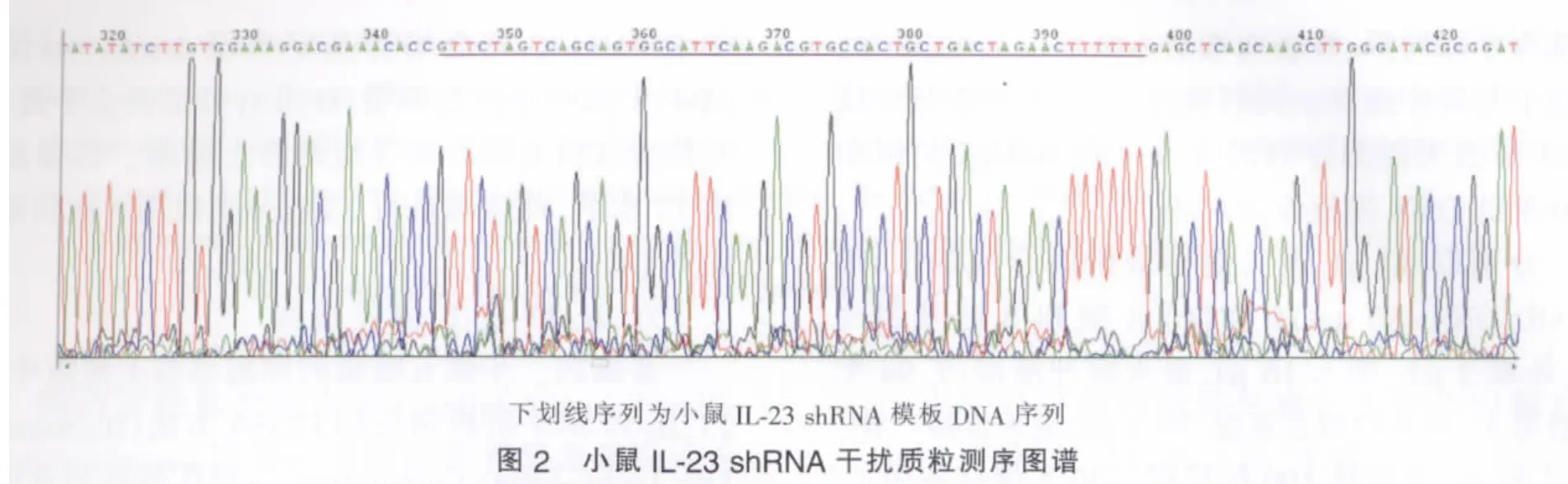
三、小鼠IL-23 shRNA干擾質粒的測序分析
測序分析結果顯示所構建質粒中小鼠IL-23 shRNA模板DNA序列與設計序列完全一致(見圖2)。
四、DC培養上清液IL-23水平
轉染小鼠IL-23 shRNA干擾質粒的DC,轉染后培養上清液中的IL-23水平較轉染前顯著降低;轉染空脂質體或無關序列shRNA干擾質粒的DC,轉染前后IL-23水平無明顯變化(見表1)。
表1 DC轉染前后培養上清液IL-23水平比較(,pg/mL)
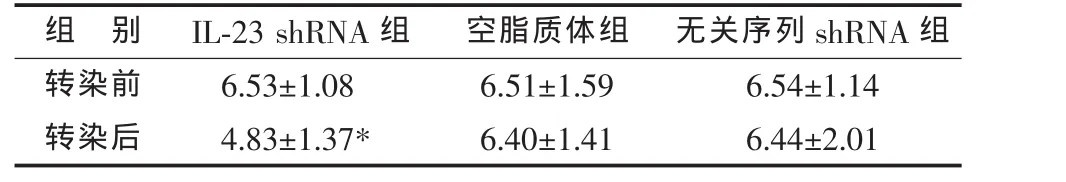
表1 DC轉染前后培養上清液IL-23水平比較(,pg/mL)
*與同組轉染前比較,P<0.05
五、轉染后DC與CD4+T細胞共培養上清液IL-17水平
CD4+T細胞與轉染小鼠IL-23 shRNA干擾質粒、空脂質體或無關序列shRNA干擾質粒的DC共培養后,共培養上清液中的IL-17水平均較單獨培養的CD4+T細胞顯著增高[(12.63±0.63)pg/mL、(14.31±0.44)pg/mL 和(14.22±0.53)pg/mL 對(11.15±0.93)pg/mL,P<0.05],其中IL-23 shRNA組顯著低于空脂質體組和無關序列shRNA組(P<0.05),空脂質體組和無關序列shRNA組間差異無統計學意義。
討 論
PI-IBS是常見功能性腸病IBS的主要亞型,近年研究發現PI-IBS患者的腸黏膜存在由T細胞介導的持續低度炎癥[1,2]。DC是腸黏膜免疫系統中最重要的抗原呈遞細胞,腸黏膜固有層中存在大量未成熟的DC,攝取抗原后轉化為成熟DC。DC在向CD4+T細胞呈遞抗原的同時,還能分泌細胞因子誘導CD4+T細胞分化。
CD4+Th細胞作為調節性T細胞中的一個大類,在機體免疫應答、免疫調節等諸多方面發揮重要作用。Th細胞可分為Th1、Th2、Th17三個亞群,三者均由初始型CD4+T細胞分化而成;作為Th17細胞產生的代表性細胞因子,IL-17與自身免疫性疾病密切相關,參與了相關疾病組織炎癥的調節[6~8]。研究[9]發現IL-17在T細胞介導的慢性腸道炎癥的維持中發揮重要作用。PI-IBS患者的腸黏膜處于持續低度炎癥狀態,因此Th17細胞可能參與了此種低度炎癥狀態的維持。
旋毛蟲感染后內臟高敏感小鼠模型可模擬人類PI-IBS的自然過程[5],目前已廣泛應用于PI-IBS的研究。本課題組的前期研究[4]顯示,小鼠感染旋毛蟲后2周,腸黏膜可見典型急性炎癥改變,結腸氣囊擴張AWR評分提示內臟敏感性增高;感染后8周,腸黏膜已無明顯炎癥改變,但AWR評分提示內臟敏感性持續增高。感染旋毛蟲后8周,小鼠腸黏膜固有層DC與脾臟CD4+T細胞共培養能顯著促進IL-17分泌,作用強于感染后2周的腸黏膜固有層DC。上述結果表明在急性炎癥期,腸黏膜固有層DC能誘導CD4+T細胞分化為Th17細胞并使之活化,隨著腸道炎癥的自愈,該作用并不減弱,反而進一步增強,即腸道感染消退后,DC仍能持續有效地活化Th17細胞,這一作用可能對PI-IBS腸黏膜免疫系統的持續激活具有重要意義。
關于PI-IBS時腸黏膜固有層DC活化Th17細胞的具體機制,目前仍不甚清楚。研究[10]發現回腸末端菌群可刺激黏膜固有層DC產生IL-23。IL-23是一個由p19亞基和IL-12p40亞基組成的異源二聚體,屬于IL-12細胞因子家族成員[11],是誘導初始型CD4+T細胞分化為Th17細胞并分泌IL-17的關鍵細胞因子[6~8]。推測PI-IBS時腸黏膜固有層DC可能系通過分泌IL-23刺激CD4+T細胞分化,誘導活化Th17細胞,參與腸道感染消退后腸黏膜免疫系統的持續激活。
RNA干擾作為一種高效、特異的基因干預工具,目前已廣泛應用于各個研究領域。p19亞基為IL-23發揮特異性作用的關鍵亞基,外周血DC、極化的Th1細胞和激活的巨噬細胞中均可檢測到高水平p19表達。因此本研究以小鼠IL-23基因p19亞基的一段序列為靶點設計、構建了小鼠IL-23 shRNA干擾質粒,以高效、特異地沉默小鼠IL-23基因。酶切鑒定和測序分析顯示小鼠IL-23 shRNA干擾質粒構建成功,目的序列完全正確。模擬人類PI-IBS的感染后內臟高敏感小鼠模型腸黏膜固有層DC轉染小鼠IL-23 shRNA干擾質粒后,培養上清液中的IL-23水平較轉染前顯著降低,而轉染空脂質體或無關序列shRNA干擾質粒的DC轉染前后IL-23水平無明顯變化,證明所構建的小鼠IL-23 shRNA干擾質粒能有效抑制腸黏膜固有層DC的IL-23表達。經RNA干擾抑制IL-23表達的DC與CD4+T細胞共培養,雖然亦能促進IL-17分泌,但作用顯著弱于IL-23表達未受抑制(轉染空脂質體或無關序列shRNA干擾質粒)的DC。由此推測感染后內臟高敏感小鼠腸黏膜固有層DC可能通過分泌IL-23刺激CD4+T細胞分化,誘導活化Th17細胞,參與維持腸道感染消退后腸黏膜免疫系統的持續激活;在PI-IBS腸黏膜免疫系統激活的過程中,可能存在著DC-IL-23-Th17-IL-17這一免疫激活通路,當然這并不是惟一的通路。這一發現對進一步認識PI-IBS的發病機制以及探索新的治療靶點具有重要意義。
1 Dunlop SP,Jenkins D,Spiller RC.Distinctive clinical,psychological,and histological features of postinfective irritable bowel syndrome[J].Am J Gastroenterol,2003,98(7):1578-1583.
2 Spiller R,Campbell E.Post-infectious irritable bowel syndrome[J].Curr Opin Gastroenterol,2006,22(1):13-17.
3 Dunlop SP,Jenkins D,Spiller RC.Age-related decline in rectal mucosal lymphocytes and mast cells[J].Eur J Gastroenterol Hepatol,2004,16(10):1011-1015.
4 王文峰,龍艷芹,汪歡,等.感染后內臟高敏感小鼠腸道黏膜固有層樹突細胞對CD4+T細胞的作用[J].胃腸病學,2010,15(3):147-150.
5 Wheatcroft J, Wakelin D, Smith A, et al.Enterochromaffin cell hyperplasia and decreased serotonin transporter in a mouse model of postinfectious bowel dysfunction[J].Neurogastroenterol Motil,2005,17(6):863-870.
6 Wynn TA.TH-17:a giant step from TH1 and TH2[J].Nat Immunol,2005,6(11):1069-1070.
7 Harrington LE,Hatton RD,Mangan PR,et al.Interleukin 17-producing CD4+effector T cells develop via a lineage distinct from the T helper type 1 and 2 lineages[J].Nat Immunol,2005,6(11):1123-1132.
8 Park H,Li Z,Yang XO,et al.A distinct lineage of CD4 T cellsregulatestissueinflammation byproducing interleukin 17[J].Nat Immunol,2005,6(11):1133-1141.
9 Yen D,Cheung J,Scheerens H,et al.IL-23 is essential for T cell-mediated colitis and promotes inflammation via IL-17 and IL-6[J].J Clin Invest,2006,116(5):1310-1316.
10 Becker C,Wirtz S,Blessing M,et al.Constitutive p40 promoter activation and IL-23 production in the terminal ileum mediated by dendritic cells[J].J Clin Invest,2003,112(5):693-706.
11 Oppmann B,Lesley R,Blom B,et al.Novel p19 protein engagesIL-12p40 to form a cytokine,IL-23,with biological activities similar as well as distinct from IL-12[J].Immunity,2000,13(5):715-725.

