缺氧環境肝癌SMMC-7721細胞ABCG2和HIF-1α的表達及其關系
卿小松,孔憲炳
(重慶醫科大學附屬第一醫院肝膽外科 400016)
三磷腺苷結合盒轉運體G2(ATP-binding cassette transporter G2,ABCG2)是近年來發現的三磷腺苷結合盒(ATP-binding cassette,ABC)轉運體蛋白家族新成員。研究表明,ABCG2參與了多種腫瘤的發生、發展及耐藥,并能維持干細胞特性[1-2]。缺氧誘導因子-1α(hypoxia-inducible factor-1alpha,HIF-lα)是目前發現的介導細胞低氧反應最關鍵的核轉錄因子,它可促進血管形成,維持細胞氧及代謝平衡,以保證腫瘤生長,并導致化療耐受[3-4]。本實驗研究了在缺氧條件下人肝癌SMMC-7721細胞ABCG2和HIF-1α表達的變化,探索二者表達的關系,并進一步探討缺氧誘導ABCG2表達的可能機制,為抗腫瘤治療提供理論依據。
1 材料與方法
1.1 材料 人肝癌SMMC-7721細胞株由重慶醫科大學普外科學重點實驗室提供。RPMI 1640培養基、小牛血清購于Gibco公司;抗HIF-1α多克隆兔抗人抗體購自Santa Cruz公司;抗ABCG2多克隆兔抗人抗體購自武漢博士德公司;辣根過氧化物酶(horseradish peroxidase,HRP)標記羊抗兔第二抗體及增強化學發光(enhanced chemiluminecence,ECL)試劑盒購于碧云天生物技術公司;HIF-lα抑制劑3-(5′-羥甲基-2′-呋喃 )-1-芐 基 吲 唑 [3-(5′-hydroxymethyl-2′-furyl)-1-benzylindazole,YC-1]購自Cayman公司;全細胞裂解液及聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜購自博海生物有限公司。
1.2 細胞培養 SMMC-7721細胞在含10%小牛血清的RPMI 1640培養基中培養,將其分為對照組及缺氧組。對照組在5%CO2、37℃培養箱中培養。待細胞生長至60%匯合狀態時,缺氧組細胞放入含1%O2、94%N2、5%CO2混合氣體的培養箱培養,根據缺氧時間,缺氧組再分為缺氧24h組、缺氧48h組及缺氧72h組。
1.3 HIF-1α與ABCG2蛋白的檢測 收獲培養的各組細胞,按照全細胞裂解液說明書提取細胞總蛋白,二辛可寧酸(bicinchoninic acid,BCA)法測定總蛋白濃度。取50μg蛋白進行聚丙烯酰胺凝膠電泳,電轉移至PVDF膜上,麗春紅染色證實轉移成功,5%脫脂奶粉封閉非特異性抗原,第一抗體封閉過夜,第二抗體37℃孵育1h。第一抗體HIF-1α抗體1∶100稀釋,ABCG2抗體1∶100稀釋,第二抗體工作濃度均為1∶1 000。ECL顯影,Bio-Rad凝膠成像系統采集圖片,將 HIF-1α與ABCG2灰度值分別與甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)灰度值的比值作為蛋白表達水平的參數,對產物相對定量,實驗重復3次。
1.4 YC-1抑制 SMMC-7721細胞 HIF-1α表達后對 ABCG2表達的影響 將缺氧72h組SMMC-7721細胞加入 HIF-1α抑制 劑 YC-1,按 YC-1 終 濃 度 分 為 YC-1 1.0、2.0 及4.0μmol/L組,將不含 YC-1的缺氧72h組SMMC-7721細胞設為YC-1對照組。各組分別處理24h后,采用Western blot檢測各組細胞中HIF-1α、ABCG2蛋白的表達。實驗重復3次。
1.5 統計學處理 所有數據采用SPSS17.0軟件行統計學分析,數據以±s表示,行SNK方差分析及Pearson相關分析,以P<0.05為差異有統計學意義。
2 結 果
2.1 缺氧環境SMMC-7721細胞 HIF-1α、ABCG2蛋白的表達 Western blot結果顯示,與對照組比較,在缺氧條件下SMMC-7721細胞中 HIF-1α蛋白表達上調,HIF-1α的表達在缺氧24h時即開始增加,48h穩步上升,72h達到高峰,各缺氧組SMMC-7721細胞HIF-1α的表達與對照組比較,差異有統計學意義(P<0.05),見圖1、表1。ABCG2的表達趨勢同HIF-1α的表達,二者表達呈正相關(r=0.944,P<0.05),表明隨著缺氧的加劇,HIF-1α與ABCG2蛋白表達逐漸增加。

圖1 Western blot檢測缺氧環境SMMC-7721細胞HIF-1α與ABCG2蛋白的表達
表1 Western blot檢測SMMC-7721細胞中 HIF-1α與ABCG2蛋白的表達(±s)

表1 Western blot檢測SMMC-7721細胞中 HIF-1α與ABCG2蛋白的表達(±s)
*:P<0.05,與對照組比較;#:P<0.05,與缺氧24h組比較;△:與缺氧48h組比較。
組別 HIF-1αABCG2對照組0.184±0.017 0.087±0.017缺氧24h組 0.289±0.044* 0.166±0.019*缺氧48h組 0.385±0.044* 0.227±0.034*缺氧72h組 0.608±0.090*#△ 0.344±0.061*#△
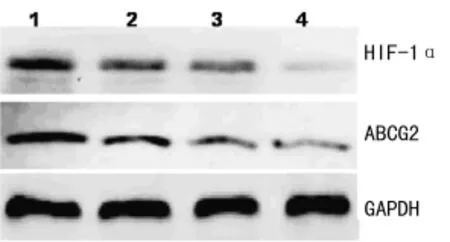
圖2 不同濃度 YC-1對SMMC-7721細胞 HIF-1α、ABCG2蛋白表達的影響
2.2 YC-1抑制 SMMC-7721細胞 HIF-1α表達后對 ABCG2表達的影響 Western blot檢測結果顯示,隨著YC-1濃度的增加,缺氧72h組SMMC-7721細胞中HIF-1α蛋白表達逐漸減少,同時 ABCG2表達亦逐漸下降,除 YC-1 1.0μmol/L組與YC-1 2.0μmol/L組比較,差異無統計學意義外,其余各組比較,差異均有統計學意義(P<0.05),見圖2、表2。
表2 不同濃度 YC-1對 HIF-1α、ABCG2表達的影響(±s)

表2 不同濃度 YC-1對 HIF-1α、ABCG2表達的影響(±s)
*:P<0.05,與對照組比較;#:P<0.05,與 YC-1 1.0μmol/L組比較;△ :與 YC-1 2.0μmol/L組比較。
組別 HIF-1αABCG2 YC-1對照組0.615±0.059 0.509±0.087 YC-1 1.0μmol/L組 0.387±0.054* 0.287±0.039*YC-1 2.0μmol/L組 0.315±0.030* 0.239±0.033*YC-1 4.0μmol/L組 0.085±0.020*#△ 0.105±0.019*#△
3 討 論
ABCG2首次發現于乳腺癌 MCF-7/Adr-Vp3000細胞系,因此,又稱為乳腺癌耐藥蛋白(breast cancer resistance protein,BCRP)[5]。隨著研究的深入,人們發現它在多種腫瘤組織及腫瘤細胞中亦有表達[6-7]。ABCG2作為一種轉運體,可以將多種化學結構不同的藥物“泵出”細胞外,其轉運的藥物包括:多柔比星、米托蒽醌、長春新堿、紫杉醇及拓撲替康等,其介導的多藥耐藥(multi-drug resistance,MDR)是導致臨床化療失敗的原因之一[8-9]。腫瘤生長快,代謝旺盛,耗氧量大,而腫瘤內部的血管生成則相對較慢,因而缺氧幾乎是所有實體瘤微環境的共同特征。缺氧時細胞內亞鐵血紅素、卟啉類化合物等物質大量堆積,它們可破壞細胞DNA、蛋白質及包膜脂質。此外,缺氧微環境還是造成化療耐藥的原因之一。
趙大偉等[10]發現ABCG2蛋白在正常肝組織及肝硬化組織中均有表達,呈弱陽性。在肝癌組織中,ABCG2表達約2/3呈弱陽性,1/3呈強陽性;ABCG2表達水平與腫瘤直徑及數目有關。ABCG2還是肝癌側群細胞表型的主要因素,后者具有腫瘤干細胞特性,而腫瘤干細胞目前被認為是維持腫瘤生長及化療失敗的根本原因[10-12]。因此,ABCG2可能對維持肝癌生長和化療耐藥發揮重要作用。本研究發現,缺氧環境中SMMC-7721細胞ABCG2的表達較常氧環境中的表達增加,這與Krishnamurthy等[13]的研究結果相符。同時本實驗結果還顯示,ABCG2的表達隨缺氧時間的延長而增加,隨著缺氧加劇,細胞能量供求矛盾突出,細胞內糖酵解途徑代謝物不斷積累,腫瘤細胞上調ABCG2表達以將這些代謝產物排出體外,抵抗缺氧帶來的傷害,而由此導致的ABCG2表達增加可能是缺氧下腫瘤細胞耐藥的機制之一。
HIF-lα在細胞缺氧信號途徑中處于核心位置,它可以促進新生血管形成,維持氧及代謝平衡,以保證腫瘤生長和促進其轉移,并引起化療耐受[3]。本研究發現,在缺氧時SMMC-7721細胞HIF-lα的表達強于常氧環境,并隨著時間延長而增加,這表明在持續缺氧條件下,腫瘤細胞可通過上調HIF-lα的表達來維持氧及代謝平衡,促進細胞生長,而這種表達趨勢也與相關文獻報道一致[14]。
本研究還發現,ABCG2和 HIF-1α在SMMC-7721細胞中的表達水平隨著缺氧信號的加強而呈現出一致的增高趨勢,且二者表達呈正相關。有關研究顯示,HIF-1α可調控40余種基因的表達,諸如MDR1便是其調控的靶基因之一[15],而MDR1基因編碼產物 P-糖蛋白(P-glycoprotein,P-GP)與 ABCG2同屬ABC轉運體家族,這就提示ABCG2是HIF-1α的下游目的基因,HIF-1α可上調ABCG2的表達。為了證明這一假設,本研究采用 HIF-1α抑制劑YC-1干預 HIF-1α的表達,發現隨著YC-1濃度的增加,HIF-1α的表達水平逐漸下降,更重要的是,ABCG2的表達亦逐漸降低,這表明ABCG2是HIF-1α的相關調控蛋白,缺氧對ABCG2的調控是通過HIF-1α的機制而實現的。
綜上所述,缺氧環境中,SMMC-7721細胞ABCG2和HIF-1α的表達上調,并隨時間延長而增加,YC-1抑制HIF-1α后可有效下調ABCG2的表達。本實驗表明缺氧時SMMC-7721細胞生存及耐藥的機制可能是通過缺氧誘導HIF-1α的表達而實現,后者上調ABCG2的表達,增強了腫瘤細胞對缺氧環境的適應能力及化療抵抗能力。抑制HIF-1α-ABCG2這一途徑有望成為治療肝癌以及逆轉肝癌患者耐藥的治療靶點。
[1] Cascorbi I,Haenisch S.Pharmacogenetics of ATP-binding cassette transporters and clinical implications [J].Methods Mol Biol,2010,596:95-121.
[2] Ding XW,Wu JH,Jiang CP.ABCG2:apotential marker of stem cells and novel target in stem cell and cancer therapy[J].Life Sci,2010,86(17/18):631-637.
[3] Rankin EB,Giaccia AJ.The role of hypoxia-inducible factors in tumorigenesis[J].Cell Death Differ,2008,15(4):678-685.
[4] Rademakers SE,Span PN,Kaanders JH,et al.Molecular aspects of tumour hypoxia[J].Mol Oncol,2008,2(1):41-53.
[5] Doyle LA,Yang W,Abruzzo LV,et al.A multidrug resistance transporter from human MCF-7breast cancer cells[J].Proc Natl Acad Sci U S A,1998,95(26):15665-15670.
[6] Ni Z,Bikadi Z,Rosenberg MF,et al.Structure and function of the human breast cancer resistance protein(BCRP/ABCG2)[J].Curr Drug Metab,2010,11(7):603-617.
[7] Ejendal KF,Hrycyna CA.Multidrug resistance and cancer:the role of the human ABC transporter ABCG2[J].Curr Protein Pept Sci,2002,3(5):503-511.
[8] Takahata T,Ookawa K,Suto K,et al.Chemosensitivity determinants of irinotecan hydrochloride in hepatocellular carcinoma cell lines[J].Basic Clin Pharmacol Toxicol,2008,102(4):399-407.
[9]Sharom FJ.ABC multidrug transporters:structure,function and role in chemoresistance[J].Pharmacogenomics,2008,9(1):105-127.
[10]趙大偉,殷曉煜,鄭進方,等.ABCG2蛋白在肝癌中表達的臨床意義[J].中華消化外科雜志,2010,9(3):213-215.
[11]Chiba T,Kita K,Zheng YW,et al.Side population purified from hepatocellular carcinoma cells harbors cancer stem cell-like properties[J].Hepatology,2006,44(1):240-251.
[12]Zhang N,Li R,Tao KS,et al.Characterization of a stemlike population in hepatocellular carcinoma MHCC97cells[J].Oncol Rep,2010,23(3):827-831.
[13]Krishnamurthy P,Ross DD,Takeo N,et al.The stem cell marker Bcrp/ABCG2enhances hypoxic cell survival through interactions with heme[J].J Biol Chem,2004,279(23):24218-24225.
[14]Kizaka-Kondoh S,Tanaka S,Hiroshi H,et al.The HIF-1-active microenvironment:An environmental target for Cancer therapy[J].Adv Drug Deliv Rev,2009,61(7/8):623-632.
[15]Cosse JP,Michiels C.Tumour hypoxia affects the responsiveness of Cancer cells to chemotherapy and promotes Cancer progression[J].Anticancer Agents Med Chem,2008,8(7):790-797.

