扁蕾不同部位的化學成分研究
羅洲飛,劉妮娜,徐彥軍,饒力群
(1.湖南農業大學生物科學技術學院,湖南 長沙 410128;2.中國科學院植物研究所北京植物園,北京 100093;3.中國農業大學理學院,北京 100193;4.中國科學院研究生院,北京 100049)
扁蕾(Herba Gentianopsis)為龍膽科植物扁蕾Gentianopsis barbata(Froel.)Ma 的全草,主要生長在高海拔的河灘、山坡草地及林緣地區,在我國主要分布于西南、內蒙古、河北、東北等地[1]。扁蕾在治療急性黃疸型肝炎、結膜炎、高血壓、急性腎盂腎炎、瘡癤腫毒、慢性肺源性心臟病等有廣泛的應用[2-3]。大興安嶺地區的扁蕾產量極少,民間藥用價值很高,已作為一種傳統蒙藥植物被廣泛運用,但其化學成分尚未見報道。為進一步研究其藥效成分,筆者對產于大興安嶺地區的扁蕾進行了化學成分的初步研究,并比較了不同部位的化學組成差異。李作平等[4]用色譜法和光譜法對扁蕾的化學成分進行了分析,其中主要成分為口山酮類。文章利用高效液相色譜-質譜聯用技術(HPLC-ESI-MSn)分離鑒定大興安嶺地區的野生扁蕾不同部位的口山酮類化學成分,為該藥材的品質評價和開發利用提供科學依據。
1 材料與方法
1.1 材料及試劑
1.1.1 供試材料 自然干燥的野生扁蕾全草,于2011年采自大興安嶺漠河(經度:124°07′ E,緯度:53°42′ N,海拔高度:576 m),經黑龍江大興安嶺地區農業林業科學院鑒定為龍膽科植物扁蕾,標本保存于中科院植物所植物園。
1.1.2 試 劑 乙腈和甲醇(色譜純)購于北京先明樂施科技發展有限公司;三氟乙酸(≥99%)購于德國Merck 公司(Darmstadt, Germany);甲醇(分析純)和甲酸(分析純)購自北京化工廠;HPLC 級水由Milli-Q 超純水系統(Millipore, Billerica,MA,USA)制備;黃酮醇標準品:蘆丁(純度91.7%)購自中國藥品生物制品檢定所。
1.2 化學成分提取
稱取扁蕾不同部位(花、葉、主莖、側枝、根)干燥粉末3 份,每份約100.00 mg,溶于10 mL 甲醇(甲酸的抽提溶劑),超聲提取30 min,離心(12 000 r/min,10 min),收集上清液。提取3 次后合并濾液,依次用濾紙及0.22 μm 的濾膜過濾。
1.3 定性分析及結構鑒定
采用Agilent 1100 LC/MSD Trap VL 液質聯用儀(HPLC-ESI-MSn)進行口山酮類化合物定性分析。色譜條件為:采用TSK gel ODS-80Ts QA(150 mm×4.6 mm,5 μm i.d.,Tosoh,Tokyo,Japan) 色譜柱,流動相組成:A 相為10%甲酸-水溶液;B 相為乙腈溶液,洗脫梯度為:0 min,10%B→20 min,22%B→65 min,60%B→70 min,10%B,檢測波長:330 nm,流速:0.8 mL/min,進樣量:10 μL,柱溫:25℃。質譜電離源采用電噴霧電離(ESI),分別在正離子和負離子模式下進行全掃描,掃描范圍:(m/z)100~1 000 μ。正離子模式下的質譜分析條件為:氮氣作為干燥和噴霧氣體,干燥溫度:350℃,氮氣流速:6.0 L/min,噴霧器壓力:241.3 KPa;毛細管電壓:3 500 KV,毛細管出口電壓:140 V;八級射頻電壓振幅:150 Vpp;skim 1 電壓:55.6 V,skim 2 電壓:6.0 V;cap exit offset:84.4 V。負離子模式下,參數設定值不同的為:毛細管出口電壓:-127.3 V;skim 1 電壓:-47.7 V,skim 2 電壓:-6.0 V;cap exit offset:-79.6 V。用LC/MSD Trap 軟件(5.2 版本)分析不同模式下的質譜數據。
1.4 定量分析
采用Dionex HPLC 系統對扁蕾中不同部位的化學成分進行定量分析。該系統包括P680 泵、TCC-100 自動控溫柱箱、PDA-100 光電二極管陣列檢測器及變色龍色譜工作站(Chromeleon,6.60版本)。色譜條件與化合物定性分析一致。利用標準品蘆丁分別對各化合物進行相對定量分析,重復3次,單位為每g 干燥扁蕾中含有的化合物mg 數。計算不同部位的各個組分含量,比較各部位之間不同化學成分的組成差異。
2 結果與分析
2.1 扁蕾化學成分的定性分析
利用HPLC-ESI-MSn 從扁蕾全株樣品中檢測出11 種主要化合物成分(圖1),各化合物的紫外可見吸收光譜和質譜數據如表1 所示。依據樣品HPLC 分析的保留時間、洗脫順序、紫外-可見吸收光譜和質譜信息,通過與參考文獻比較推定了各化合物的結構[5]。其中,正離子模式下的質譜數據為化合物的結構解析提供了更多信息。
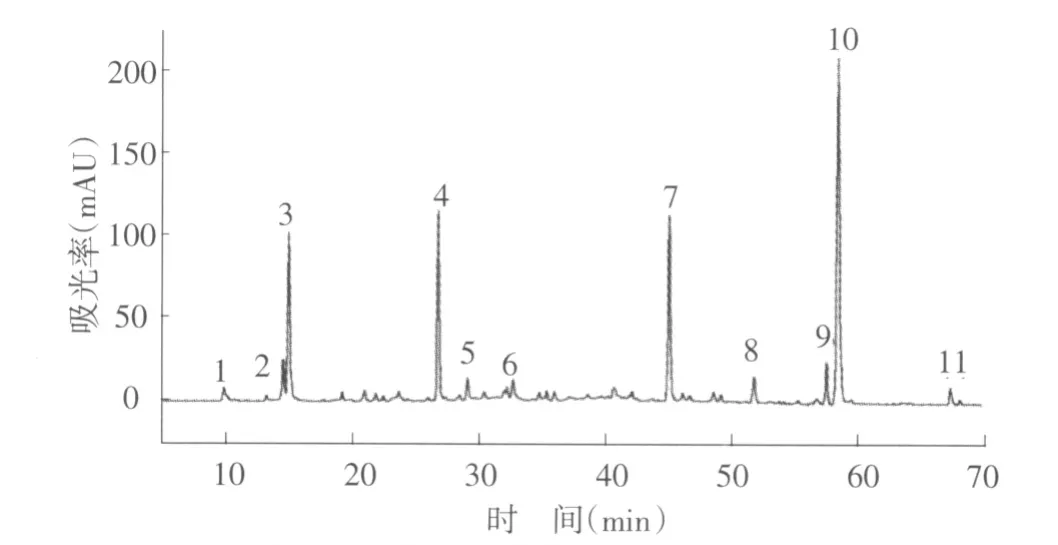
圖1 扁蕾全株化學組成成分HPLC 圖譜
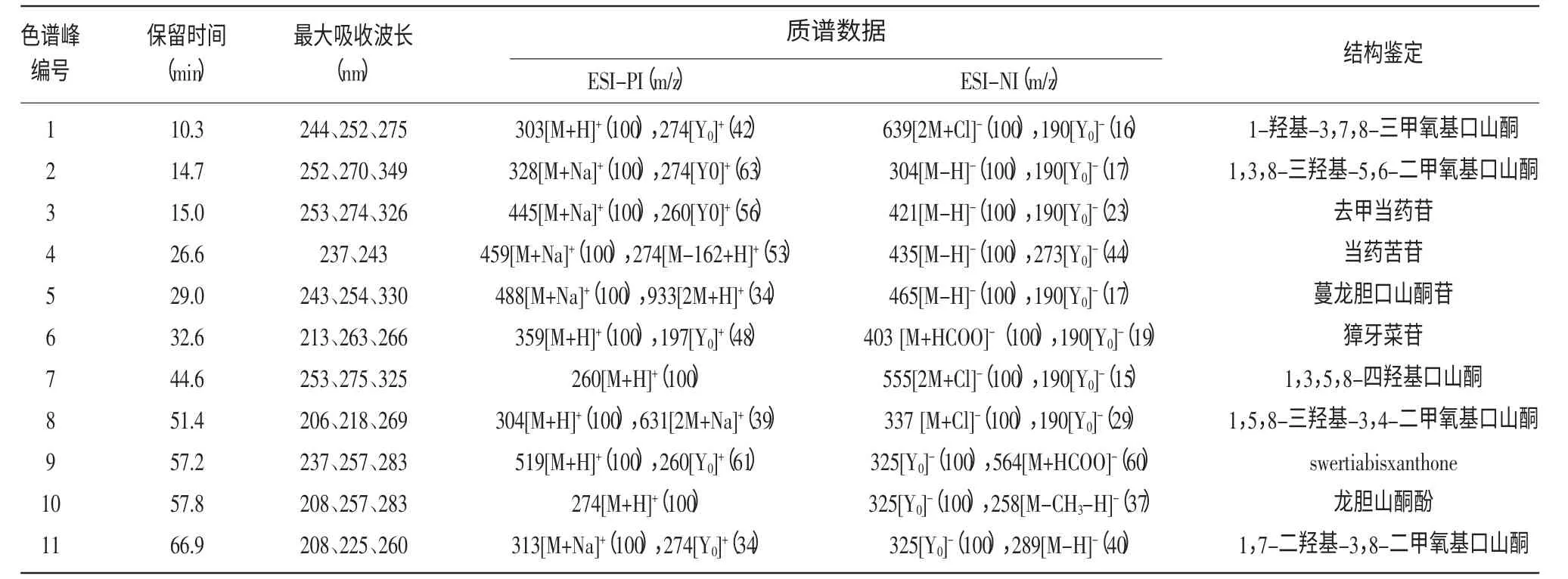
表1 扁蕾中化學成分的紫外-可見吸收光譜及ESI-質譜數據
組分1 在紫外吸收光譜中的最大吸收波長為244、252、275 nm,為較典型的口山酮特征吸收。正離子模式下檢測到分子離子m/z 303([M+H]+)和苷元碎片離子m/z 274([Y0]+),負離子模式下檢測到碎片離子m/z 639([2M+Cl]-),它與濕生扁蕾中的1-羥基-3,7,8-三甲氧基口山酮的裂解特征相同,因此推定組分1 為1-羥基-3,7,8-三甲氧基口山酮[6]。
組分2 在正離子模式下檢測到高豐度的加鈉分子離子m/z 328([M+Na]+),負離子模式下檢測到分子離子m/z 304([M-H]-),且碎片離子信息與文獻報道一致[7],由于缺乏更多的結構信息,暫推定組分2 為1,3,8-三羥基-5,6-二甲氧基口山酮。
組分3 在正離子模式下檢測到高豐度的加鈉分子離子m/z 445([M+Na]+),負離子模式下檢測到分子離子m/z 421([M-H]-),m/z 260 是苷元1,3,5,8-四羥基口山酮的特征質荷比[13]。其與去甲當藥苷的裂解特征相同,結合紫外數據,推定組分3 為去甲當藥苷,質譜信息和結構圖如圖2(a)所示[8]。
組分4 在正離子模式下檢測到苷元碎片離子m/z 274([M-162+H]+)及高豐度的加鈉分子離子m/z 459([M+Na]+),負離子模式下檢測到去質子分子離子m/z 273([Y0]-)和m/z 435([M-H]-),分子量是在苷元碎片離子(m/z 274)的基礎上加上一個己糖的分子量(162 u),再結合紫外可見吸收光譜數據,推定組分4 為當藥苦苷[9],質譜信息和結構圖如圖2(b)所示。
組分5 在正離子模式下得到加納分子離子m/z 488([M+Na]+),負離子模式檢測到顯著的分子離子m/z 465([M-H]-),且紫外光譜在243、254、330 nm處出現特征吸收,結合文獻報道,推定組分5 為蔓龍膽口山酮苷[10]。
組分6 的紫外光譜在263 nm、266 nm 處出現肩峰,為環烯醚萜苷類化合物的特征吸收峰,正譜數據為分子離子m/z 359([M+H]+)及苷元原子m/z 197([Y0]+),負譜數據為m/z 403([M+HCOO]-)及碎片離子m/z 190([Y0]-),與文獻中獐牙菜苷的數據一致,因此,推定組分6 為獐牙菜苷[11]。
組分7 的質譜數據為正離子模式下高豐度分子離子m/z 260([M+H]+),m/z 260 是1,3,5,8-四羥基口山酮的特征質荷比[12]。負離子模式下也檢測到碎片離子m/z 555([2M+Cl]-),結合紫外吸收數據,推定峰7 為1,3,5,8-四羥基口山酮,質譜信息和結構圖如圖2(c)所示。
組分8 的紫外吸收為206、218、269 nm,可知組分8 為口山酮類化合物的五氧取代類型,正離子模式下含有碎片離子m/z 631([2M+Na]+)和分子離子m/z 304([M+H]+),負離子模式下檢測到m/z 337([M+Cl]-)。口山酮類化合物若只有羥基和甲氧基取代,其不飽和度為10,故推測其分子組成為C15H12O6,通過與文獻的光譜數據進行比較,可推定峰8 為1,5,8-三羥基-3,4-二甲氧基口山酮[13]。
峰9 正離子模式下檢測到顯著的分子離子m/z 519([M+H]+),負離子模式下也檢測去質子分子離子m/z 564([M+HCOO]-)和碎片離子m/z 325([Y0]-),紫外最大吸收為237、257、283 nm,峰9 的質譜信息與從大籽獐牙菜分離到的新口山酮類化合物Swertiabisxanthone 一致,由于缺乏更多的信息,暫推定組分9 為Swertiabisxanthone[14-15]。

圖2 扁蕾中4 種主成分的正譜質譜圖和結構圖
組分10 正離子模式下檢測到顯著的分子離子m/z 274([M+H]+),負離子模式下檢測到去甲基碎片離子m/z 258([M-CH3-H]-),m/z 274 是龍膽山酮酚的特征質荷比,再結合其在色譜柱中的洗脫順序和紫外可見吸收光譜數據,故確定組分10 為龍膽山酮酚[15],質譜信息和結構圖如圖2(d)所示。
組分11 在紫外吸收光譜中的最大吸收波長為208、225、260 nm,且為口山酮類化合物的四氧取代類型。正離子模式下檢測到加納分子離子峰m/z 313([M+Na]+)和碎片離子m/z 274([Y0]+),負離子模式下檢測到苷元離子m/z 289([M-H]-),與文獻的光譜數據進行比較,推定組分11 為1,7-二羥基-3,8-二甲氧基口山酮[2,16]。
2.2 扁蕾不同部位中化合物定量分析
扁蕾不同部位化合物的含量差異如表2 所示。其中去甲當藥苷、當藥苦苷、1,3,5,8-四羥基口山酮和龍膽山酮酚為扁蕾的4 種主要組成成分。扁蕾各部位的口山酮類化合物總含量的分布狀態為:花>葉>側枝>主莖>根,含量最多的為花器官,根中含量很低。
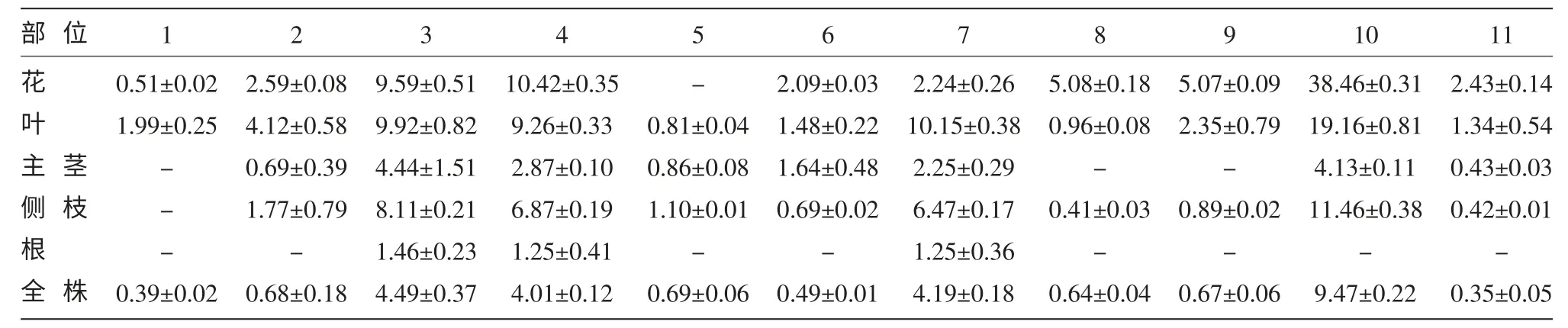
表2 扁蕾不同部位的組成成分分析 (mg)
3 小結與討論
通過高效液相色譜-質譜聯用技術(HPLCESI-MSn)檢出了大興安嶺地區產傳統蒙藥扁蕾不同部位的化學成分共11 種化合物,其中9 種化合物首次從扁蕾中檢測到。扁蕾不同部位的化合物定量分析結果表明,檢出的11 種化合物中,去甲當藥苷、當藥苦苷、1,3,5,8-四羥基口山酮和龍膽山酮酚為扁蕾的4 種主要組成成分;口山酮類總含量分布狀態為:花>葉>側枝>主莖>根,地上部分口山酮種類豐富,與地下部分化學成分存在顯著差異,建議以扁蕾地上部分入藥。這為闡明將扁蕾開發成治療藥物及應用的最佳藥用部位提供了客觀可靠的理論依據,為該藥材的品質評價和開發利用提供科學參考。
[1]Yuan Y M, Küpfer P.Karyological Studies of Gentianopsis Ma and Some related genera of Gentianaceae from China[J].Cytologia., 1993, 58:115-123.
[2]Ding L, Liu B, Qi L L, et al.Anti-proliferation, cell cycle arrest and apoptosis induced by a natural xanthone from Gentianopsis paludosa Ma, in human promyelocytic leukemia cell line HL-60 cells[J].Toxicol.in Vitro, 2009, 23:408-417.
[3]王煥弟,譚成玉,杜昱光,等.藏藥濕生扁蕾的化學成分研究[J].中國中藥雜志,2004,29(11):1055-1056.
[4]李作平,霍長虹,鄭小莉.扁蕾化學成分的研究[J].中國現代應用藥學,2003,20(1):24-25.
[5]Yang L G, Wang Y, Wang L X.et al.Rapid quantication of iridoid glycosides analogues in the formulated Chinese medicine Longdan Xiegan Decoction using high-performance liquid chromatography coupled with mass spectromentry[J].J.Chromatogr.A, 2009, 1216:2098-2103.
[6]米 琴,曹長年,趙宙興,等.藏藥濕生扁蕾有效成分的研究[J].青海師范大學學報(自然科學版),2005,(2):64-66.
[7]Aberhama A, Pieri V, Croom Jr.E.M.et al.Analysis of iridoids,secoiridoids and xanthones in Centaurium erythraea, Frasera caroliniensis and Gentiana lutea using LC-MS and RP-HPLC[J].J.Pharm.Biomed.Anal., 2011, 54:517-525.
[8]Urbain A, Marston A, Marsden-Edwardsb E.et al.Ultra-performance Liquid Chromatography Time-of-flight Mass Spectrometry as a Ch emotaxonomic Tool for the Analysis of Gentianaceae Species[J].Phytochem.Anal.2008, 20:134-138.
[9]許旭東,楊峻山.毛獐芽菜苷口山酮化學成分研究[J].中國藥學雜志,2005,9:657-659.
[10]Hideaki O.Triptexanthosides A-E: Xanthone glycosides from aerial parts of Tripterospermum japonicum[J].Chem.Pharm.Bull., 1999, 47(7):962-965.
[11]Ye J, Zhang X, Dai W X.et al.Chemical fingerprinting of Liuwei Dihuang Pill and simultaneous determination of its major bioactive constituents by HPLC coupled with multiple detections of DAD, ELSD and ESI-MS[J].J.Pharm.Biomed.Anal., 2009, 49:638-645.
[12]周 青,陳家春,劉焱文.貴州獐牙菜化學成分研究[J].中藥材,2004,27(12):908-910.
[13]Qiao X, Ye G, Liu C F.et al.Chemical analysis of Eriocaulon buergerianum and adulterating species by high-performance liquid chromatography with diode array detection and electrospray ionization tandem mass spectrometry[J].J.Pharm.Biomed.Anal.,2012, 57:133-142.
[14]Zhou H, Liu Y L, Blasko G.et al.Swertiabisxanthone-I from swertia –macrosperma[J].Phytochem., 2008, 12:3569-3571.
[15]Li M H, Li L, Yang Y M.et al.Genus Gentianella moench: a phytochemical and ethnopharmacological review[J].Chinese Herbal Med., 2010, 2(4):262-271
[16]Wang Z G, Ma C M, Tang S H.et al.Qualitative and quantitative analysis of swertia herbs by High Performance Liquid Chro -matography-Diode Array Detector-Mass Spectrometry (HPLCDAD-MS)[J].Chem.Pharm.Bull., 2008, 56(4):485-490.

