不同SO2添加量的草莓發酵微生物種群及理化特性動態測定
張 麗 娜, 孫 玉 梅, 曹 方, 何 丹
( 大連工業大學 生物工程學院, 遼寧 大連 116034 )
0 引 言
草莓屬薔薇科多年生草本植物,營養豐富[1],具有保健功能[2]。草莓酒精發酵過程伴隨微生物群落復雜短暫的動態變化[3],這些微生物包括水果表面和釀酒設備中的細菌和酵母菌[4],并不是單一菌屬或單一菌株[5]。影響草莓酒發酵過程中微生物種群數量的因素有很多,如草莓品種,果實的部位,生產工藝,初始細胞濃度,溫度和SO2等[6]。SO2作為抑菌劑,可選擇性地抑制不利于草莓酒精發酵的微生物,保證發酵順利進行。有學者認為游離SO2通過主動運輸或自由擴散的形式被非釀酒酵母菌吸收,通過擾亂其基本的生物途徑而起到抑菌作用[7-8]。還有研究認為,酒醪中加入SO2后,酵母菌處于不可培養的狀態但仍有活性[9]。但到目前為止,SO2對草莓酒精發酵過程中微生物種群變化的影響尚未見報道。
本工作采用平板涂布培養法研究了不同SO2添加量的酵母強化草莓發酵過程中微生物種群數量的動態變化,測定了草莓發酵醪的還原糖、可溶性固形物、滴定酸、游離SO2和總SO2的含量以及pH等相關參數。
1 實 驗
1.1 材料與試劑
草莓,豐香草莓,購于大連果品市場;酵母菌,本實驗室篩選自草莓自然發酵醪,經鑒定為裂殖酵母屬[10];果膠酶,酶活力200萬U/g,河南洛陽夏盛果汁果膠酶有限公司;亞硫酸,天津市科密歐化學試劑有限公司。
1.2 酵母菌種子液的制備
一級種子液:從YEPD斜面上挑取2環酵母菌,接入5 mL 10%的葡萄糖溶液中,于30 ℃靜置培養24 h。
二級種子液:將一級種子液接入100 mL的草莓汁中,于30 ℃搖床培養12~16 h,使酵母菌數達到1.5×108~2.0×108cells/mL。
1.3 酵母強化的草莓發酵過程
選擇無病斑的草莓,手工去萼,壓榨取汁,添加0.05%的果膠酶,45 ℃酶解90 min。取300 mL酶解后的草莓漿裝入無菌的500 mL三角瓶中,分別調整漿液中SO2質量濃度為0、60、120、180、240 mg/L。按5%接種量接入酵母菌二級種子液,于25 ℃發酵14 d。
1.4 微生物種群數量測定
1.4.1 培養基
細菌培養采用肉湯培養基,酵母菌采用YEPD培養基,霉菌采用察氏培養基;乳酸菌培養基:蛋白胨1%、牛肉膏1%、酵母膏0.5%、K2HPO4·3H2O 0.2%、乙酸鈉0.5%、葡萄糖2%、吐溫80 0.1%、檸檬酸二鈉0.2%、MgSO4·7H2O 0.058%、MnSO4·4H2O 0.025%、瓊脂1.8%、pH 6.2~6.4;醋酸菌培養基:葡萄糖1%、酵母膏1%、碳酸鈣2%、無水乙醇3%、瓊脂1.8%、50 mg/L制霉菌素,pH自然[11]。
1.4.2 微生物種群數量測定
在草莓發酵過程中,定期采集上、下層發酵醪樣品,用稀釋平板涂布法分別對不同微生物進行培養,定期觀測微生物種群數量。
1.5 理化分析
1.5.1 取樣方法
在草莓發酵過程中,定期采集均勻的發酵醪樣品,分別進行不同理化指標的測定。
1.5.2 測定方法
還原糖測定:采用菲林滴定法[12];可溶性固形物測定:利用WHT-5型手持糖量折光儀;滴定酸測定:采用酸堿滴定法[12];pH測定:利用PHS-3C型pH計;酒精度測定:采用蒸餾比重法[12];游離SO2及總SO2測定:采用直接碘量法[12]。
2 結果與討論
2.1 酵母強化的草莓發酵醪的微生物種群變化
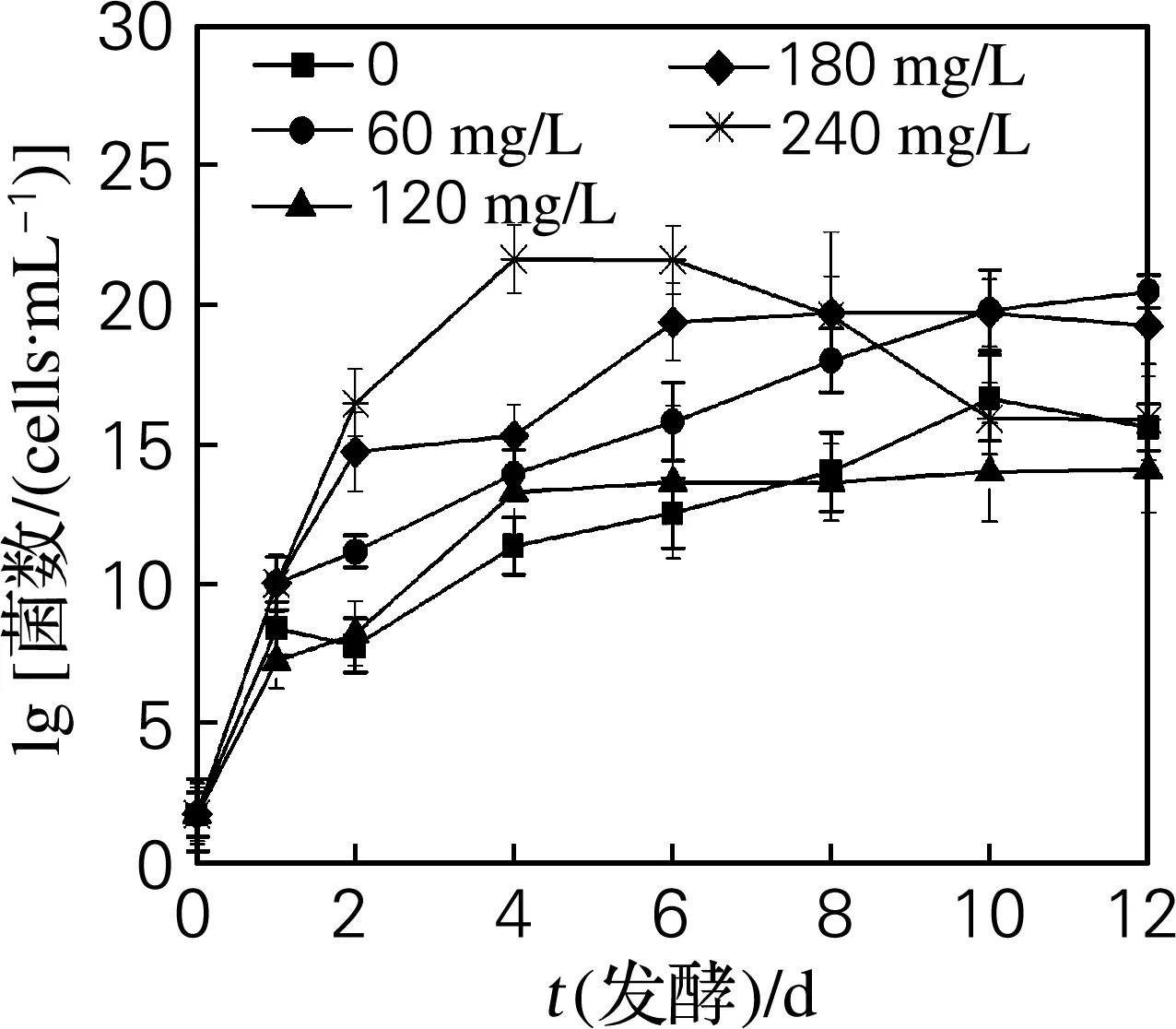
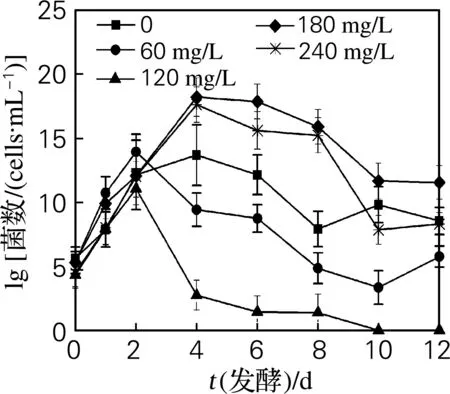
定期從不同SO2添加量的草莓發酵醪上、下層取樣,分別測定酵母菌、細菌和霉菌的數量,結果如圖1~3所示。
草莓屬溫濕性植物,生長環境決定草莓鮮果表面附有大量的酵母菌、細菌和霉菌[13]。由圖1~3可見,發酵醪上、下層的酵母菌、細菌、霉菌各自的生長曲線均相似,只是數量有所不同。在發酵初期,發酵醪上層酵母菌和細菌可利用的氧氣(醪中溶解氧以及液面上的氣態氧)充足,得以快速繁殖,數量較下層多;在發酵后期,液面上的氣態氧被較多消耗,上、下層的酵母菌和細菌可利用的氧氣量差別不大,表現出數量差別不大。在發酵初期的發酵醪中,營養物質和溶解氧較多,酵母菌和細菌的數量較快增多。發酵4~6 d后,營養物質消耗和代謝產物積累等環境變化使酵母菌進入生長穩定期,細菌的數量逐漸減少。這與李子自然發酵過程的菌群變化相似[6]。草莓發酵醪中的少量霉菌則快速減少直至消失,其中在發酵醪下層比在上層消失提前2天,估計也是可利用氧氣量的差別所致。未檢測到醋酸菌和乳酸菌。

(a) 上層發酵醪
(b) 下層發酵醪
圖1 不同SO2添加量草莓發酵醪中酵母菌數量的變化
Fig.1 Changes of yeast numbers in strawberry fermentation mash with various SO2concentration
(a) 上層發酵醪

(a) 上層發酵醪
以上實驗結果說明,在酵母強化發酵的草莓發酵醪中,酵母菌是發酵體系中的優勢菌,而細菌和霉菌在多方面競爭力較弱。在發酵醪中添加60 mg/L SO2,對相對好氧的(發酵醪上層)細菌有抑制作用,而對酵母菌和相對厭氧的(發酵醪下層)細菌抑制作用不明顯;添加120 mg/L SO2對細菌的抑制作用明顯,而對酵母菌生長無抵制作用。
2.2 酵母強化的草莓發酵醪的還原糖質量濃度與可溶性固形物質量分數的變化
可溶性固形物質量分數的變化可反映發酵程度。由圖4、5可知,在不同SO2添加量的草莓發酵醪中,可溶性固形物質量分數均呈下降趨勢。添加0~120 mg/L SO2的發酵醪中還原糖質量濃度先升高后減少,因為加入的蔗糖在酸性環境下水解,導致還原糖質量濃度升高,而后酵母菌利用了大量糖進行發酵使還原糖質量濃度急劇下降。添加60 mg/L SO2的發酵醪可溶性固形物質量分數下降速度最快,發酵初期還原糖質量濃度上升幅度小,與其他SO2添加量相比,此時酵母菌數量較多,較多利用了還原糖。添加180和240 mg/L SO2時,酵母菌和細菌數量最多,利用了大量還原糖,使還原糖質量濃度無升高趨勢。
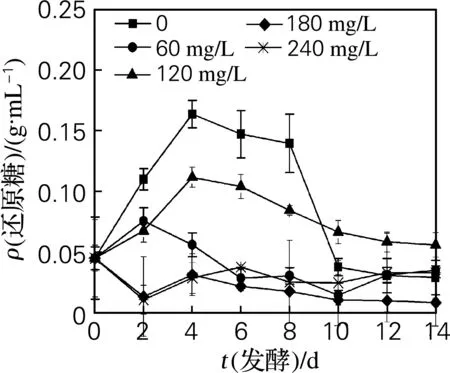
圖4 不同SO2添加量草莓發酵醪中還原糖質量濃度的變化
Fig.4 Changes of reducing sugar in strawberry fermentation mash with various SO2concentration

圖5 不同SO2添加量草莓發酵醪中可溶性固形物質量分數的變化
Fig.5 Changes of soluble solid in strawberry fermentation mash with various SO2concentration
2.3 酵母強化的草莓終發酵醪的酒精體積分數
表1顯示,草莓發酵醪的酒精體積分數與SO2添加量有關。較高濃度SO2對發酵體系中雜菌有較強的抑制作用,有利于酵母菌成為優勢菌并進行酒精發酵。但SO2質量濃度高于120 mg/L 時,因為酵母菌利用發酵醪中的營養物質進行大量繁殖,對酒精發酵有一定的抑制作用,使草莓發酵醪的酒精體積分數較低。
表1 不同SO2添加量的草莓終發酵醪中的酒精體積分數
Tab.1 Ethanol content in strawberry fermentation mash with various SO2concentration
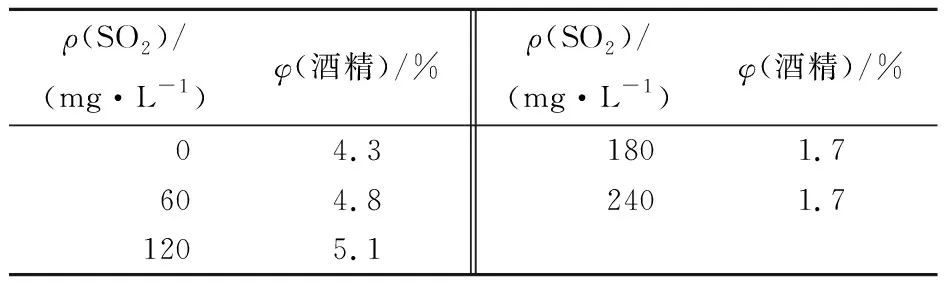
ρ(SO2)/(mg·L-1)φ(酒精)/%ρ(SO2)/(mg·L-1)φ(酒精)/%04.31801.7604.82401.71205.1
2.4 酵母強化的草莓發酵醪的pH與滴定酸質量濃度的變化
如圖6、7所示,在發酵過程中,不同SO2添加量的發酵醪pH的變化規律相似,變化幅度均較小。隨著SO2添加量增大,發酵醪pH減小,但添加0~60 mg/L SO2對發酵醪pH的影響無顯著差別。發酵前2天,不同SO2添加量的發酵醪中滴定酸質量濃度升高,發酵中期,只有添加120 mg/L SO2的發酵醪中滴定酸質量濃度又有升高。與其他SO2添加量的測定結果比,添加180和240 mg/L SO2的發酵醪pH較低,但滴定酸質量濃度也較低,其原因有待于進一步探討。
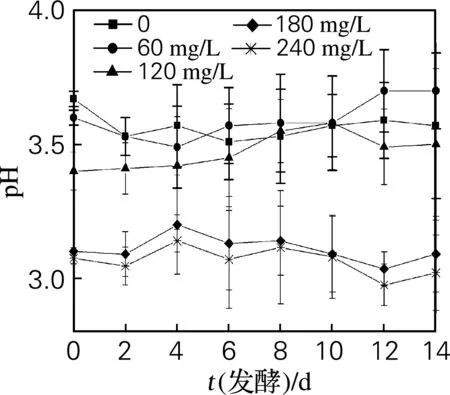
圖6 不同SO2添加量的草莓發酵醪的pH變化
Fig.6 pH changes of strawberry fermentation mash with various SO2concentration

圖7 不同SO2添加量的草莓發酵醪中滴定酸質量濃度的變化
Fig.7 Changes of titratable acid in strawberry fermentation mash with various SO2concentration
2.5 酵母強化的草莓發酵醪的游離SO2與總SO2質量濃度的變化
由圖8、9可知,在草莓發酵過程中,發酵醪的總SO2質量濃度始終呈下降趨勢;游離SO2質量濃度在發酵的前24 h迅速下降,之后趨于穩定,但添加180和240 mg/L SO2的發酵醪游離SO2質量濃度較高。在酵母菌快速生長期間,會向胞外分泌乙醛,厭氧和低pH有利于酵母菌生成乙醛[7,14],乙醛等羰基化合物能與活性SO2結合形成復合物使游離SO2減少;pH也會影響SO2的電離平衡,pH越低,游離SO2質量濃度越大[15]。綜合作用的結果導致總SO2和游離SO2的質量濃度變化。

圖8 不同SO2添加量的草莓發酵醪中游離SO2質量濃度變化
Fig.8 Changes of free-SO2in strawberry fermentation mash added various SO2concentration

圖9 不同SO2添加量的草莓發酵醪中總SO2質量濃度變化
Fig.9 Changes of total-SO2in strawberry fermentation mash added various SO2concentration
3 結 論
草莓發酵過程是一個復雜的微生物種群變化及生化反應過程,微生物在發酵過程中相互協作、相互制約。添加SO2影響發酵體系中微生物種群的動態變化,進一步引起草莓發酵過程的理化指標改變。添加60 mg/L SO2僅對相對好氧的細菌有抑制作用,添加120 mg/L SO2對細菌的抑制作用明顯,添加180和240 mg/L SO2時草莓酒精發酵水平較低。在發酵過程中,添加0~120 mg/L SO2的發酵醪中還原糖質量濃度先升高后減少,添加180和240 mg/L SO2時發酵醪中還原糖質量濃度無變化,不同SO2添加量的發酵醪中可溶性固形物質量分數均呈下降趨勢,滴定酸質量濃度和pH變化幅度均較小。
[1] QIN Yonghua, JAIME A, ZHANG Lingxiao, et al. Transgenic strawberry:State of the art for improved traits[J]. Biotechnology Advances, 2008, 26:219-232.
[2] 馬子俊,林瑛影,王陽光,等. 草莓釀酒特性和人工加糖發酵工藝的研究[J]. 食品科學, 2003, 24(5):102-106.
[3] CHANPRASARTSUK O, PRAKITCHAIWATTANA C, SANGUANDEEKUL R, et al. Autochthonous yeasts associated with mature pineapple fruits, freshly crushed juice and their ferments; and the chemical changes during natural fermentation[J]. Bioresource Technology, 2010, 101(19):7500-7509.
[4] NYANGA L K, NOUT M J, GADAGA T H, et al. Yeasts and lactic acid bacteria microbiota from masau (Ziziphusmauritiana) fruits and their fermented fruit pulp in Zimbabwe[J]. International Journal of Food Microbiology, 2007, 120(1/2):159-166.
[6] SATORA P, TUSZYNSKI T. Biodiversity of yeasts during plum Wegierka Zwykla spontaneous fermentation[J]. Food Technology and Biotechnology, 2005, 43(3):277-282.
[9] DIVOL B, STREHAIANO P, LONVAUD-FUNEL A. Effectiveness of dimethyl dicarbonate to stop alcoholic fermentation in wine[J]. Food Microbiology, 2005, 22:169-178.
[10] 呂慧威,孫玉梅,蘆明春,等. 自選酵母菌株草莓酒發酵特性比較[J]. 食品科學, 2010, 31(11):197-201.
[11] 杜連祥,路福平. 微生物學實用技術[M]. 北京:中國輕工業出版社, 2005:349-355.
[12] 全國食品工業標準化技術委員會. GB/T 15038-1994葡萄酒、果酒通用試驗方法[S]. 北京:中國標準出版社, 1994.
[13] 潘見,黃訓端,謝慧明,等. 草莓采后衛生微生物學檢查及細菌VITEK鑒定實驗[J]. 食品科學, 2007, 28(3):320-323.
[14] 魏運平. 葡萄酒釀造中乙醛的形成及其重要作用[J]. 釀酒科技, 2003(2):77-78.
[15] 莫海珍,張浩,李華. SO2及其他環境因子對蘋果酸-乳酸細菌的影響[J]. 釀酒科技, 2003(5):70-72.

