長葉點地梅愈傷組織誘導和植株再生
張彥妮,陳素波
(東北林業大學園林學院,黑龍江 哈爾濱150040)
長葉點地梅(Androsace longifolia)又稱矮葶點地梅,為報春花科點地梅屬多年生草本,葉叢生,線性,灰綠色,花冠白色,喉部紫紅色,5月開花[1]。點地梅屬約有100種,分布于北半球溫帶,其中青藏高原地區和歐洲的阿爾卑斯山脈是該屬的兩個分布中心。中國有73種,7變種,主要分布在青藏高原,有部分種類分布在西北至內蒙古、東北以及秦嶺以南各省區。長葉點地梅的植株較矮小,單朵花雖小,但花色清新,開花較早,具有很高的觀賞價值。長葉點地梅的葉呈叢生狀,鋪地,適應性較強,能夠在中國東北、內蒙古、蒙古高原[2],草原、半干旱石質山地的油松-沙棘混交林林下[3],多石質山坡生長,可用于巖石園、園林地被及盆栽觀賞及灌木叢旁作地被材料。長葉點地梅還具有一定的生態效益,可以降低地表濕度、減少塵土飛揚和防止水土流失,因而它又是一種不可多得的草坪植物和優良的地被植物,對豐富東北地區景觀植物多樣性、推動園林事業以及綠地建設具有一定的實用價值。同時,野生花卉是構成多樣化的生態環境和自然植被的重要組成部分,也是研究和培育花卉新品種的重要種源和進行園林綠化的優秀材料[4]。
長葉點地梅雖有諸多優勢,但目前園林應用極少,同時隨著生存環境的惡化,其生存狀況不斷受到威脅,資源受到破壞。快繁技術是保護野生花卉種質資源的有效途徑之一,但點地梅屬植物組織培養方面的研究迄今還是很少。聶勇[5]對點地梅葉片進行了愈傷組織的誘導,李承花等[6]采用層析法對點地梅的化學成分進行分離純化,秦向菁[7]對點地梅進行了藥理分析試驗認為點地梅在抗腫瘤方面具有一定作用。而對于野生花卉長葉點地梅的相關研究卻鮮見報道,因此本試驗對長葉點地梅進行愈傷組織誘導和再生體系的建立,以期為長葉點地梅種質資源的保護、園林應用和培育新品種等奠定基礎。
1 材料與方法
1.1 材料 本試驗的研究材料為長葉點地梅無菌實生苗。
1.2 方法
1.2.1 不同培養基對長葉點地梅下胚軸愈傷誘導的影響 將培養皿中萌發的長葉點地梅轉接于添加不同激素6-BA(0、0.1、0.3mg·L-1)、NAA(0、0.1 mg·L-1)的MS培養基中,每組20株,觀察生長狀況,30d后統計生長狀況及誘導率。
1.2.2 愈傷組織的誘導及增殖 試驗中長葉點地梅的愈傷組織有兩種來源:一種是由葉片誘導而來;另一種是由萌發苗下胚軸基部產生。將葉片切為0.5 cm左右的小塊,接到添加不同種類、不同濃度的TDZ(0.1、0.2、0.3mg·L-1)、NAA(0.01、0.02、0.03mg·L-1)的MS培養基中,進行愈傷組織誘導,之后選擇最佳培養基進行愈傷繼代增殖。將兩種不同的愈傷組織繼代兩次(每次周期為30d),下胚軸產生愈傷后,將愈傷組織與苗分離后再進行繼代增殖,之后進行愈傷組織的分化。30d后統計分化外植體數、誘導率和形態指標。
1.2.3 愈傷組織的分化與植株再生 將繼代后的愈傷組織轉接到添加不同激素的6-BA(0.5、1.0、2.0 mg·L-1)、NAA(0.1、0.2、0.4mg·L-1)分化培養基中,待分化出芽后,將芽接入芽伸長培養基中,芽伸長培養基為 MS+0.1mg·L-16-BA+0.2 mg·L-1KT。30d后統計愈傷分化數、分化率和平均分化芽數。
1.2.4 組培苗的生根及移栽 參照葛蓓孛[8]的移栽法,將幼苗在生根培養基中進行生根培養。生根培養基為添加不同濃度IBA(0.5、1.0、2.0mg·L-1)的MS和1/2MS培養基中,兩種培養基均加入1 g·L-1的活性炭,每組20株苗,待根長為3~4cm時,將小苗移出組培室,在溫室中不打開封口膜放置4~5d,讓組培苗適應溫度的變化,然后半開封口膜緩苗3d,再將小苗取出,用自來水沖洗掉附著在根上的培養基,將苗移栽于基質中(基質為已滅菌的蛭石),30d后統計平均苗根數、平均根長、生根率、成活率及生長狀況。本試驗無特殊說明外,均為MS培養基,pH 值為5.8,高壓滅菌(1.1MPa,121 ℃)15min。
1.2.5 數據統計

2 結果與分析
2.1 不同培養基對長葉點地梅下胚軸愈傷誘導的影響 植株在不同培養基上的生長狀況不同。在不加激素的培養基中植株葉片發黃,長勢一般,植株下胚軸基部無愈傷組織產生,但有極少量根發生,而在添加不同濃度6-BA的培養基中,植株葉片呈綠色或黃綠色,植株下胚軸基部有愈傷產生;只添加NAA的植株也有少量根產生,無愈傷產生,說明NAA有利于無菌苗根的發生。其中產生大量愈傷、長勢好的培養基為 MS+0.3mg·L-16-BA+0.1mg·L-1NAA,誘導率達85%(表1)。本試驗獲得的植株下胚軸基部的愈傷組織可作為愈傷誘導芽的材料。
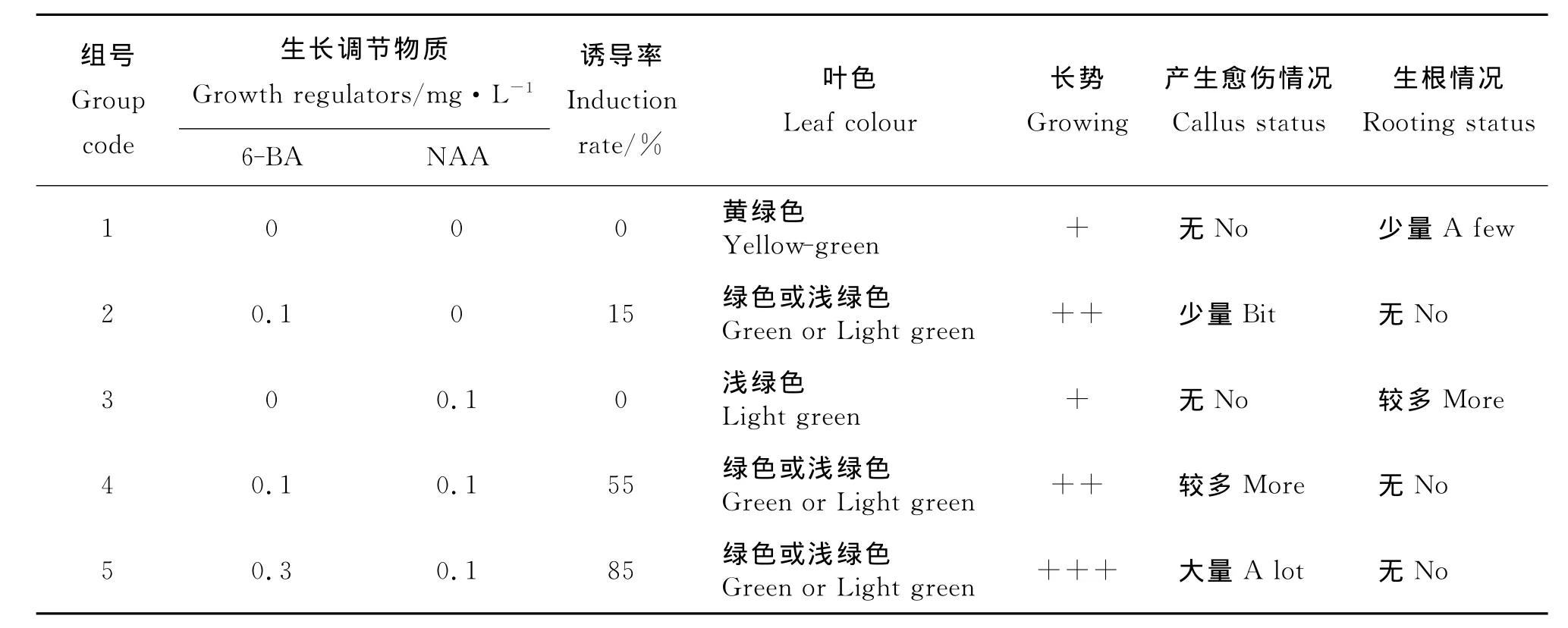
表1 不同培養基對長葉點地梅下胚軸愈傷誘導的影響Table 1 Effects of various mediums on hypocotyl callus induction
2.2 葉片愈傷組織的誘導及繼代 不同濃度TDZ和NAA組合對長葉點地梅葉片愈傷組織誘導的影響顯著(表2)。無激素的MS培養基不能誘導葉片愈傷組織,在添加不同濃度NAA和TDZ組合的培養基中誘導葉片愈傷組織大部分呈綠色,結構緊實的愈傷長勢一般,結構疏松的愈傷長勢相對較好。當NAA濃度為0.02mg·L-1、TDZ濃度為0.3mg·L-1時,愈傷啟動期為12d,愈傷顏色為淡綠色,結構疏松,長勢好,誘導率達80%;所以誘導葉片愈傷的最佳NAA和TDZ組合為0.02 mg·L-1NAA +0.3mg·L-1TDZ。
2.3 愈傷組織誘導再生芽 以兩種來源不同的愈傷組織誘導芽分化,結果表明(表3),苗基部愈傷組織的分化率明顯大于由葉片誘導的愈傷。當6-BA濃 度 為 1.0mg·L-1、NAA 濃 度 為 0.2 mg·L-1時,葉片愈傷的分化效果最好,分化率為82.5%,平均分化芽數為4.3。當6-BA濃度為0.5 mg·L-1、NAA濃度為0.2mg·L-1時,苗基部愈傷的分化效果最好,分化率為92.5%,平均分化芽數為6.1。來自下胚軸的愈傷組織的平均分化芽數高于葉片愈傷平均分化芽數,主要是由于下胚軸的胚性愈傷形成率高于葉片的胚性愈傷形成率。因此,苗下胚軸基部愈傷為誘導芽的最佳愈傷,最佳激素比為0.5mg·L-16-BA+0.2mg·L-1NAA。
2.4 組培苗的生根及移栽 將在芽伸長培養基上生長為3~4cm的無菌苗轉接到生根培養基中,進行生根誘導。在生根試驗中發現(表4),添加不同濃度IBA的MS和1/2MS兩種培養基,前者的生根率均達到100%,移栽后的成活率及狀況相對最好;前者的平均苗根數最多為7.3,平均根長最長為2.7,成活率達95%,移栽后植株長生新葉較多,后者的平均苗根數最多為4.9,平均根長最長為1.8,成活率達89.5%,移栽后產生的新葉相對較少。因此,組培苗的最佳生根培養基為 MS+1.0mg·L-1IBA。
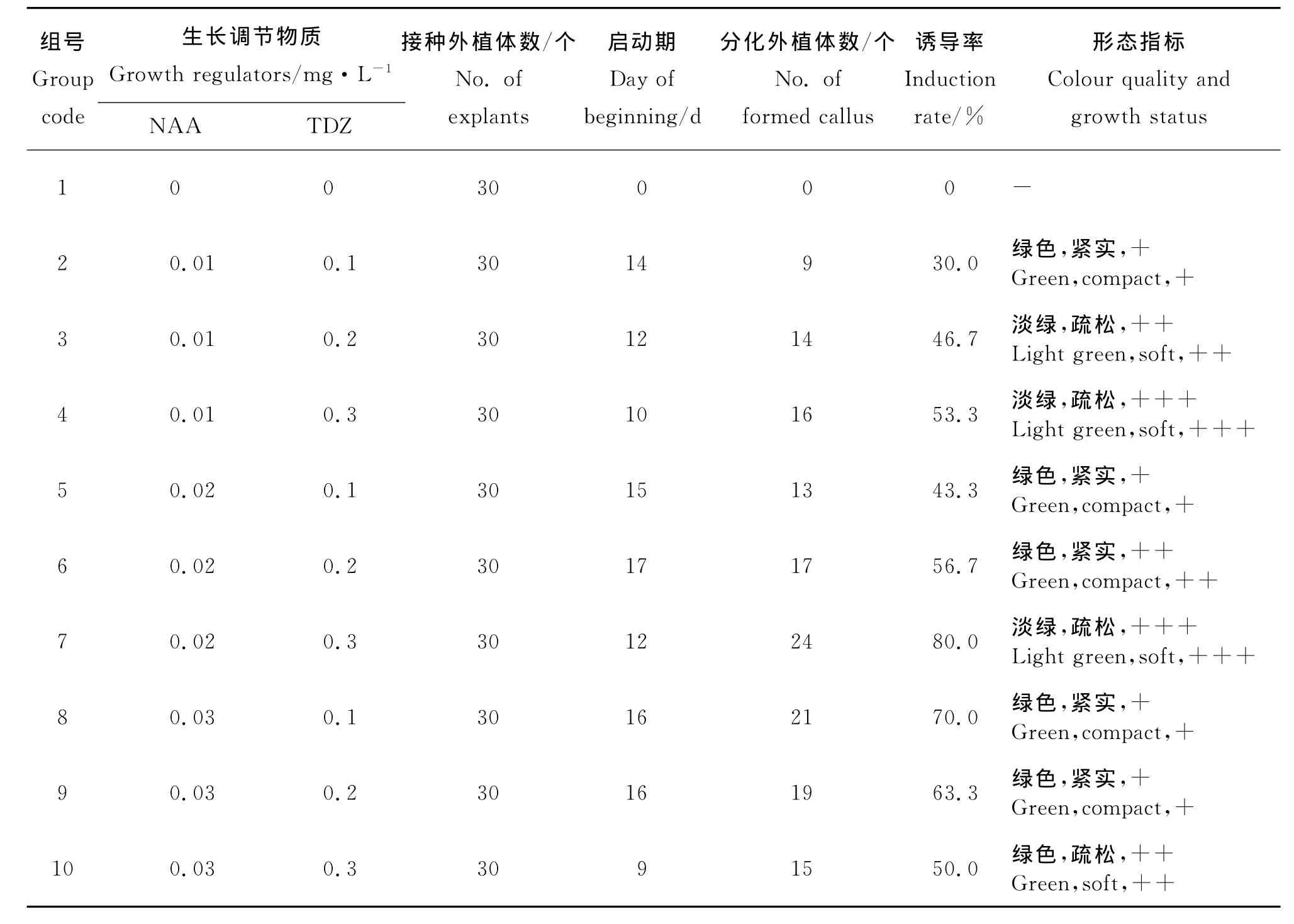
表2 不同濃度TDZ和NAA組合對長葉點地梅葉片愈傷組織誘導的影響Table 2 Effects of different combinations of TDZ and NAA on callus induction from leaf

表3 不同濃度6-BA和NAA組合對愈傷誘導芽的影響Table 3 Effects of different combinations of 6-BA and NAA on bud induction
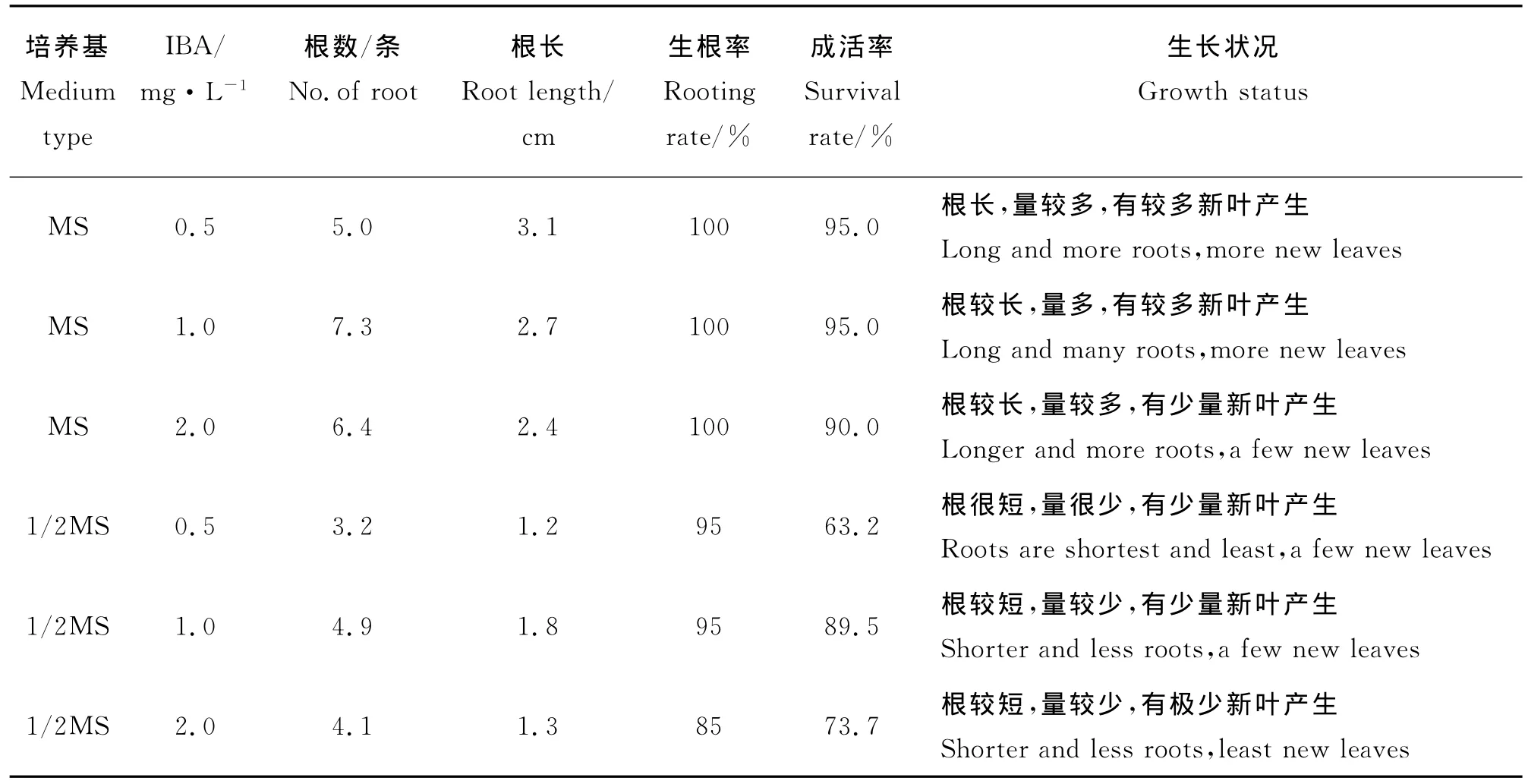
表4 組培苗的生根及成活狀況Table 4 Status of plant rooting and survival

圖1 葉片愈傷的誘導(A)、增殖(B)、分化(C),下胚軸愈傷的誘導(D)、分化(E)、增殖(F)和組培苗的生根(G)及移栽(H)Fig.1 Callus induced from leaves(A),multiplication of callus(B)and differentiation(C),callus induced from hypocotyl(D),multiplication of hypocotyl callus(E)and differentiation(F),rooting(G)and transplanting(H)
3 討論與結論
本研究以長葉點地梅的實生苗及其葉片來誘導愈傷組織,初步建立植株再生體系,實現長葉點地梅的快繁(圖1)。不同植物激素對幼苗的生長影響不同,只添加NAA的植株19d后下胚軸周圍少膨大,變褐色,25d后有少量根產生,說明NAA有利于無菌苗根的發生,但不能誘導其產生愈傷組織。當6-BA與NAA共同作用時,無根發生,植株下胚軸基部均出現愈傷組織,說明6-BA能夠促進愈傷的形成,其中發生愈傷效果最佳的培養基為 MS+0.3 mg·L-16-BA+0.1mg·L-1NAA。
目前,TDZ在愈傷組織誘導[9-12]、體胚細胞發生[13]、叢生芽誘導[14-15]、內源激素水平[16]等方面都有所應用。本研究在葉片誘導愈傷的過程中,高濃度的TDZ和NAA都會在一定程度上抑制愈傷組織的發生,在培養基 MS+0.02mg·L-1NAA和0.3mg·L-1TDZ上誘導出的愈傷淡綠疏松、長勢好,因此,為葉片誘導愈傷的最佳培養基。在愈傷組織分化試驗中,植株下胚軸基部產生的愈傷其分化能力優于葉片愈傷,在最佳培養基 MS+0.5 mg·L-16-BA+0.2mg·L-1NAA 上,愈傷分化率最高,達92.5%,平均分化芽個數最高達6.1。有的植物的不同部位產生的愈傷,其分化能力也會有一定的差別,如萵苣(Lactuca sativa)子葉和真葉誘導產生的愈傷組織和再生苗頻率與下胚軸相比會相對較低[17]。通過下胚軸基部的愈傷建立植株再生體系已經在豆科牧草沙打旺(Astragalus adsurgens)等植物中研究應用[18-19],是建立再生體系的有效途徑。在誘導生根的試驗中發現,MS培養基更有利于植株的生根成活,IBA濃度過高或過低都會影響植株的根數、根長及移栽苗的成活率,當IBA濃度為1.0mg·L-1IBA時,植株的根較長,量多,有較多新葉產生,為最佳生根培養基。
本試驗以長葉點地梅種子為外植體,通過葉片愈傷及下胚軸愈傷誘導芽,并進行生根培養,從而建立起完整的再生體系,為以后的組培快繁等相關研究奠定基礎。
[1] 柳參奎.中國東北鹽堿地植物原色圖鑒[M].哈爾濱:東北林業大學出版社,2006:123.
[2] 岳秀賢.蒙古高原種子植物區系研究[D].呼和浩特:內蒙古農業大學,2011:153-154.
[3] 李杰.半干旱石質山地不同造林模式適應性研究[D].呼和浩特:內蒙古農業大學,2010:24-25.
[4] 周濤,樸永吉,林元雪.中國野生花卉資源的研究現狀及展望[J].世界林業研究,2004,17(4):45-48.
[5] 聶勇.2,4-D和6-BA 對點地梅愈傷組織誘導的影響[J].阿壩師范高等專科學校學報,2006,23(4):126-128.
[6] 李承花,殷志琦,黃曉君,等.點地梅的化學成分[J].中國天然藥物,2008,6(2):123-125.
[7] 秦向菁.抗乙型肝炎病毒藏藥及活性部位的研究[D].北京:軍事醫學科學院放射醫學研究所,2004:16-28.
[8] 葛蓓孛.細葉百合組織培養及多倍體誘導研究[D].哈爾濱:東北林業大學,2010:9-17.
[9] Van Le B,Nhut D T,Van K T T.Plant production via shoot regeneration from thin cell layer pseudo-bulblet explants of Lilium longiflorum in vitro[J].Plant biology and Pathology,1999,322:303-310.
[10] Loretta B,Patrizio C R,Claudia B,et al.Adventitious shoot regeneration from leaf explants and stem nodes of Lilium[J].Plant Cell,Tissue and Organ Culture,2003,74:37-44.
[11] 姜新超.百合懸浮細胞體系的建立及植株再生[D].北京:中國農業科學院,2010:3-31.
[12] 蔣晶,竇美安,孫偉生.菠蘿花藥愈傷組織誘導及褐變影響因素[J].中國農學通報,2010,26(11):366-369.
[13] Sheibani M,Nemati S H,Davarinejad G H,et al.Induction of somatic embryogenesis in saffron using thidiazuron(TDZ)[J].Pakistan Journal of Biological Sciences,2007,739:259-267.
[14] 高翔,羅鴻源.蕓苔叢生芽誘導和快速繁殖[J].植物生理學通訊,1995,31(6):429-435.
[15] 顧地周,高捍東,馮穎,等.不同激素對黃檗腋芽叢生芽苗誘導及種質試管保存的影響[J].中國農學通報,2010,26(9):255-258.
[16] 馬光,郭繼平.TDZ和6-BA對蕪菁離體再生過程中內源激素水平的不同影響[J].浙江大學學報(農業與生命科學版),2010,36(3):237-245.
[17] 高輝,茍曉松,鄧運濤,等.萵苣‘紅帆’品種下胚軸愈傷組織誘導與植株再生[J].園藝學報,2002,29(5):486-488.
[18] Luo J P,Jia J F.Callus induction and plant regeneration from hypocotyl explants of the forage legume Astragalus adsurgens[J].Plant Cell Reports,1998,17:567-570 .
[19] Shang A Q,Cai H,Yan X J,et al.Plant regeneration fromin vitro cultured of hypocotyl explants of Euonymus japonicus Cu zhi[J].Agricultural Sciences in China,2006,5(3):196-201.

