山生柳SSR-PCR反應體系優化
郭 敏,李 毅,馬彥軍
(甘肅農業大學林學院,甘肅 蘭州730070)
山生柳(Salix oritrepha)屬楊柳科柳屬多年生灌木,主要分布于海拔3 000~3 700m的高山山脊、山坡[1],是高寒灌叢群落的主要優勢種之一,常與高山繡線菊(Spiraea alpina)、金露梅(Potentilla fruticosa)、沙棘(Hippophae rhamnoides)、甘肅杜鵑(Rhododendron potaninii)、窄葉鮮卑花(Sibiraea angustata)、錦雞兒(Caragana sinica)等組成高寒灌叢[2]。山生柳也是防護林、薪炭林、水土保持林及用材林的重要造林樹種,是重要的能源林樹種,具有較高的生態和經濟價值[3]。
簡單重復序列(Simple Sequence Repeat,SSR)分子標記是近年來迅速發展起來的建立在PCR精確擴增基礎上的第二代分子標記[4]。SSR分子標記技術在小麥(Triticum aestivum)[5]、水稻(Oryza sativa)[6]、大豆(Glycine max)[7]等農作物基因圖譜的建立上的應用已初具成效。近幾年來甘肅農業大學“東祁連山高寒灌叢生態系統特征及放牧管理策略”項目組對祁連山脈的山生柳資源進行了較多研究,并對分布于張掖境內核桃溝的山生柳進行了梯度式考察取樣并作了細致的群落調查[8-9]。目前,在分子方面對高寒山生柳遺傳多樣性及基因漂流方面的研究相對較少,高效的山生柳SSR-PCR反應體系及其優化方法的研究也未見報道。鑒于以上因素,本研究測試和優化山生柳SSR-PCR反應體系中每個組合及成分的濃度,利用正交設計分析法,及單一因素分析法建立并優化適宜山生柳遺傳分析的高效穩定的SSR-PCR技術體系,以期為SSR標記在山生柳的遺傳多樣性分析、功能基因比較、重要性狀定位等方面的應用奠定基礎和提供依據。
1 材料與方法
1.1 樣地設置與取樣方法 在全面勘察祁連山山生柳分布情況的基礎上,選擇山生柳分布較為廣泛的祁連山自然保護區作為試驗區,首先在海拔2 800~3 500m范圍內設樣線,在各樣線上沿海拔梯度大約每100m設置16m×16m的樣地1塊。然后在各地內,對山生柳進行取樣。
取樣時,分別取健康植株當年生枝條上的嫩葉、嫩芽和種子,供后續DNA檢測用。所有材料均用液氮保存帶回。SSR-PCR體系優化選取4個海拔梯度進行,海拔從高到低依次為:1號取樣地(P1),海拔3 520m;3號取樣地(P3),海拔3 380m;5號取樣地(P5),海拔3 281m;7號取樣地(P7),海拔3 220m。引物設計來自 http://www.ornl.gov/sci/ipgc/ssr_resource.htm(USA),由北京天埂集團公司合成。
1.2 山生柳不同組織基因DNA的提取及比較 采用CTAB法對不同海拔梯度山生柳基因組DNA 進行 提取[10],提取 了嫩芽、嫩葉、種 子的DNA,以期選取最優質的DNA。用紫外分光光度法和瓊脂糖凝膠電泳法檢測其質量,稀釋到所需濃度后置于-20℃冷藏。
1.3 PCR擴增反應和聚丙烯酰胺凝膠電泳檢測 PCR的預擴增程序參考馮亮亮等[11]的試驗步驟,稍作改動。94℃先預變性45s,然后94℃變性30s,引物SHUK123退火溫度56℃,退火45s,再72℃延伸10min,循環數30個,最后72℃延伸5 min,擴增產物需盡快電泳,否則在4℃進行保溫。用8%聚丙烯酰胺凝膠電泳跑膠,用固定液,銀染液處理膠片檢測PCR的產物[12]。

表1 SSR反應體系中各因素及其水平Table 1 Factors and levels in SSR reaction
1.4 SSR-PCR體系優化 采用P1海拔的山生柳母本DNA為體系優化模板,P2、P3、P4為檢驗模板。引物SHUK123上游:ATCGCATTTGTTCTTGAATCT;下游:GCTTAGGGTCTCTGTGGTGAG。選用L9(34)正交設計(表2),結合單因子試驗對PCR反應的Taq酶、Mg2+、dNTPs、模板濃度4個因素的3個水平進行試驗[13],并對反應的擴增程序進行優化,對PCR反應的變性時間、退火時間、延伸時間、循環數4個因素的3個水平進行試驗(表3)。對正交結果和單因素得到的結果進行綜合性直觀分析,得到山生柳SSR-PCR反應各因素的最佳水平。
1.4.1 SSR-PCR 各組分體系優化正交試驗 依照L9(34)正交表(表2)對4個因素的3個不同水平進行試驗,對每個水平的處理進行重復性試驗3次。PCR產物經8%變性聚丙烯酰胺凝膠電泳[14]跑膠,并染色拍照保存,供后續試驗數據的分析。
1.4.2 單因子試驗 在單因子反應中采用的初始反應體系,各組分添加濃度:0.5μmol·L-1上下游引物各2μL;DNA 模板1μL,30ng左右;0.5U 的Taq聚合酶1μL;2.5mmol·L-110×PCR Buffer 2μL;0.2mmol·L-1dNTPs 2.5mmol·L-1Mg2+;加ddH2O調整體系最終體積至20μL。
在SSR-PCR反應體系中分別對4個因素的影響進行分析(表1),每個組合設3個重復。每當其中一種水平進行變化時,體系中其他成分的水平保持不變。產物電泳檢測方法和擴增的程序與正交試驗相同。對跑膠的結果進行直觀評價,同時將單因子試驗的結果與正交試驗結果進行綜合分析比較,從而在正交和單因子水平兩個方面建立山生柳SSR-PCR反應的最優體系。
表2 PCR反應體系組分的正交試驗設計Table 2 Orthogonal design of PCR reaction system
1.4.3 SSR-PCR 擴增程序優化的正交試驗 在SSR-PCR反應中,PCR擴增時的關鍵因素,如變性時間、退火時間、延伸時間及循環數對擴增的優劣起到了重要的作用。采用優化后的反應體系進行PCR擴增反應,本試驗的擴增程序優化同樣選用L9(34)正交試驗設計(表 4)。產物檢測方法與1.4.2相同,對結果進行直觀分析,從而確定最終的PCR反應程序。
1.4.4 退火溫度的優化 引物SHUK123的退火溫度確定為(55±4)℃,設退火梯度(不同退火溫度分別設置),PCR儀自動形成1~12個梯度,確定最佳退火溫度。
2.1 陰道鏡診斷與組織病理診斷結果的比較 98例病理診斷典型病例中,慢性宮頸炎7例(7.14%),CIN 75例(76.53%,包括CINⅠ29例,CINⅡ28例,CINⅢ18例),宮頸癌(均為宮頸鱗癌)16例(16.33%)。陰道鏡下對慢性宮頸炎、CINⅠ、CINⅡ、CINⅢ及宮頸癌的診斷符合率分別為100.00%、93.10%、89.29%、88.89%及100.00%。見表1。

表3 PCR擴增程序中各因素及其水平Table 3 Factors and levels in the PCR procedure
1.4.5 上樣量對電泳檢測結果的影響 SSR-PCR體系建設的優劣關鍵在于擴增程序的掌控和反應體系濃度的大小,與上樣量的多少沒有直接的關系。而本試驗在進行跑膠電泳檢測時,發現上樣量的大小對反應的優劣同樣起關鍵作用,于是對擴增產物的上樣量做了6個不同的處理,分別為1~6μL,用于測定上樣量的不同對跑膠結果的影響。
2 結果
2.1 DNA提取結果 以嫩芽為材料所提的DNA量最多,沒有蛋白質、無機鹽及RNA等雜質,質量最好;嫩葉所提DNA量稍少于嫩芽,且有微量雜質,可能由于山生柳屬于高海拔植物,其自身蠟質含量高;種子提出的DNA量較少,含有少量蛋白質和無機鹽,且RNA較多,質量比嫩葉的差;果實所提的DNA量最少,雜質最多,質量最差(因為果實質量很差,基本拍不出圖像,山生柳果實很難采取,不適合提取DNA)。試驗結果顯示(圖1),嫩芽和嫩葉是提取DNA的最理想材料,并且在質量和數量上均能滿足SSR擴增的需要,其次為老葉、種子、果實。綜合上述,采用CTAB法可以提取高質量的DNA。

圖1 3種材料山生柳組織DNA提取電泳圖Fig.1 Electrophoresis of DNA of three Salix oritrepha materials
2.2 反應組分正交設計電泳結果 編號1、2、3、4、6、8的水平組合中都可以擴增出譜帶,但編號1、2、3組合擴增譜帶目標帶不明顯,拖尾比較嚴重。同時編號4、6組合的譜帶較弱,幾乎看不清譜帶的擴增情況。編號5、7、9的組合幾乎擴增不出譜帶,一般可排除擴不出目標帶的組合認為。編號8的組合擴增譜帶最清晰且分辨率較高,綜合比較,編號8的擴增帶最好,條帶清晰,非特異帶少,顏色較深,即Taq酶 1.0U·μL-1,Mg2+2.0mmol·L-1,dNTP 0.1mmol·L-1,DNA 濃度 20ng·μL-1(圖3)。
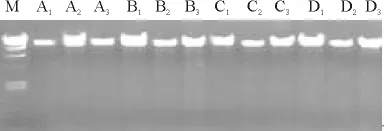
圖2 不同海拔山生柳DNA電泳圖Fig.2 Electrophoresis of DNA of Salix oritrepha
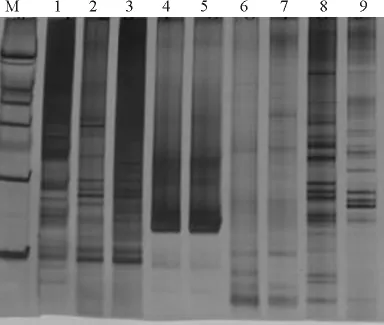
圖3 SSR-PCR反應正交設計電泳結果Fig.3 Electrophoresis of SSR-PCR by orthogonal design
2.3 單因子試驗結果分析
2.3.1 Taq聚合酶對山生柳SSR-PCR 擴增的影響
擴增譜帶的依次減弱是因為酶的用量有所減少而導致的,Taq酶用量在0.5U時條帶最清晰且沒有拖尾現象,從而確定Taq酶的最佳用量為0.5U(圖4)。
2.3.2 Mg2+濃度對山生柳SSR-PCR擴增的影響

圖4 反應體系中各因素在不同濃度下對3 520m處山生柳PCR產物的影響Fig.4 Effects of factors in orthogonal design on the PCR production of Salix oritrepha from an altitude of 3 520m
2.3.3 dNTPs濃度對山生柳SSR-PCR擴增的影響
3種不同濃度dNTPs下擴增的結果優劣有明顯差異,濃度過低會沒有譜帶(圖4)。因此,確定0.10 mmol·L-1為山生柳20μL反應體系中的最佳濃度。
2.3.4 DNA濃度對山生柳擴增的影響 隨著DNA模板濃度的升高,擴增條帶彌散現象比較嚴重,同時出現拖尾現象。因而采用20ng·μL-1的DNA濃度即可。以上結果顯示,單因子試驗可以對反應體系中每一個因素的不同水平進行比較直觀的分析,而對各個因素水平的組合實驗可以利用正交設計。在單因子試驗中,與正交試驗相比,其余的組分濃度基本相同,只有酶的用量略有降低,為0.5U。綜合兩種試驗結果,確定山生柳20μL SSR-PCR反應體系中幾個關鍵的影響因子分別為0.5UTaq聚合酶,2.0mmol·L-1Mg2+,0.10mmol·L-1dNTP,20ng·μL-1DNA模板。
2.4 反應程序的正交試驗設計電泳結果
SSR-PCR反應程序正交設計9個組合的擴增顯示(圖5),擴增譜帶的深淺、優劣不同,原因是變性時間、退火時間、延伸時間以及循環數的組合不同。編號2、3、6組合的譜帶較弱,編號4、5組合沒有擴出目標帶。編號1、7、8、9組合都可以擴增出較清晰譜帶,但1、8、9組合擴增背景不清,較彌散并且帶有雜帶,顏色較深。綜合正交試驗結果和以往經驗,得出第7組為反應程序最佳方案,即變性時間45s,退火時間45s,延伸時間30s,循環數30個。

圖5 SSR-PCR反應程序的正交試驗設計電泳結果Fig.5 Electrophoresis of SSR-PCR by orthogonal design
2.5 不同退火溫度的優化 在梯度試驗中引物SHUK123基本上均能擴增出條帶,但在56℃時擴增出的帶型整齊、清楚,特異帶明顯,無拖尾現象(圖6),此溫度與引物兩條鏈的較低的理論熔解溫度[Tm=2(A+T)+4(G+C)]相近。而在59℃時產生了一定的彌散現象,條帶拖尾比較嚴重。故采用56℃退火溫度即能得到很好的擴增結果。綜上所述,山生柳優化后的反應程序:94℃高溫預變性時間3min,94℃變性45s,Tm退火時間45s,72℃延伸30s,循環數30個,最后72℃后延伸時間5min,4℃保溫。
2.6 不同上樣量對聚丙烯酰胺電泳結果的影響 在8%的丙烯酰胺凝膠上,上樣4μL以下的條帶由于染色背景較淺,擴增的分子量相差較小,所以無法顯示。上樣量大于5μL時背景顏色太深,產生彌散效果。上樣5μL效果最好,條帶較清晰,區分度強,目標帶明顯(圖7)。因此最佳上樣量最佳為5μL。
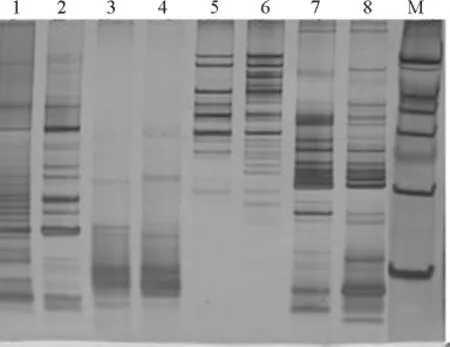
圖6 引物不同退火溫度的電泳圖Fig.6 Electrophoresis of SHUK123with different annealing temperatures

圖7 不同上樣量對聚丙烯酰胺電泳結果的影響Fig.7 Effects of loading amount on the polyacrylamide gel electrophoresis
2.7 體系優化后的擴增結果 綜上利用優化后的SSR-PCR反應體系對4個不同海拔山生柳材料進行了PCR擴增,各海拔梯度的擴增條帶均很清晰,每個泳道有譜帶15~22條,反應體系的特異性、可重復操作性和穩定性較好(圖8)。這表明不同海拔的山生柳品種優化后的體系是穩定可靠的。譜帶的豐富性從另一方面也反映了山生柳具有較豐富的遺傳多樣性。

圖8 用優化體系對4個海拔梯度山生柳擴增的結果Fig.8 Amplification results of Salix oritrepha from 4altitudes with optimized system
3 討論
山生柳是我國祁連山脈特有高寒防御樹種,篩選其SSR引物及建立優化的反應體系是SSR-PCR的關鍵所在,這也是SSR分子標記多態性應用的必要環節和基礎[15]。但在影響擴增優劣的各個影響因子中,由于SSR反應體系所含組分比較繁多,各組分的含量大小和反應時間長短均可能對擴增的產物及跑膠的優劣產生影響[16]。所以本研究中采用正交試驗設計和單因子試驗綜合考慮的方法,可有效地節省試驗時間并節約成本,對SSR-PCR試驗的有效性和嚴謹性提供了支持[17]。
PCR反應的擴增效率及譜帶的優劣是反應體系中各因素綜合作用的結果,各因素要綜合考慮。Taq酶用量是其中的重要因子,它直接影響擴增結果和產物多態性的檢出率、重復性和有效性。Mg2+濃度是影響Taq酶活性的主要因子,Mg2+濃度過高會使非特異性擴增產物增加,過低則造成擴增產物減少,甚至不能擴增。這是因為Mg2+是TaqDNA聚合酶的激活劑,其濃度的高低不僅影響引物與模板的結合效率和產物的特異性,而且還會影響酶的活性和擴增的可靠性,所以Mg2+的濃度大小直接影響了反應的特異性和擴增片段的產率[18-19]。本研究結果是在2.0mmol·L-1時擴增產物最清晰,Mg2+為2.5mmol·L-1時擴增結果不穩定,由于高濃度Mg2+影響了Taq酶的活性,所以適當降低Mg2+的濃度有助于擴增的效果。
引物濃度和質量也會直接影響PCR擴增結果的優劣,如果引物濃度過高會產生非特異性擴增,還會增加背景的彌散程度導致拖尾現象的產生[20]。濃度過高的dNTPs會競爭 Mg2+,降低游離 Mg2+濃度,從而導致擴增效果不理想,而當組分含量dNTPs的濃度過低時會影響SSR-PCR擴增的效率。
在各種影響因素中,考慮適宜的退火溫度也是關鍵所在,它會影響反應的準確率和擴增效果。退火溫度過低會促使引物二聚體的產生,雜帶太多,對結果分析產生影響。而當退火溫度過高時,模板與引物在擴增過程中不能積極退火,反應遲緩無法繼續進行;擴增結果顯示,有的引物(WPMS13、WPMS14)在退火溫度為55℃時沒有擴增帶,退火溫度降到50℃時就能擴增出產物。值得注意的是,引物在有些情況下沒有擴增出來產物也是其多態性的體現。一般可以以Tm值為PCR退火溫度[21]。當引物兩條鏈的Tm不同時,可以以平均值為準或適當降低其退火溫度也會得到很好的特異性條帶。總之,在SSR-PCR擴增中,應綜合考慮各因素的組分濃度和反應時間,從而加強擴增的有效性和結果檢驗的真實性。
[1] 吳海艷,馬玉壽,王彥龍,等.黃河源區山生柳灌叢草甸植物群落多樣性及植物量組成[J].草業科學,2008,25(5):55-59.
[2] 王芳,陳文業,才讓卓瑪,等.高寒區山生柳硬枝扦插灰色系統理論分析研究[J].草業科學,2010,27(9):86-90.
[3] 關傳友.中國植柳史與柳文化[J].北京林業大學學報(社會科學版),2006,5(7):8-15.
[4] 解新明,盧小良.SSR和ISSR標記及其在牧草遺傳與育種研究中的應用前景[J].草業科學,2005,22(2):30-35.
[5] 陳新民,何中虎,史建榮.利用SSR標記進行優質冬小麥品種(系)的遺傳多樣性研究[J].作物學報,2003,29(1):13-19.
[6] 楊官品,張啟發.水稻——多拷貝微衛星DNA多態性分析[J].遺傳,1998,20(2):27-30.
[7] 海林,王克晶,楊凱.半野生大豆種質資源SSR位點遺傳多樣 性 分 析 [J].西 北 植 物 學 報,2002,22(4):751-757.
[8] 李毅,胡自治,王志泰.東祁連山高寒地區山生柳種群分布格局研究[J].草業學報,2002,11(3):49-54.
[9] 王志泰.東祁連山高寒陰濕地區山生柳種群年齡結構和空間分布格局[D].蘭州:甘肅農業大學,2001.
[10] 劉恩英.簸箕柳×綿毛柳遺傳框架圖譜的構建[D].南京:南京林業大學,2008.
[11] 馮亮亮,唐紅,李毅,等.甘肅紅砂不同種群遺傳多樣性的ISSR分析[J].草業學報,2011,20(1):125-129.
[12] 張道遠,張元明,曹同.耐寒苔蘚植物DNA提取及優化RAPD、ISSR 反應體系 的建立 [J].中國沙 漠,2006,26(9):827-831.
[13] 易金鑫,侯喜林,冷月祥.茄子基因組DNA提取及RAPD-PCR體系的優化[J].江蘇農業科學,2004(3):50-52.
[14] Liu Y,Chen H Y,Wei Y T,et al.Construction of a genetic map and localization of QTLs for yield traits in tomato by SSR markers[J].Progress in Natural Science,2005,15(9):793-797.
[15] 常宏,王漢寧,張金文,等.玉米品種真實性和純度鑒定的SSR標記多重PCR體系優化[J].草業學報,2010,19(2):204-211.
[16] 沈紫微,陳本建,康俊梅,等.紅豆草ISSR體系優化及其在航天誘變種質鑒定中的應用[J].草業科學,2010,27(12):66-71.
[17] 鄭軼琦,王志勇,郭海林,等.正交設計優化假儉草SRAP-PCR反應體系及引物篩選[J].草業學報,2008,17(4):110-117.
[18] 何慶元,吳萍,張曉紅,等.不同秋眠性苜蓿SRAP體系優化及遺傳多樣性分析[J].草業學報,2011,20(2):201-209.
[19] 喬玉山,章鎮,房經貴,等.李種質資源ISSR反應體系的建立[J].果樹學報,2003,20(4):270-274.
[20] 王志勇,袁學軍,劉建秀,等.狗牙根SRAP-PCR反應體系優化及引物篩選[J].草業學報,2008,17(3):79-85.
[21] 劉曉麗,何天明,張美勇,等.核桃SSR反應體系的優化[J].果樹學報,2007,24(2):140-145.

