鹽酸氟桂利嗪口腔崩解片的穩定性研究
王景翔,于宏偉,曹德英,李濤,黃瑞彬(.石家莊學院化工學院,石家莊050035;.河北醫科大學藥學院,石家莊 05007)
鹽酸氟桂利嗪(Flunarizine hydrochloride,FH)為選擇性的鈣通道阻滯藥,對血管平滑肌有擴張作用,能顯著地改善腦循環和冠脈循環,并能預防血管的脆化性。臨床常用于腦血栓形成、腦栓塞、腦動脈硬化、腦出血恢復期、腦外傷后遺癥、內耳眩暈癥、冠狀動脈硬化等疾病的預防和治療[1,2];其制成口腔崩解片后,不用水或用極少量水就可將藥物服下[3],尤其適宜于腦血管疾病急性發作期及老年患者的服用。為制定該制劑的儲存條件和有效期,筆者研究了FH口腔崩解片的穩定性。
1 儀器與試藥
FA-2104B電子天平(上海精密科學儀器有限公司);DK-98-1型電熱恒溫水浴鍋、101-2型電熱鼓風干燥箱(天津市泰斯特儀器有限公司);YB-Ⅱ澄明度檢測儀(天津光學儀器有限公司);LHS-100HC恒溫恒濕培養箱(嘉興中新醫療儀器有限公司);SPD-10A高效液相色譜(HPLC)儀(日本島津株式會社);N2010色譜工作站(浙江大學)。
FH對照品(石家莊華新制藥廠,批號:070216,純度:99.62%);FH口腔崩解片(石家莊學院化學實驗中心藥物制劑實驗室制備,批號:080901、080902、080903,規格:每片5 mg);甲醇為色譜純,其他試劑均為分析純,水為高純水。
2 方法與結果
2.1 崩解時限測定
依據國家藥品評審中心發布的《口腔崩解片的劑型特點和質量控制會議紀要》(2003年9月)[4]的規定,取10 mL比色試管6支,內置26目工業篩網制成的篩籃,加入2 mL水,置于(37±0.5)℃恒溫水浴中保溫2 min,使試管內外溫度平衡;取樣品6片,每支試管中放入1片,采用靜態法測定崩解時限。以片劑接觸水面開始記時,至全部崩散為完全崩解,篩網上應無大顆粒殘留,用秒表記錄崩解時限,取平均值即為測定結果,測定3批樣品,崩解時限分別為18.9、19.6、18.2 s,均符合≤1 min的規定要求。
2.2 含量測定
2.2.1 色譜條件。色譜柱:Shimadzu ODS C18(150 mm×4.6 mm,5 μm);流動相:甲醇-磷酸二氫鉀溶液(0.01 mol·L-1,pH=3.5)=68∶32,流速:1.0 mL·min-1;檢測波長:254 nm;柱溫:30 ℃;進樣量:20 μL。
2.2.2 對照品溶液制備。精密稱取于105℃干燥至恒重的FH對照品60 mg,置于50 mL容量瓶中,加入乙醇10 mL溶解后,加鹽酸溶液(稀鹽酸24 mL加水至1 000 mL)稀釋至刻度,搖勻,得對照品儲備液;精密吸取儲備液1 mL,置于100 mL容量瓶中,加流動相稀釋至刻度,搖勻,得濃度為12 μg·mL-1對照品溶液。
2.2.3 供試品溶液制備。取FH口腔崩解片20片,精密稱定,研細;精密稱取細粉適量(約相當于FH 12 mg)置于100 mL容量瓶中,加乙醇10 mL溶解后加鹽酸溶液稀釋至刻度,搖勻,用0.45 μm濾膜濾過;再精密量取續濾液5 mL,置于50 mL容量瓶中,加流動相稀釋至刻度,搖勻,得供試品溶液。
2.2.4 干擾試驗。稱取處方量輔料適量,照“2.2.3”項下方法制備成輔料溶液。取輔料溶液和對照品、供試品溶液進樣測定,結果輔料對主峰無干擾;供試品與對照品溶液中主峰保留時間一致,無雜峰,色譜詳見圖1。

圖1 高效液相色譜圖A.對照品;B.供試品;C.輔料;1.FH Fig 1 HPLC chromatogramsA.substance control;B.test sample;C.excipient;1.FH
2.2.5 標準曲線制備。精密吸取對照品儲備液0.1、0.2、0.4、0.6、0.8、1.0、1.2 mL分別置于25 mL容量瓶中,加流動相稀釋至刻度,搖勻;依“2.1.1”項下色譜條件,各取20 μL進樣;以峰面積(A)對濃度(c)進行回歸分析,得回歸方程A=31 250.67c-1 547.37(r=0.999 9);表明FH檢測濃度線性范圍為4.8~57.6 μg·mL-1。
2.2.6 回收率試驗。精密稱取FH對照品約4、5、6 mg各3份,按處方量加入相應的輔料,分別按“2.2.3”項下制備高、中、低(38.4、28.8、19.23 μg·mL-1)3個濃度的溶液,分別測定,計算回收率分別為99.26%、100.28%、101.27%,RSD分別為0.97%、1.26%、1.49%。
2.2.7 精密度試驗。取“2.2.6”項下高、中、低3個濃度的溶液,在同日內不同時間測定5次,計算日內RSD分別為0.85%、0.93%、1.06%;每天測定1次,連續測定5 d,計算日間RSD分別為1.21%、1.35%、1.59%。結果表明本方法精密度較好。
2.2.8 樣品含量測定。將樣品按“2.2.3”項下方法制備成供試品溶液,精密吸取20 μL注入色譜儀,記錄峰面積;另取對照品溶液同法測定。依外標法以峰面積計算FH的含量,以C26H26F2N2計,含量(標示量)應在90%~110%之間。測定3批樣品,含量分別為100.62%、101.53%和99.97%。
2.3 有關物質檢查
2.3.1 供試溶液制備。取FH口腔崩解片20片,研細,精密稱取細粉適量(約相當于FH 10 mg)置于100 mL容量瓶中,加乙醇10 mL溶解后加鹽酸溶液稀釋至刻度,搖勻,制成每1 mL含100 μg FH的溶液,濾過,續濾液作為供試溶液。
2.3.2 對照溶液制備。精密吸取上述供試溶液1 mL,置于100 mL容量瓶中,加鹽酸溶液稀釋至刻度,搖勻,制成每1 mL含1 μg FH的溶液,作為對照溶液。
2.3.3 方法專屬性考察。取3份供試溶液各10 mL,分別滴加6 mol·L-1的鹽酸、2 mol·L-1的氫氧化鈉溶液和30%的雙氧水各2滴,振搖,室溫放置20 min,過濾,取續濾液20 μL注入色譜儀,記錄色譜。另取2份供試溶液各10 mL,置于稱量瓶中,密塞,其中1份置于溫度為105℃的烘箱中加熱4 h,取出后放至室溫;另1份置于照度為(4 500±500)lx的澄明度檢測儀中放置1 d,過濾,同法測定,記錄色譜,見圖2。

圖2 破壞性試驗色譜圖A.酸破壞樣品;B.堿破壞樣品;C.氧化破壞樣品;D.高溫破壞樣品;E.光照破壞樣品;1.FHFig 2 HPLC chromatogram of destructive testA.destroyed by acid;B.destroyed by alkalization;C.destroyed by oxidation;D.destroyed by heat;E.destroyed by light;1.FH
圖2結果表明,樣品被破壞后產生的降解物雜質峰均能與主峰分離,該色譜系統可有效分離并測定降解物質,適用于樣品的有關物質檢查。
2.3.4 有關物質測定。精密吸取對照溶液20 μL注入色譜儀,調節檢測靈敏度,使主成分色譜峰的峰高為滿量程的10%~20%;再精密吸取供試溶液與對照溶液各20 μL分別注入色譜儀,記錄色譜圖至主成分峰保留時間的2倍。如顯雜質峰,各雜質峰峰面積之和與對照溶液峰面積比較,計算有關物質含量,應不超過1%。測定3批樣品,結果有關物質含量分別為0.47%、0.26%、0.28%。
2.4 影響因素試驗
取實驗室制備的樣品(批號為080901),除去包裝后置于潔凈的表面皿中,分別在高溫、高濕和光照條件下進行穩定性的影響因素試驗,并于第5、10天取樣測定,考察其性狀、崩解時限、含量和有關物質[5],結果與0 d比較,詳見表1。
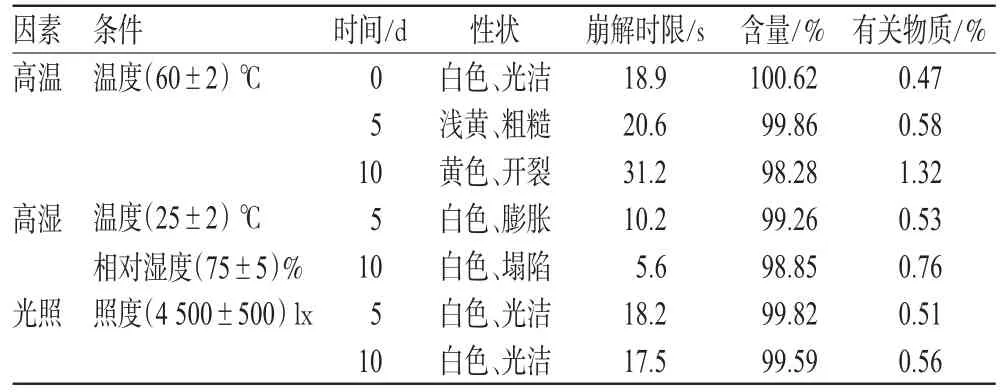
表1 樣品影響因素試驗結果(n=3)Tab 1Results of influence factors test of samples(n=3)
從表1可見,高溫對樣品的影響較大,并且有關物質含量超標;口腔崩解片的吸濕性較強,但對光照較穩定。提示FH口腔崩解片應密封,在陰涼干燥處保存。
2.5 加速試驗
取3批樣品,選用雙鋁復合膜包裝材料模擬上市包裝,置于溫度(40±2)℃、相對濕度為(75±5)%的恒溫恒濕培養箱中放置6個月,分別于1、2、3、6個月末取樣測定,考察其性狀、含量、有關物質以及崩解時限,結果與0月對照,詳見表2。
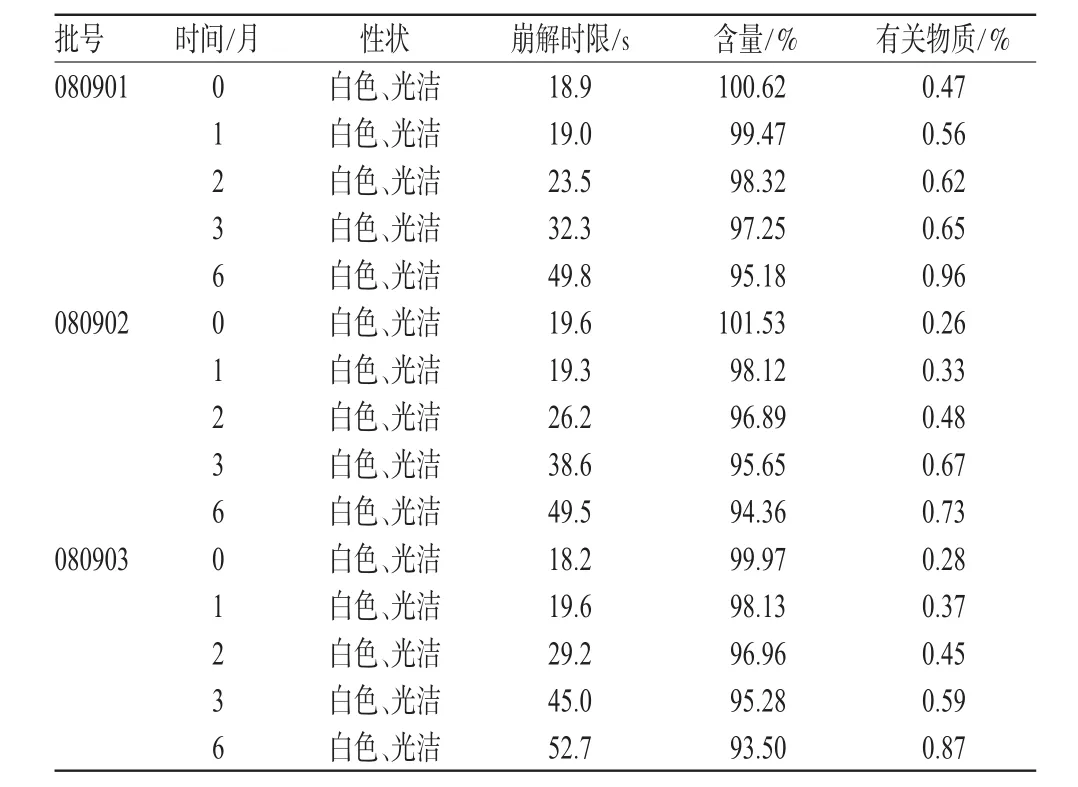
表2 樣品加速試驗結果(n=3)Tab 2Results of accelerated test(n=3)
2.6 長期留樣試驗
取3批樣品,按選定的包裝材料進行包裝,置于溫度(25±2)℃、相對濕度為(60±10)%的恒溫恒濕培養箱中放置12個月,分別于0、3、6、9、12個月末取樣測定,考察其性狀、含量、有關物質和崩解時限,結果與0月對照,詳見表3。
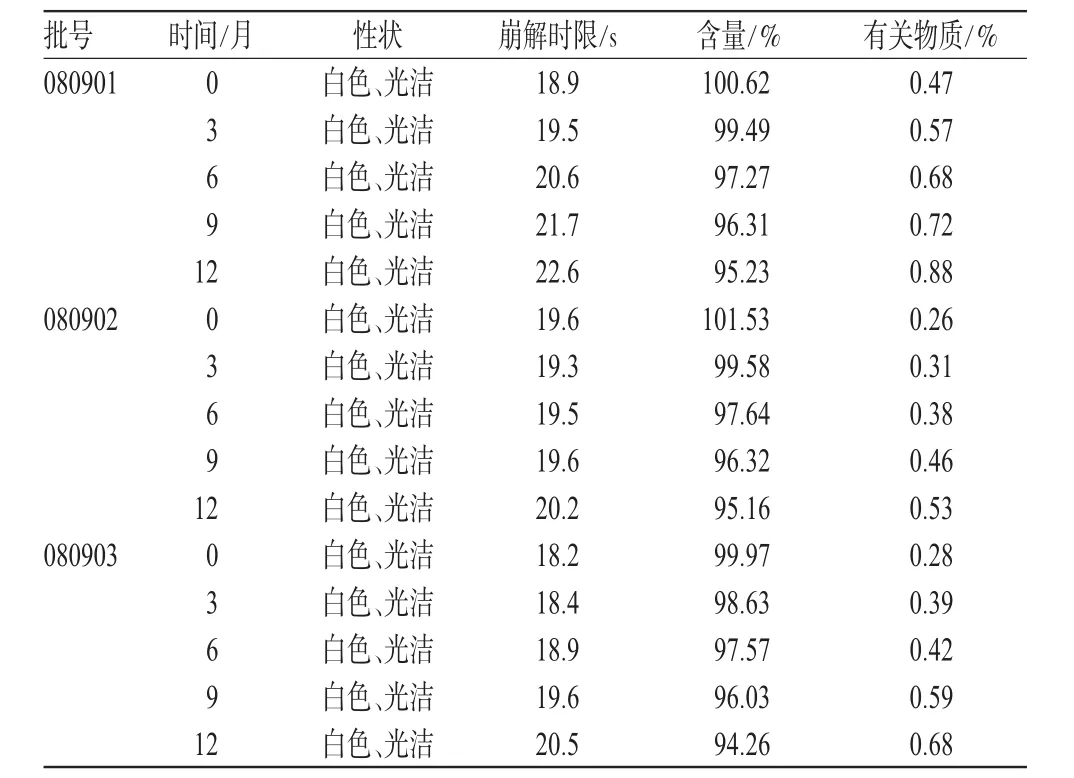
表3 樣品長期試驗結果(n=3)Tab 3Results of long-term test(n=3)
表3結果顯示,樣品連續放置12個月各項質量指標變化較小,在選定包裝及儲存條件下穩定性良好。
2.7 有效期統計分析
選擇批號為080901樣品的長期試驗測定數值為例,以標示量(y)對時間(x)進行線性回歸,得回歸方程:y=-0.465 3x+100.58(r=0.989 3);求出各時間點標示量的計算值(y′),然后計算95%單側可信限置信區間y′±σ;用x與y′、y′+σ、y′-σ作圖,從置信區間下界線的標示量90%處劃一條直線,自交點作垂線于x軸相交處,即為最短有效期[6,7],結果見圖3。

圖3 有效期統計分析圖Fig 3 The term of validity statistical analysis
從圖3可見,FH口腔崩解片的最短有效期為24個月,與穩定性試驗結果推斷相符合。
3 討論
影響因素試驗中樣品在高溫和高濕狀態下性狀發生較大變化,尤其濕度的影響更大,這與片劑中加入大量崩解劑吸濕有關,因此不再進行95%濕度條件下的試驗。加速試驗中6個月的有關物質量增加近3倍,提示生產及內包裝環境應嚴格控制濕度,盡量減少半成品的周轉期限;成品也應在陰涼干燥處儲存,密封并在包裝盒內放置干燥劑。
采用雙鋁復合膜包裝的樣品經加速試驗,在規定的時間內各項質量指標均穩定,說明其包裝材料選擇較為適宜;模擬產品的上市包裝,進行長期試驗,檢驗結果表明該制劑質量穩定,在規定的貯藏條件下可以長期儲存,有效期暫定為2年。
[1]許云紅.鹽酸氟桂利嗪的臨床應用進展[J].中國醫學創新,2010,7(12):191.
[2]王雪輝,左小磊.鹽酸氟桂利嗪的臨床新用途[J].中國現代藥物應用,2009,3(15):129.
[3]陳 嵐,武新安,張國榮,等.口腔速崩片的研制[J].中國藥房,2001,12(11):657.
[4]國家食品藥品監督管理局藥品審評中心.口腔崩解片的劑型特點和質量控制會議紀要[EB/OL].http://www.cde.org.cn/.2003-08-03.2011-01-10.
[5]國家藥典委員會.中華人民共和國藥典(二部)[S].2010年版.北京:中國醫藥科技出版社,2010:附錄200-201.
[6]陳海峰.藥物建立有效期的考慮要點[J].中國新藥雜志,2009,18(19):1 831.
[7]朱富根.BASIC語言求算藥物制劑穩定性試驗參數的程序[J].中國藥業,2008,17(11):38.

