TLR4與TLR9在原發性肝癌組織中的表達及意義
劉曉聰,朱慧芬,楊道鋒,曹旭東,鄧科蘭,黃春梅,胡曉萌,陳琰琰,姜素華,沈關心
(1石河子大學醫學院生化教研室,石河子832002;2華中科技大學同濟醫院;3石河子大學醫學院病原生物學與免疫學教研室;4華中科技大學同濟醫學院)
據報道,目前,我國主要的慢性肝病是乙型肝炎病毒感染所致的慢性病毒性肝炎后肝硬化[1],可最終發展成肝癌。Toll樣受體(Toll-like receptors,TLRs)是Ⅰ型跨膜蛋白,能識別侵入體內的微生物進而激活免疫細胞應答,被認為在先天性免疫系統中起關鍵作用。據報道,TLRs家族中TLR3、TLR4、TLR7、TLR8及 TLR9與病毒感染性疾病密切相關[2]。本研究通過免疫組織化學及流式細胞術分別檢測原發性肝癌癌組織、相應癌旁組織及肝血管瘤組織中TLR4、TLR9的表達,旨在探討二者在肝癌發生、發展中的作用。
1 材料與方法
1.1 材料 110例臨床病理診斷為原發性肝癌患者的癌組織及相應癌旁組織標本,患者男93例,女17例,年齡22~74歲,平均52歲;血清學檢測證實患者均有乙肝感染史。同期肝血管瘤患者瘤組織標本10份,患者男5例,女5例,年齡37~55歲,平均44歲;乙肝相關指標均為陰性。主要試劑及儀器有PE-anti-human TLR4、PE-anti-human TLR9(eBio-sience公司),小牛血清以及胎牛血清(杭州四季青公司),消化酶(Clostridium histolyticum,Gibco,武漢天傲生物分裝),1640培養液(Gibco公司),FACS Calibur流式細胞儀(BD LSRⅡ,美國),免疫組化TLR4、TLR9一抗(博士德生物工程,武漢/Abcam公司,美國),免疫組化染色試劑盒Envision HRP兔鼠通用 二抗(上海基因科技),NU-6613V31型-80℃低溫冰箱,Sigma 4 K15低溫離心機(Sigma,Germany)。
1.2 TLR4、TLR9水平檢測 ①免疫組化法:采用Elivision二步法進行免疫組化染色,具體步驟參照試劑盒推薦步驟進行,抗TLR4單克降抗體稀釋度為1∶100,抗 TLR9 單克降抗體稀釋度為 1∶50,DAB顯色,用檸檬酸微波法進行抗原修復,以PBS代替抗體作為陰性對照組。采用綜合評分法,高倍鏡下隨機計數5個視野,計算陽性細胞所占百分比。陽性細胞占所有細胞的比例≤10%為0分,11% ~25%為1分,26% ~50%為2分,51% ~75%為3分,≥76%為4分;凡細胞質或細胞核呈淺棕色為1分、棕色為2分、深棕色為3分、不著色為0分。上述兩積分相乘:0分為陰性(-)、1~4分為弱陽性(+)、5~8分為中等陽性(++)、9~12分為強陽性(+++),并以Image-Pro Plus 6.0軟件進行組化圖像分析。②直接免疫熒光流式細胞術(FCM):將獲取的新鮮肝癌、癌旁及肝血管瘤組織標本剪成1 mm3組織塊,用無鈣、無鎂的D-Hank's液反復沖洗后加入膠原酶進行消化,以用DMEM液終止膠原酶的作用。Facoll管中各自加入PE-anti-human TLR4抗體5μL、PE-anti-human TLR9抗體20μL和每管加入已計數的相應細胞量,混勻,每管設陰性對照,按常規方法室溫、避光孵育30 min,4 mL PBS常溫1 200 g離心5 min/3次洗滌后,再加入0.5~1 mL PBS重懸,FCM上機檢測,并用Cellquest軟件分析TLR4、TLR9的平均熒光強度及陽性表達率。
1.3 統計學方法 采用SPSS13.0統計軟件,計量資料以ˉx±s表示,對計數數據進行t檢驗和秩和檢驗,Spearman等級相關檢測相關性。檢驗水準α=0.05。
2 結果
免疫組化法示癌旁組織主要呈現出慢性炎癥及肝硬化的病理表現,TLR4及TLR9主要為漿/膜表達,而細胞核中無表達(圖1)。肝癌、癌旁及肝血管瘤組織中 TLR4表達陽性率分別為0.058 434、0.653 51、1,兩兩比較,P 均 <0.05;TLR9 表達陽性率分別為0.819 10、0.370 18、0.079 54,兩兩比較,P均<0.05。FCM檢測與免疫組化染色法結果一致,見圖2。肝癌、癌旁及肝血管瘤組織中TLR4表達熒光強度分別為2 168、2 453、2 616,兩兩比較,P 均 <0.05;TLR9 表達分別為 2 280、1 907、1 428,兩兩比較,P 均 <0.05。
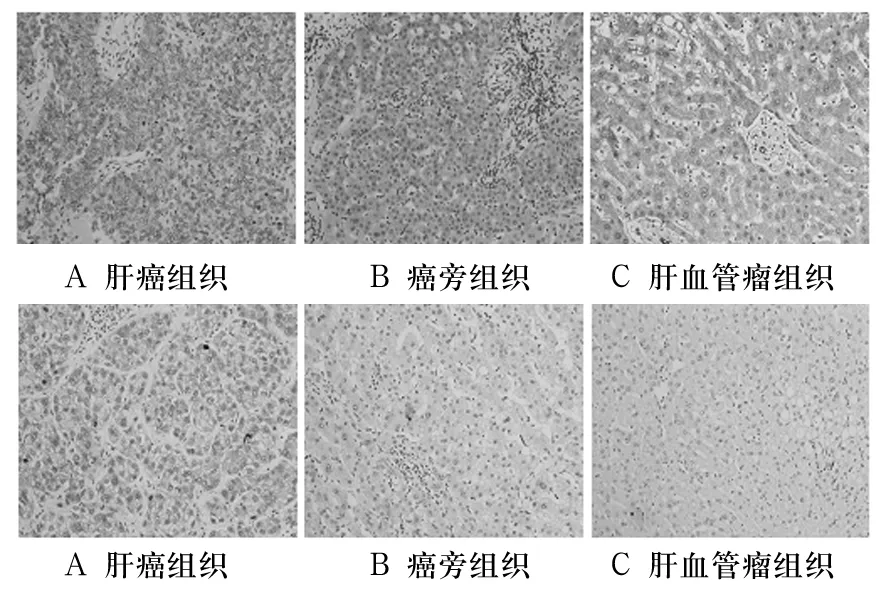
圖1 肝癌組織、癌旁組織、肝血管瘤組織中TLR4、TLR9表達(IHC ×200)
3 討論
研究發現,慢性乙型肝炎病毒感染所致的慢性肝炎和肝硬化是原發性肝癌最主要的因素,TLRs是參與非特異性免疫(天然免疫)的一類重要蛋白質分子,亦是連接非特異性免疫和特異性免疫的橋梁。TLRs通過識別病原相關分子模式(Pathogenassociated molecular patterns,PAMPs)及某些內源性配體引發信號轉導并導致炎癥介質的釋放,在天然免疫防御中起重要作用,并最終激活獲得性免疫系統。以往研究認為TLRs主要表達于免疫細胞中,但越來越多的證據表明某些腫瘤細胞亦表達TLRs,TLRs參與調節腫瘤細胞的增殖、存活以及藥物敏感性[3,4]。
TLR4為TLR的一種,主要識別革蘭陰性菌脂多糖。新近研究發現,TLR4基因突變或基因多態性與肝癌的發生或惡性程度密切相關[5]。腫瘤組織在侵襲過程中可產生活性氧或應激保護性因子,細胞壞死崩解釋放腫瘤抗原,所有的這些因子可成為TLR4的內源性配體,從而激活TLR信號途徑,促進抗原呈遞細胞的成熟,進而活化T細胞引起特異性抗腫瘤免疫。TLR4信號途徑的激活有助于抗腫瘤免疫的啟動。研究發現,TLR4在慢性肝炎患者的肝組織中表達上調,而TLR4在肝癌組織中較癌旁組織表達降低[6,7]。本研究發現 TLR4在肝癌組織中表達低于癌旁及肝血管瘤組織,與文獻報道結果一致。原因可能為HBV基因編碼的病毒蛋白發揮拮抗TLR介導的固有免疫應答作用,乙肝病毒通過拮抗TLR4表達促進肝癌的發生。
研究顯示,TLR9的外源性配體為細菌和病毒DNA中未甲基化的CpG序列,內源性配體為含低甲基化CpG序列的自身DNA,亦是免疫細胞識別病毒和細菌中非甲基化DNA的必需成分。TLR9位于內質網,UNC93B1同樣位于內質網內,激活以后,TLR9依賴UNC93B1的方式轉移到內體/溶酶體,從而招募適配體蛋白MyD88,通過依賴MyD88的途徑激活IRF、AP-l、NF-κB 等轉錄因子,以產生大量的Ⅰ型干擾素和多種炎癥細胞因子,從而誘導干擾素的產生和一系列免疫應答機制,發揮免疫應答效應[8~10]。研究發現,TLR9除表達于正常上皮外,在腫瘤細胞中亦有表達,如乳腺癌、中樞系統腫瘤、肺癌、胃癌及前列腺癌等[11~15]。Tanaka 等[16]證實 TLR9 在 85.7%的肝癌組織中表達,利用CpG-ODN激活TLR9通路后發現細胞增殖加快,耐藥性增加,進一步發現TLR9激活后凋亡抑制因子(Survivin、Bcl-xL、XIAP等)上調,而TLR9抑制劑處理后諸多相關癌基因下調。本研究結果顯示,TLR9在肝癌組織中的表達明顯高于癌旁組織和肝血管瘤肝組織,提示乙肝病毒可能充當外源性CpG相似的作用,激活TLR9通路并產生一系列生物學效應,從而促進肝癌的發生、發展。
綜上所述,TLR4、TLR9與肝癌的發生、發展有關,機制可能為乙肝病毒通過拮抗TLR4表達、激活TLR9通路促進肝癌的進展。
[1]Salhab M,Canelo R.An overview of evidence-based management of hepatocellular carcinoma:a meta-analysis[J].J Cancer Res Ther,2011,7(4):463-475.
[2]Thompson MR,Kaminski JJ,Kurt-Jones EA,et al.Pattern recognition receptors and the innate immune response to viral infection[J].Viruses,2011,3(6):920-940.
[3]Chen R,Alvero AB,Silasi DA,et al.Cancers take their Toll-the function and regulation of Toll-like receptors in cancer cells[J].Oncogene,2008,27(2):225-233.
[4]Huang B,Zhao J,Unkeless JC,et al.TLR signaling by tumor and immune cells:a double-edged sword[J].Oncogene,2008,27(2):218-224.
[5]Minmin S,Xiaoqian X,Hao C,et al.Single nucleotide polymorphisms of Toll-like receptor 4 decrease the risk of development of hepatocellular carcinoma[J].PLoSOne,2011,6(4):e19466.
[6]Wei XQ,Guo YW,Liu JJ,et al.The significance of Toll-like receptor 4(TLR4)expression in patients with chronic hepatitis B[J].Clin Invest Med,2008,31(3):E123-130.
[7]Guo YW,Li YW,Wei XQ,et al.Expression of TLR2 and TLR4 in hepatocellular carcinoma[J].Chin J Pathophysiol,2008,24(10):1912-1915.
[8]Merrell MA,Ilvesaro JM,Lehtonen N,et al.Toll-like receptor 9 agonists promote cellular invasion by increasing matrix metalloproteinase activity[J].Mol Cancer Res,2006,4(7):437-447.
[9]El Andaloussi A,Sonabend AM,Han Y,et al.Stimulation of TLR9 with CpG ODN enhances apoptosis of glioma and prolongs the survival of mice with experimental brain tumors[J].Glia,2006,54(6):526-535.
[10] Droemann D,Albrecht D,Gerdes J,et al.Human lung cancer cells express functionally active Toll-like receptor 9[J].Respir Res,2005,6(1):1-10.
[11]Schmausser B,Andrulis M,Endrich S,et al.Toll-like receptors TLR4,TLR5 and TLR9 on gastric carcinoma cells:an implication for interaction with Helicobacter pylori[J].Int J Med Microbiol,2005,295(3):179-185.
[12]Ilvesaro JM,Merrell MA,Swain TM,et al.Toll-like receptor-9 agonists stimulate prostate cancer invasion in vitro[J].Prostate,2007,67(7):774-781.
[13]Leifer CA,Kennedy MN,Mazzoni A,et al.TLR9 is localized in the endoplasmic reticulum prior to stimulation[J].J Immunol,2004,173(2):1179-1183.
[14]Brinkmann MM,Spooner E,Hoebe K,et al.The interaction between the ER membrane protein UNC93B and TLR3,7 and 9 is crucial for TLR signaling[J].JCell Biol,2007,177(2):265-275.
[15]Kim YM,Brinkmann MM,Paquet ME,et al.UNC93B1 delivers nucleotide-sensing toll-like receptors to endolysosomes[J].Nature,2008,452(7184):234-238.
[16]Tanaka J,Sugimoto K,Shiraki K,et al.Functional cell surface expression of toll-like receptor 9 promotes cell proliferation and survival in human hepatocellular carcinomas[J].Int JOncol,2010,37(4):805-814.

