超聲破碎變異鏈球菌后蛋白質(zhì)提取條件的優(yōu)化研究
劉 果,何永紅,萬呼春,鐘曉波,齊 進(jìn)△
(1.重慶醫(yī)科大學(xué)附屬口腔醫(yī)院400015;2.口腔疾病研究國家重點(diǎn)實(shí)驗(yàn)室/四川大學(xué),成都610041;3.四川大學(xué)華西口腔醫(yī)院內(nèi)科,成都610041)
變異鏈球菌(streptococcus mutans,以下簡稱變鏈菌)屬革蘭陽性球菌,以其較強(qiáng)的產(chǎn)酸、耐酸及黏附能力成為牙菌斑生物膜中的優(yōu)勢(shì)菌,是導(dǎo)致齲病的重要致病菌之一[1]。目前,已有研究表明,多種藥物成分可有效抑制變鏈菌生長,但具體作用機(jī)制未知。雙向電泳(two-dimensional electrophoresis,2DE)作為蛋白質(zhì)組學(xué)研究的核心技術(shù),能夠?qū)f種蛋白質(zhì)實(shí)現(xiàn)分離,動(dòng)態(tài)分析細(xì)菌蛋白質(zhì)的表達(dá)變化,在研究致齲機(jī)制、藥物抑菌機(jī)制等方面具有重要意義[2-4]。而如何增大樣品蛋白質(zhì)的提取量并提高其溶解度是蛋白質(zhì)組研究的關(guān)鍵步驟[5]。超聲法破碎細(xì)菌提取樣品蛋白質(zhì)是常用方法,本研究采用超聲法破碎細(xì)菌,并對(duì)如何提高蛋白質(zhì)的提取效率進(jìn)行研究,為開展變鏈菌的蛋白質(zhì)組學(xué)進(jìn)行探索,為變鏈菌致齲機(jī)制的研究提供基礎(chǔ)。
1 材料與方法
1.1 主要儀器和試劑 變異鏈球菌ATCC25175(四川大學(xué)口腔疾病研究國家重點(diǎn)實(shí)驗(yàn)室提供),TPY培養(yǎng)基,裂解液(30 mmol/L Tris-Hcl,7mol/L脲,2mol/L硫脲,4%CHAPS,1%DTT,5mmol/L PMSF),RC DC 蛋白定量試劑盒(BIO-RAD公司,美國),超聲破碎儀(Sanyo公司,日本),微型垂直電泳系統(tǒng)和BIO-RAD 2000凝膠成像分析系統(tǒng)(BIO-RAD 公 司,美國)。
1.2 實(shí)驗(yàn)方法
1.2.1 細(xì)菌培養(yǎng)及收集 細(xì)菌復(fù)蘇后接種TPY瓊脂平板,37℃兼性厭氧(80%N2,10%H2,10%CO2)培養(yǎng)24h,挑取單菌落接種TPY液體培養(yǎng)基,37℃兼性厭氧培養(yǎng)18h,收集菌懸液。4℃12 000×g離心10min,棄上清液,細(xì)菌沉淀用含氯霉素(100μg/mL)雙蒸水洗滌2次后重懸于不含氯霉素的雙蒸水中。調(diào)整菌懸液Mcf(麥?zhǔn)现担?.8左右,濃縮40倍后將菌懸液按每管1mL分裝于離心管中,4℃12 000×g離心10 min,收集菌沉淀,-20℃保存?zhèn)溆谩?/p>
1.2.2 超聲破碎菌體 取-20℃保存的菌沉淀,加入裂解液1mL,冰浴條件下采用超聲法(超聲功率300~350W,工作9.9s,間歇9.9s,循環(huán)152次)裂解細(xì)菌。超聲結(jié)束時(shí)將菌懸液振蕩混勻。
1.2.3 掃描電鏡觀察裂解前、后菌體形態(tài) 分別取等量裂解前和裂解后菌懸液。將細(xì)菌懸液與等量5%戊二醛混合,4℃固定過夜。經(jīng)磷酸鹽緩沖液(PBS)液(pH7.2)洗3次,調(diào)整細(xì)胞懸液濃度為108~107CFU。取10μL滴于1cm×1cm大小載玻片上,50℃干燥10min使細(xì)菌固定。30%、40%、50%、60%、70%、80%、90%和100%梯度乙醇梯度脫水各10min,由醋酸異戊酯浸泡2h。常規(guī)臨界點(diǎn)干燥,鍍金,掃描電鏡觀察樣本。
表1 放置不同時(shí)間提取的蛋白質(zhì)樣本吸光度A值(s,CV,n=3)
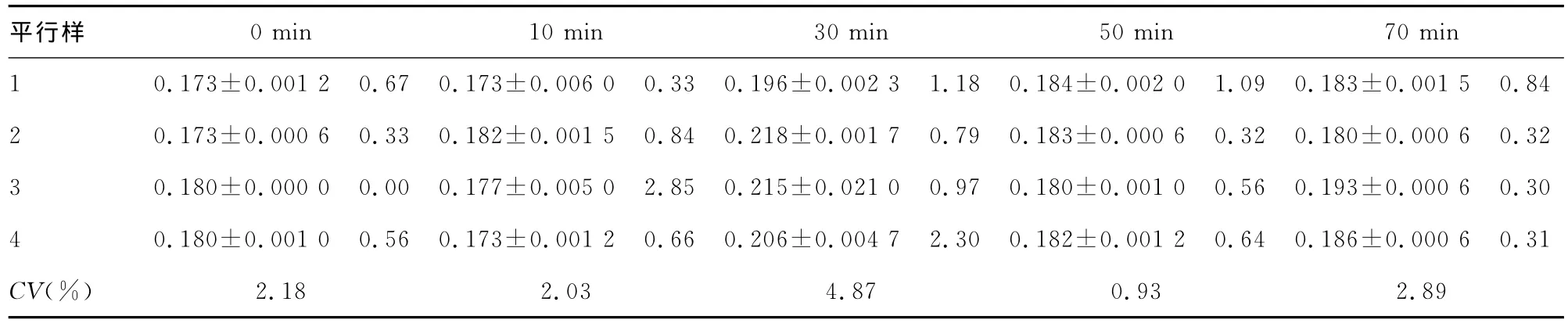
表1 放置不同時(shí)間提取的蛋白質(zhì)樣本吸光度A值(s,CV,n=3)
0min 10min 30min 50min 70min平行樣.84 2.18 2.03 4.87 0.93 2.89
1.2.4 提取不同放置時(shí)間點(diǎn)菌懸液蛋白 將超聲破碎后的菌懸液分裝于1mL滅菌EP管中,分別編號(hào)為a、b、c、d、e,對(duì)應(yīng)室溫中放置時(shí)間0、10、30、50、70min。每個(gè)時(shí)間點(diǎn)設(shè)4個(gè)平行管。放置時(shí)間結(jié)束后,各管分別振蕩混勻,然后4℃16 060×g離心10min,取上清液進(jìn)行分析。
1.2.5 SDS-PAGE測(cè)定不同放置時(shí)間蛋白質(zhì)構(gòu)成的差異 按《蛋白質(zhì)技術(shù)手冊(cè)》制備SDS-PAGE,濃縮膠為5%,分離膠為12%。取各時(shí)間點(diǎn)的蛋白質(zhì)提取液20uL,分別加入上樣緩沖液混勻制成電泳樣本。將電泳樣本注入SDS-PAGE加樣孔中,濃縮膠80V電泳30min,分離膠120V電泳90min停止。考馬斯亮藍(lán)染色30min,再用脫色液脫色至背景清晰。每個(gè)電泳樣本重復(fù)2孔,電泳及染色重復(fù)3次。凝膠成像分析系統(tǒng)觀察并采集圖像。
1.2.6 RC DC法測(cè)定不同時(shí)間點(diǎn)蛋白質(zhì)濃度
1.2.6.1 蛋白質(zhì)標(biāo)準(zhǔn)系列配制 稱取一定量BSA溶解于提取液對(duì)照中,配制蛋白質(zhì)標(biāo)準(zhǔn)系列,標(biāo)準(zhǔn)系列濃度為0、0.25、0.5、0.75、1.0和1.5mg/mL。
1.2.6.2 蛋白質(zhì)濃度測(cè)定 從各時(shí)間點(diǎn)的上清液中分別取25μL于EP管。按照RC DC試劑盒說明操作,取最終的反應(yīng)液200μL于96孔板中,在750nm波長處測(cè)定每孔的吸光度值(A)。每個(gè)樣本設(shè)3個(gè)平行孔。
1.3 統(tǒng)計(jì)學(xué)處理 采用SPSS13.0統(tǒng)計(jì)軟件對(duì)數(shù)據(jù)進(jìn)行處理,對(duì)蛋白質(zhì)質(zhì)量濃度的比較采用單因素方差分析,以P<0.05為差異有統(tǒng)計(jì)學(xué)意義。
2 結(jié) 果
2.1 細(xì)菌破碎程度分析 未處理的變鏈菌收集后互相重疊呈團(tuán)聚狀,數(shù)量多,密度大,如圖1A所示。高倍鏡下觀變鏈菌菌體形態(tài)完整飽滿,在同一平面上分裂并相互粘連,如圖1B所示。超聲處理后絕大部分細(xì)菌破碎成絮狀碎片,僅見極少量破裂不完全和形態(tài)完整的細(xì)菌,如圖1C、D所示。
2.2 放置時(shí)間對(duì)提取蛋白質(zhì)構(gòu)成成分的影響 圖2為裂解后從放置不同時(shí)間后的菌懸液中提取的蛋白質(zhì)電泳圖譜。由圖顯示放置不同時(shí)間后裂解液中的蛋白質(zhì)經(jīng)SDS-PAGE分離后的條帶分布完全一致,同時(shí)條帶豐度也無明顯差異。
2.3 放置時(shí)間對(duì)提取蛋白質(zhì)濃度的影響 蛋白質(zhì)標(biāo)準(zhǔn)曲線為Y=0.118 9 X-0.002,相關(guān)系數(shù)為 0.996 1,其中 X為蛋白質(zhì)濃度,Y為吸光度值。各時(shí)間點(diǎn)上清液樣本的3個(gè)平行孔的變異系數(shù)CV(%)范圍在0%~2.9%之間。各時(shí)間點(diǎn)4個(gè)平行樣本吸光度值變異系數(shù)CV(%)范圍為0.93%~4.87%之間,結(jié)果見表1。各時(shí)間點(diǎn)上清液的蛋白質(zhì)濃度見圖3所示。由圖可見,超聲結(jié)束后室溫放置30min時(shí)裂解液中蛋白質(zhì)含量最高。對(duì)5組進(jìn)行單因素方差分析,結(jié)果顯示放置30min和70min時(shí)裂解液中的蛋白質(zhì)含量均高于其他3組,差異有統(tǒng)計(jì)學(xué)意義(P<0.05);同時(shí),放置30min時(shí)裂解液中的蛋白質(zhì)含量顯著高于70min時(shí)(P<0.05);而放置0、10和50min的裂解液中的蛋白質(zhì)含量比較差異無統(tǒng)計(jì)學(xué)意義(P>0.05)。

圖1 超聲裂解前、后的變鏈菌形態(tài)
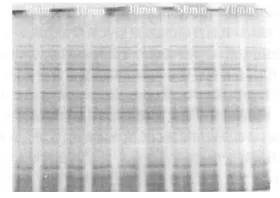
圖2 裂解后放置不同時(shí)間提取的蛋白質(zhì)SDS-PAGE圖譜

圖3 放置不同時(shí)間提取的蛋白質(zhì)樣本質(zhì)量濃度
3 討 論
變異鏈球菌屬于革蘭陽性菌,細(xì)胞壁厚且堅(jiān)韌難以破碎,一般采用的破碎方法有反復(fù)凍融結(jié)合超聲法、氧化鋁粉末混合研磨法、玻璃珠勻漿法以及高壓法等[6-8]。超聲波破碎法是目前提取細(xì)菌蛋白時(shí)常用的技術(shù)手段[9-10]。Thongboonkerd等[11]研究認(rèn)為僅通過超聲即可使化膿性鏈球菌達(dá)到80%的破碎,但無明確評(píng)價(jià)細(xì)菌破碎程度的指標(biāo)。超聲破碎法在大大提高蛋白質(zhì)提取效果的同時(shí),還能增加蛋白質(zhì)的溶解性[12],且可避免外源性蛋白質(zhì)對(duì)樣本的污染[13]。已有實(shí)驗(yàn)表明超聲破碎變鏈菌效果明顯[9,14],而在變鏈菌蛋白質(zhì)組研究中,如何提取樣本的最大量對(duì)結(jié)果至關(guān)重要。本實(shí)驗(yàn)將超聲破碎結(jié)束的變鏈菌菌懸液分別放置不同時(shí)間,在菌體內(nèi)的蛋白質(zhì)充分溢出并溶解后,對(duì)其中的蛋白進(jìn)行構(gòu)成及量的測(cè)定,探索放置時(shí)間對(duì)菌懸液中蛋白質(zhì)提取效率的影響。SDS-PAGE電泳可根據(jù)相對(duì)分子質(zhì)量的不同分離混合蛋白質(zhì),是分析各蛋白質(zhì)構(gòu)成變化的有效手段[14]。本實(shí)驗(yàn)電泳結(jié)果顯示,超聲后放置不同時(shí)間的菌懸液中蛋白質(zhì)的條帶分布及豐度基本相同,提示放置時(shí)間對(duì)菌懸液中蛋白質(zhì)的構(gòu)成無明顯影響,但對(duì)濃度的影響無法通過SDS-PAEG電泳精確展示。本實(shí)驗(yàn)采用的RC DC試劑盒法以Lowry法為基礎(chǔ),并能夠兼容裂解液中多種試劑成分,同其他蛋白質(zhì)定量測(cè)定方法相比,具有精密度高、準(zhǔn)確性好等特點(diǎn)[15-16]。定量結(jié)果表明,超聲破碎后放置30min的菌懸液中蛋白質(zhì)的濃度最高;放置時(shí)間少于30min的菌懸液,隨時(shí)間的延長蛋白質(zhì)濃度逐漸升高,而超過30min所提取的蛋白質(zhì)隨時(shí)間的延長濃度下降。
經(jīng)掃描電鏡觀察,大部分細(xì)菌破裂后呈絮狀碎片,極小部分細(xì)菌呈現(xiàn)清晰的殘余菌體形態(tài),個(gè)別變鏈菌菌體較為完整。提示胞壁破裂完全的細(xì)菌胞內(nèi)物質(zhì)已充分外流,蛋白質(zhì)等內(nèi)容物的釋放較徹底。而形態(tài)完整的細(xì)菌胞壁上可能存在有較小的裂口,猜測(cè)它們和存在殘余菌體的變鏈菌胞內(nèi)物質(zhì)的釋放需要一定時(shí)間完成。在測(cè)定蛋白質(zhì)質(zhì)量濃度時(shí),需保證菌體內(nèi)釋放的蛋白質(zhì)充分溶解于提取介質(zhì)中。而當(dāng)?shù)鞍踪|(zhì)的釋放量少,或出現(xiàn)蛋白降解、沉淀等情況時(shí),即導(dǎo)致提取介質(zhì)中蛋白質(zhì)的溶解減少,使測(cè)量濃度偏低。本實(shí)驗(yàn)采用的提取液中含有的脲和硫脲等可以充分破壞蛋白質(zhì)之間形成的氫鍵,防止由氫鍵引起的蛋白質(zhì)聚集。還原劑DTT能夠幫助打開蛋白質(zhì)的二硫鍵,促進(jìn)半胱氨酸殘基被還原,使已變性的蛋白質(zhì)展開更完全,溶解更徹底。而蛋白酶抑制劑PMSF可有效抑制細(xì)菌自身所釋放的蛋白酶對(duì)蛋白質(zhì)的降解。由數(shù)據(jù)可看出,蛋白質(zhì)質(zhì)量濃度與裂解后放置時(shí)間在0~30min范圍內(nèi)成正相關(guān)。由此提示,一方面,蛋白質(zhì)的釋放可能隨時(shí)間的延長增加;另一方面,提取介質(zhì)中復(fù)雜的試劑成分與蛋白質(zhì)、水解酶的相互作用可能并沒有伴隨裂解過程的結(jié)束而終止,而在裂解后的一段時(shí)間內(nèi)繼續(xù)進(jìn)行。同時(shí),蛋白酶抑制劑PMSF主要抑制絲氨酸蛋白酶和巰基蛋白酶,而菌體內(nèi)釋放的其他蛋白酶可能仍存在活性,它們?cè)谌芙夂笈c蛋白質(zhì)相互作用,導(dǎo)致蛋白質(zhì)濃度的降低。但放置30~70min與蛋白質(zhì)濃度的相關(guān)性無明顯規(guī)律,具體作用機(jī)制需進(jìn)一步探索。
[1]周學(xué)東,肖曉蓉.口腔微生物學(xué)[M].成都:四川大學(xué)出版社,2002:12-28.
[2]Hrimech M,Mayrand D,Grenier D,et al.Xylitol disturbs protein synthesis,including the expression of HSP-70and HSP-60,in Streptococcus mutans[J].Oral Microbiol Immunol,2000,15(2):249-257.
[3]Visith TH,Jirapon L,Junkai C,et al.Fluoride exposure attenuates expression of streptococcus pyogenes virulence factors[J].J Biolog Chem,2002,277(19):16599-16605.
[4]Brighenti,Luppens.Effect of psidium cattleianum leaf extract on streptococcus mutans viability,protein expression and acid production[J].Caries Res,2008,42(2):148-154.
[5]談旭翡,陳智.蛋白質(zhì)組學(xué)研究中雙向電泳樣本的制備[J].醫(yī)學(xué)分子生物學(xué)雜志,2008,5(5):462-465.
[6]Wilkins JC,Homer KA,Beighton D.Analysis of streptococcus mutans proteins modulated by culture under acidic conditions[J].Appl Environ Microbiol,2002,6(15):2382-2390.
[7]Welin J,Wilkins JC,Beighton D,et al.Effect of acid shock on protein expression by bioflm cells of streptococcus mutans[J].FEMS Microbiol Letters,2003,227(2):287-293.
[8]牛屹東,馮捷,崔恒,等.蛋白質(zhì)雙向電泳實(shí)驗(yàn)手冊(cè)[M].北京:北京大學(xué)醫(yī)學(xué)出版社,2006:1-13.
[9]何永紅,田曉蓓,萬呼春,等.變異鏈球菌蛋白提取方法研究[J].華西口腔醫(yī)學(xué)雜志,2009,27(1):100-103.
[10]Alice C,Len L.Harty DW.Stress-responsive proteins are upregulated in streptococcus mutans during acid tolerance[J].Microbiology,2004,150(11):1339-1351.
[11]Thongboonkerd V,Luengpailin J,Cao JK,et al.Fluoride exposure attenuates expression of streptococcus pyogenes virulence factors[J].J Biol Chem,2002,19(277):16599-16605.
[12]Ca?as B,Pi?eiro C,Calvo E,et al.Trends in sample preparation for classical and second generation proteomics[J].J Chromatogr A,2007,1153(2):235-258.
[13]Rathsam C,Eaton RE,Simpson CL,et al.Two-dimensional fluorescence difference gel electrophoretic analysis of streptococcus mutans biofilms[J].J Proteome Res,2005,4(6):2161-2173.
[14]田曉蓓,韓建國.超聲時(shí)間對(duì)提取變異鏈球菌蛋白質(zhì)的實(shí)驗(yàn)研究[J].徐州醫(yī)學(xué)院學(xué)報(bào),2010,30(8):527-529.
[15]Mey MD,Lequeux GJ,Maertens J,et al.Comparison of protein quantification and extraction methods suitable for E.coli cultures[J].Biologicals,2008,36(3):198-202.
[16]Okutucu B,Din?e A,Habib?,et al.Comparison of five methods for determination of total plasma protein concentration[J].J Biochem Biophys Methods,2007,70(5):709-711.

