刺槐開花傳粉及交配方式1)
孫 鵬 戴 麗 胡瑞陽 習 洋 李允菲 袁存權 孫 妍 李 云
(林木育種國家工程實驗室(北京林業大學),北京,100083)
刺槐(Robinia pseudoacacia)屬于雌雄同花植物,原生于北美洲,后被廣泛引種到歐洲、亞洲等地。刺槐葉片含有大量粗蛋白,可作飼料。刺槐木質堅硬且具有發達的根系。刺槐根部有根瘤,有提高地力之效;刺槐具有很強的抗旱能力,能夠適應石質山地的干旱環境。刺槐的花屬于蝶形花,開花時香氣四溢,并且可供食用[1]。此外,刺槐還是一種重要的蜜源植物。綜上所述,刺槐具有很好的生態和經濟價值。但刺槐的應用還存在一些亟待解決的問題,例如,有些刺槐無性系速生性好,但抗性差;有些抗性強,但干型差或生長慢;有些葉片粗蛋白含量高,但生物量低等[2]。目前,刺槐改良以選種為主,但其選種是建立在實生刺槐林自由授粉的基礎上,變異程度低,選擇偶然性大,人為控制能力差。如果能夠采用控制授粉實現刺槐雜交育種,必將提高刺槐改良程度。然而,本實驗室通過多年研究發現刺槐雜交時去雄操作技術要求高、難度大,雜交結實率非常低,特別是去雄和套袋操作對刺槐的授粉受精和坐果影響嚴重。Dini-papanastasi et al.[3]對刺槐雜交育種的報道也發現雜交結實率低的現象。雜交工作在開花期進行,包括去雄、套袋、授粉等對花展開的操作。另外,雜交的成功還有賴于外源花粉的親和能力。鑒于此,詳細了解刺槐的開花傳粉及交配方式對于提高刺槐的雜交育種工作水平具有重要的意義。近年來,國內外對刺槐開花特性的研究還比較少,主要有郝晨等[4]和姜金仲等[5]對四倍體刺槐花器官變異的報道,而二倍體刺槐的有關研究還未見報道。本研究關于刺槐花部外形、花粉萌發、柱頭可授性的研究對于雜交時去雄時機的選擇,花粉采集時間和儲存方式以及授粉時機的選擇具有指導意義。此外,關于刺槐天然群體的交配方式目前看法仍不一致,Surles et al.[6]利用等位酶技術研究認為刺槐天然群體異交率高達80%以上,而原法憲[7]認為刺槐是高度自交的樹種。另外,Lian et al[8]從9個刺槐無性系采集種子,發現這些種子是高度自交的。針對上述疑問,本研究從刺槐的開花特性和傳粉生物學入手,以延慶實生刺槐林為試材,以期闡明刺槐天然狀態下自交及異交的親和能力。該研究結果將有助于刺槐雜交時親本的選擇,以及提高刺槐雜交結實率。
1 試驗區概況
試驗地選在北京市延慶縣米家堡苗圃(N40°29.748'~ 40°30.276',E115°59.192'~ 115°59.883'),延慶位于北京城區西北70 km處,屬大陸性季風氣候,處于溫帶與中溫帶、半干旱與半濕潤帶的過渡地帶。氣候冬冷夏涼,年平均氣溫8℃,刺槐多在5月底6月初開花。延慶米家堡苗圃的刺槐林為人工刺槐實生林。林區面積約6 hm2。所選樣樹高6~7 m,地徑12~15 cm,胸徑8~10 cm,為開花結實盛期的成年植株。
2 材料與方法
開花生物學特性觀察:選擇生長正常、樹體健壯的3株刺槐成年植株,于開花后1 d在選定的每株樹上隨機選取3個正常花序,利用游標卡尺測量花序長和花序直徑,然后在每個花序上選擇10朵花,測量小花長、小花直徑、花柱長、柱頭與花藥的最長和最短距離。
花粉形態觀察:采集開花前2 d、開花當天、開花后24 h、開花后48 h及開花后72 h的花,用FAA固定。然后經叔丁醇干燥,鍍金,利用掃描電子顯微鏡觀察花粉形態并照相。
花粉體外萌發試驗:開花當天采集花粉,放在培養皿中,加硅膠使其干燥,并于常溫保存。用TTC法[9]測定花粉保存 24、48、72 h 后的活力。
花粉體內萌發試驗:首先在開花散粉前人工去雄套袋,然后在適授期授粉,于授粉后2、6、10、24、48 h采集花朵,用FAA固定,根據胡適宜[10]報道的方法染色壓片后在熒光顯微鏡下觀察花粉萌發及花粉管生長情況。本試驗材料取自3棵生長狀況良好的單株,每個單株設3次重復。
柱頭可授性試驗:于幼花期、將開花期(該時期為本文叫法,特指開花前1~2 d的時期,圖1A,下同)、開花當天、開花后24 h、開花后48 h,以及開花后 72 h 采集花朵,參照 Suwan et al.[11]的方法,利用掃描電子顯微鏡觀察柱頭形態,判斷其可授性。試驗材料取自3棵生長狀況良好的單株,每個單株設3次重復。
傳粉方式檢測:在盛花期選取3株間隔50 m的刺槐單株觀察其傳粉媒介。在每個單株4周8個方位布置涂布凡士林的載玻片各2枚,凡士林涂布面積為2.5 cm×5.0 cm,露置1 d后收回,鏡檢以風為媒介散布花粉的數量。刺槐花粉的鑒定以其花粉的大小和形狀與單獨采制的標準花粉對比計數。
在野外選擇間隔50 m以上的3株生長狀況良好的刺槐單株,每個單株選擇10個花序,于開花后連續3 d,每天分6個時段:8:00—8:30、10:00—10:30、12:00— 12:30、14:00—14:30、16:00—16:30、18:00—18:30進行觀察,分別記為時段1至時段6。同時,對刺槐植株上的訪花昆蟲進行觀察并拍照,凡發現有昆蟲訪花并在花上停留者,就用乙烯瓶捕捉、殺死并鑒定。同時記錄每植株上所有來訪昆蟲的訪花次數,并計算訪花頻率,訪花頻率的計量方法為10個花序在30 min內被訪問的次數。
雜交指數估算:按照李昆等[12]研究小桐子的標準進行花序直徑、花朵大小和開花行為的測量及交配系統的評判。具體方法:花朵直徑(D)D<1 mm記為0,1 mm≤D<2 mm 記為1,2 mm≤D<6 mm 記為2,D>6 mm記為3;花藥開裂時間與柱頭可授期之間的時間間隔,同時或雌蕊先熟記為0,雄蕊先熟記為1;柱頭與花藥的空間位置,同一高度記為0,空間分離記為1。
上述三者之和為OC,I值。評判標準為:OC,I為 0時,交配系統為閉花受精;OC,I=1時,交配系統為專性自交;OC,I為 2 時,交配系統為兼性自交;OC,I為 3時,交配系統為自交親和,有時需要傳粉者;OC,I為4時,交配系統為部分自交親和,異交需要傳粉者。
花粉量及P/O值(花粉數/胚珠數)的測定:隨機選取10棵樹,每棵樹隨機選取3朵花藥尚未開裂的小花,取小花的全部花藥,用 0.1 mol·L-1HCl溶液在60℃下水解去除藥壁,制成2 mL花粉粒懸浮液,吸取5 μL于顯微鏡下觀察統計花粉數量,重復取樣觀察5次,取均值再乘以400(2 mL=5 μL×400)則為單花花粉數。取子房在解剖鏡下用解剖針劃開心皮,觀測并記錄胚珠數。最后計算花粉與胚珠的比值。按 Cruden[13]的標準,P/O為 2.7 ~5.4時,其交配系統為閉花受精;P/O為18.1~39.0時,交配系統為專性自交;P/O為31.9~396.0時,交配系統為兼性自交;P/O為244.7~2588.0時,交配系統為兼性異交;P/O為2108.0~195525.0時,交配系統為專性異交。
授粉試驗:選擇4株生長狀態良好、間隔50 m以上、上一年天然狀態下結實率較高的刺槐個體,進行完全雙列雜交。參考李昆等[12]描述的方法進行下述處理:天然授粉,是不套袋,不去雄,自由傳粉,用于檢測自然條件下的傳粉情況;自交,對花進行套袋但不去雄,檢測自交能力;雜交,套袋并且去雄,用不同植株的花粉進行異花授粉;去雄不套袋,自然條件下異花傳粉,對花進行去雄但不套袋,使去雄后的花在天然狀態下異花授粉;孤雌生殖,對花進行去雄并套袋,但不授粉,使子房在沒有花粉的情況下生長發育;競爭授粉,對花進行套袋但不去雄,人工授以異株花粉,在排除自交不親和以及去雄影響的前提下,觀察套袋對坐果率的影響。每種交配組合選5個花序,每花序保留10朵小花。在授粉后1周、1個月和3個月分別統計各交配類型的坐果率。其中坐果率=(結實數/開花數)×100%。
試驗所用的花除自然授粉和自交外,均在將開花期去雄。這一時期花瓣閉合,花藥未開裂,柱頭表面干凈無花粉。去雄后套袋隔離。授粉4 d(4 d時間足夠花粉管生長到子房完成受精;4 d后柱頭可授性大大下降,新的花粉難以萌發;去袋太晚會影響花的正常發育)后將硫酸紙袋去掉。人工授粉時間應在去雄后2 d內,否則柱頭干燥,且可授性差。在試驗期間,對套袋的花朵經常進行檢查,并揭袋換氣,防止花朵霉壞,換氣時嚴格防止昆蟲在花序附近活動。在授粉后1周(6月9日)、授粉后1個月(7月15日)以及授粉后4個月(10月20日)分別統計各交配組合的坐果率。由于4株樹中的1株在授粉后遭到了破壞,因此,只統計其余3株的坐果率。
3 結果與分析
3.1 花朵表型性狀
刺槐花為總狀花序、蝶形花、兩性花、雌雄同花,雄蕊10枚圍繞在雌蕊周圍。各雄蕊與柱頭距離并不一致,距離最短的1.5 mm左右,距離最長的為4.5 mm左右。有些單株花萼為綠色,有些單株花萼略帶紅色(圖1A)。花冠為白色,開花時香氣濃郁。花的各項表型性狀,即:花序長、花序直徑、小花長、小花直徑、花柱長、柱頭與花藥的最長距離、柱頭與花藥的最短距離分別為(112.53±6.71)、(33.67±1.95)、(24.37±0.20)、(11.49±0.30)、(7.05±0.06)、(4.53±0.11)、(1.48±0.08)mm。

圖1 刺槐花形態、訪花昆蟲以及花粉管在花柱中生長
3.2 花粉形態觀察
刺槐花粉近橢圓形,直徑15~30 μm,具3個萌發溝,萌發溝處著色較深(圖2A)。花粉外壁粗糙具有深刻而清晰的一級網狀紋飾和微小的顆粒狀次級雕紋且富有黏性(圖2B),是蟲媒花花粉粒的主要形態特征。因此,刺槐的花粉在形狀、大小和外壁表面紋飾等方面的特征符合蟲媒花的主要特征,花粉的形態特征與傳粉的方式是相適應的,刺槐花粉的形態特征有利于花粉粘附在昆蟲身體上傳播。開花當天落在柱頭上的花粉有些已經開始長出花粉管,花粉外形依然飽滿;開花24 h后柱頭上的花粉大量長出花粉管,其外形開始皺縮(圖2F);開花48 h后柱頭上的花粉進一步皺縮,大部分花粉已完成萌發。
3.3 花粉萌發
TTC法表明花粉在收集后24 h具有活力的占87.67%,收集后48 h具有活力的占23.78%,收集后72 h具有活力的占16.83%。
花粉管體內生長試驗是將花粉授到提前去雄(去雄到授粉不超過2 d)的花的柱頭上,然后每隔一定時間觀察花粉管生長情況。結果表明,授粉后2 h花粉已經開始萌發(圖1C),授粉后6 h已有少量花粉管生長到花柱基部(圖1D),授粉后24 h花粉管完全生長到子房內(圖1E),授粉后48 h花柱內的花粉管依然清晰可見(圖1F)。
3.4 柱頭可授性
幼花期的柱頭干燥且缺乏黏液,可授性較差(圖2C);將開花期的柱頭上黏液較多,而且幾乎沒有附著花粉,這一時期是去雄的好時機(圖2D);開花當天柱頭黏液很多,表現出最佳的可授性,柱頭上已沾染大量的花粉粒,這一時期去雄已晚,但卻是授粉的最佳時期(圖2E);開花后24 h柱頭上依然有大量黏液,附著的花粉粒已經萌發出花粉管(圖2F);開花后48 h柱頭上黏液明顯減少,有些柱頭開始解體,形狀變得不規則,說明柱頭可授性開始下降(圖2G);開花后72 h柱頭上黏液已經很少,柱頭進一步降解,形狀更加不規則,此時柱頭可授性已經很差(圖2H)。綜上所述,去雄的時機應選在將開花期,然后,必須在去雄后2d內完成授粉,這樣既可以防止柱頭被非目標花粉污染,又可以使得柱頭與目標花粉親和性最佳。另外,需要指出的是,利用掃描電鏡觀察時,柱頭已經過干燥處理,但是黏液中含有的糖、氨基酸類物質會使柱頭表面顯得模糊,觀察時看不清柱頭表面乳突結構,據此可以判斷柱頭表面是否具有黏液。
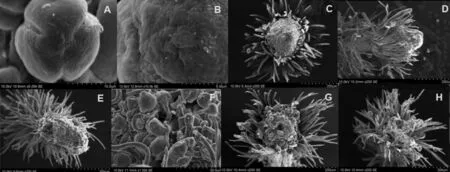
圖2 花粉及柱頭表型的掃描電鏡觀察
3.5 刺槐傳粉媒介分析
3.5.1 風媒傳粉觀測
用重力載玻片法檢測到刺槐花粉風力傳播能力極其有限,每個單株載玻片上粘黏花粉數如表1。利用顯微鏡觀察載玻片,幾乎所有視野都觀察不到花粉,只有極個別視野內分布有高度集中的花粉。如果把柱頭看成半球形,則其半徑最長0.05 cm,表面積最大0.015 7 cm2(S=4πr2)。如表1,每平方厘米載玻片露置1 d后平均粘黏花粉量為7.50粒,則柱頭露置1 d平均粘黏花粉為0.1粒。這樣的效率說明風媒對刺槐傳粉的貢獻微乎其微。
3.5.2 蟲媒傳粉觀測
刺槐的花萼有的呈紅色,有的呈綠色,花冠呈白色,在綠葉襯托下非常顯眼。刺槐花香氣濃郁,對訪花者極具吸引力。刺槐種群記錄到的訪花者可分為3類:分別為膜翅目的蜂類和蟻類,以及雙翅目的蠅類。其中蜂類的蜜蜂為刺槐的最主要訪花昆蟲。蜜蜂訪花時身體位于旗瓣和龍骨瓣之間,頭部伸向花萼基部蜜腺處,后面的觸手蹬在龍骨瓣上。雌雄蕊此時失去龍骨瓣包裹,與蜜蜂腹部產生接觸,這使得花粉粘附在蜜蜂腹部及觸手上,而柱頭則接觸到蜜蜂攜帶的異源花粉,從而完成蟲媒傳粉過程(圖1B)。從表2可以看出晴好天氣有利于蜜蜂訪花,陰雨和大風天會妨礙昆蟲的訪花行為。蠅類和蟻類訪花頻率極低,且很少直接與花藥柱頭接觸,因此,與蜜蜂相比,其傳粉作用非常微小。綜上所述,刺槐的傳粉方式主要是蟲媒傳粉。
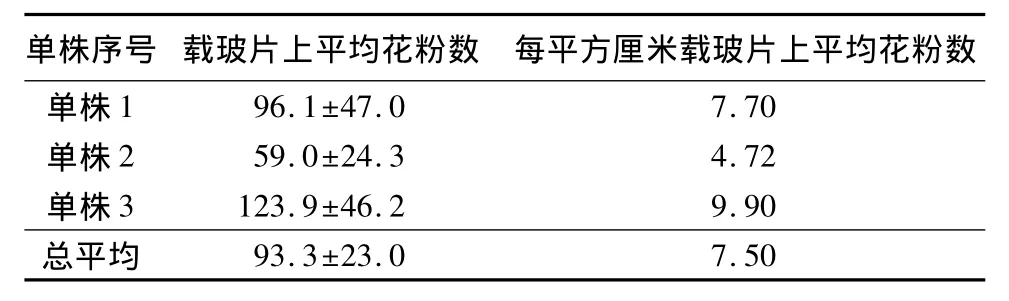
表1 載玻片露置1 d后粘黏花粉粒數 粒
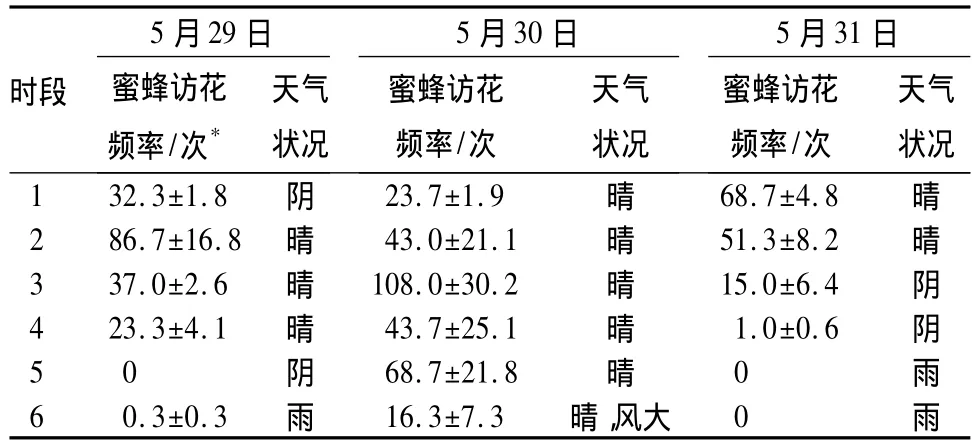
表2 蜜蜂訪花頻率統計
3.6 交配方式評判
3.6.1 刺槐雜交指數
刺槐花朵直徑(11.49±0.30)mm。刺槐柱頭可授性從開花前2 d延續到開花后2 d,這一時期也是花粉成熟散粉的時期,因此,可以認為雌雄蕊成熟時間相同。雌雄蕊在空間上有所分離,雌蕊比雄蕊高1~5 mm。以上幾點使得刺槐雜交指數達到4。根據 Dafni[14]和李昆等[12]的標準,該樹種的交配系統為部分自交親和,異交需要傳粉者(表3)。

表3 刺槐雜交指數
3.6.2 刺槐的花粉—胚珠比(P/O)
刺槐單花的平均胚珠數為(20.37±0.32),單花的平均花粉數為(28 071.67±879.47),花粉—胚珠比(P/O)約為 1 378.09。按 Cruden[13]的標準,刺槐的交配方式為兼性異交。
3.6.3 控制授粉試驗坐果率統計
各交配組合在授粉1周、1個月、4個月后結實率統計如表4。
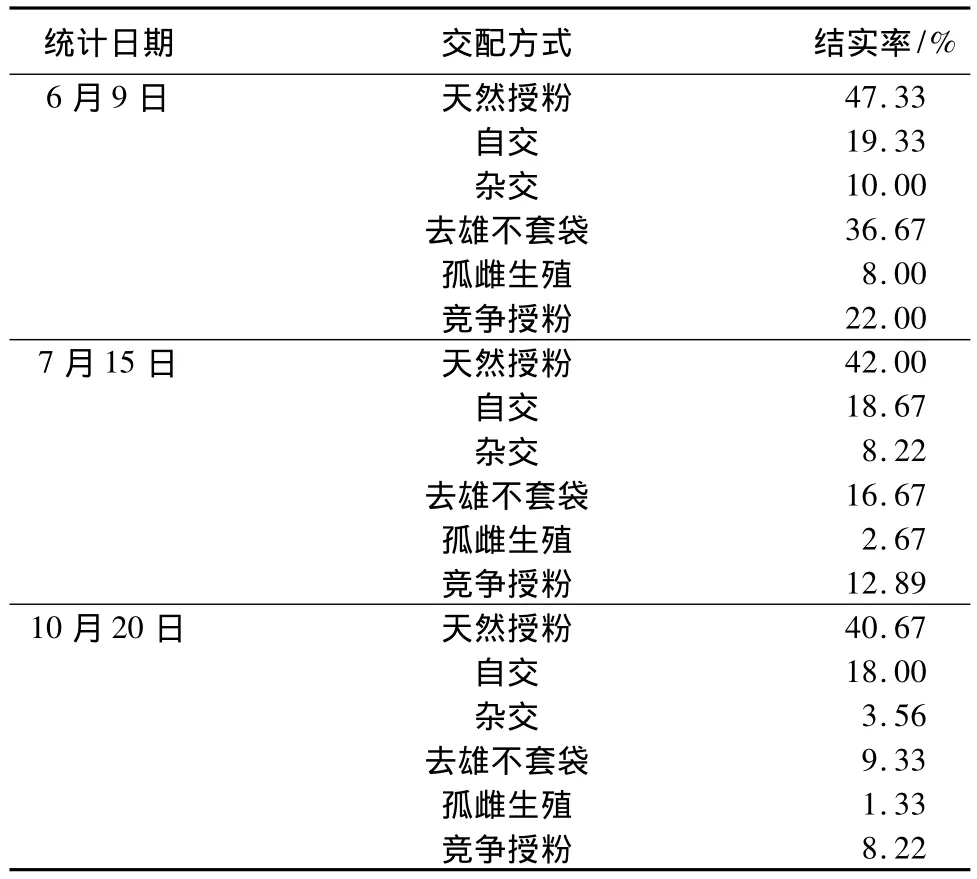
表4 控制授粉結實率統計
刺槐的果實到九十月份才能完全成熟。從10月20日的統計結果看,天然授粉結實率(40.67%)遠遠高于其他交配方式,自交結實率為18.00%,而雜交結實率為3.56%,去雄不套袋結實率為9.33%,孤雌生殖結實率為1.33%,競爭授粉結實率為8.22%。從上述3個時期的統計結果看,各交配組合在授粉后第1周內落花率最高,此后直到果實成熟的幾個月時間內,落花率大大下降,坐果率變化相對較小。
4 結論與討論
何亞平等[15]認為自然界絕對自交或異交的植物種類很少,大多數為兩者兼而有之,即為混合交配的交配模式。植物近交會導致后代衰退,遠交易受環境影響。自然選擇使刺槐形成了以異交為主,部分自交的混合交配系統。Surles et al.[6]以多地刺槐天然大群體為研究對象,利用等位酶標記研究發現,天然狀態下刺槐80%以上為異交,這與本文觀點一致。而原法憲[7]認為刺槐主要是以自交為主的樹種,其主要理由是刺槐在開花前,花藥就已經開裂,從而使得柱頭上沾滿了花粉,這些花粉必然是自花花粉。本試驗通過3年觀察也發現刺槐在開花前柱頭上就已經沾滿了花粉這一現象。既然如此,那么為何 Surles et al.[6]和本文的研究結果都認為刺槐是以異交為主的樹種呢?Hasegawa et al.[16]報道指出板栗在傳粉階段,自花傳粉占到90.2%,而到種子成熟時,自花傳粉所得種子僅僅占0.3%,因此,他指出自交不親和性強烈抑制了自花傳粉種子的生長和發育。Kristina et al.[17]在研究Platypodium elegans時也發現,從授粉結束到種子成熟,再到幼苗長出的過程中,自交后代個體所占的比例不斷下降,尤其從種子成熟以后到幼苗長出這段時間下降更快。此外,他還指出自交所得種子的質量明顯比異交得到的種子輕。據此,猜測刺槐也存在這一機制——從授粉到種子成熟再到幼苗長出的過程,自交后代所占比例逐漸下降,最后存活的個體就主要是異交的后代。關于這一點還需要后續相關的種子成熟、萌發及幼苗生長的對比試驗進行驗證。Lian et al.[8]利用SSR分子標記對從9棵單株上采集的種子進行親本鑒定后認為,這些種子大部分是自交個體。但該試驗樣本取自無性系林分,樣本量小,僅有9個無性系,不足以說明刺槐天然群體的交配類型。在無性系林分中,無性系之間的授粉會受其周圍的無性系個體影響,雖然是異株傳粉,但會有一定程度的相同基因型之間的雜交。因此,該試驗結果不足以代表刺槐天然大群體的異交率。
載玻片粘黏花粉試驗計算得出每平方厘米載玻片上平均黏著花粉數為7.50粒,這一結果只有假設花粉平均分布在載玻片上才可靠。事實上,花粉在載玻片上的絕大部分區域并沒有被觀察到,只有極個別的區域分布有高度集中的花粉粒。如果是風媒傳粉,那么分布在載玻片上的花粉就應該趨于分散。高度集中的花粉粒可能是因為載玻片與雄蕊在風的作用下直接接觸造成的,具體原因還需進一步觀察。根據以上推測,認為風媒對刺槐的傳粉貢獻可以忽略不計,刺槐屬于蟲媒傳粉植物。觀察發現,蜜蜂采蜜時經常就近訪問同一株樹的不同花,這種同株異花授粉依然屬于自交,因為同株花粉基因型相同。此外,由于蜜蜂就近采蜜,雜交的花粉來源也以鄰近的單株為主,這會使得雜交后代基因型與鄰近植株相近,變異幅度有限。
花粉萌發和柱頭可授性試驗表明開花當天散粉量最大,花粉收集后放入加硅膠的培養皿,常溫下保存24 h后萌發率可達80%以上,常溫下保存48 h后萌發率不到30%。野外雜交試驗中,花粉采集后要盡快授粉,否則花粉活力會大大下降。柱頭可授性試驗表明,柱頭適授期從開花前2 d持續到開花后2 d。早于這一時期,柱頭干燥,不易粘黏花粉。晚于這一時期,柱頭開始降解,形狀不規則,缺乏粘液,不利于花粉萌發。雜交試驗去雄時機應盡可能地晚,但是一定要在散粉前,這樣既可以把去雄對花發育的影響降到最小,又能保證柱頭不被自身花粉沾染。去雄后應盡快(2 d內)完成授粉,否則花粉活力和柱頭可授性都將大大下降。
文中的授粉試驗顯示,刺槐天然生長結實率為4 0.66%,自交結實率為18%,雜交結實率為3.56%,孤雌生殖結實率為1.33%。本試驗去雄套袋操作雖然嚴格防止自身和外界花粉污染,但是因為沒有對后代種子進行染色體倍性分析,所以還不能肯定刺槐存在孤雌生殖的現象。
另外,從以上數據看出,刺槐天然生長也存在落花落果現象,這和很多果樹的生理落花落果現象一致,但去雄雜交后刺槐落花落果率急劇增加,這就不是普通意義的生理落花落果,而一定是與去雄或套袋的人工操作有關。雜交過程需要去雄、套袋、授粉(本試驗雜交所用的花粉已被證明是有活性的)三步人工操作,而自交只需要套袋一步人工操作。現假設自交和雜交坐果率低的原因只是套袋(套袋使花處于一個相對封閉的環境,花生長環境中的溫度會升高,光照會減少,風吹時袋對花有可能造成機械損傷作用)引起的,而與去雄無關,那么根據Surles et al.[6]的試驗以及文中觀點,刺槐天然狀態下屬于高度異交樹種,外來花粉更有利于結實,由此推斷刺槐雜交結實率應高于自交,但是從文中雜交試驗結果看,雜交結實率遠遠低于自交,那么在保證雜交所授花粉有活力的前提下,可以確定去雄是造成雜交結實率極低的最主要原因,此外,去雄不套袋花的結實率也低于天然生長和自交,從而進一步斷定去雄是影響花發育和結實率的主要因素。
按照這一推論,人工雜交所得結實率并不能反應自然狀態下刺槐真實的異交結實率。從Dini-papanastasi et al.[3]的報道中也可發現刺槐雜交結實率低的現象。前人在蘭屬[18]和石竹屬[19]以及豇豆[20]等植物中發現去雄會加速花衰老。在酸櫻桃中已有去雄雜交會降低結實率的報道[21]。Hedhly et al.[22]研究甜櫻桃發現,去雄雜交后落花落果率明顯上升,并且去雄雜交后雌蕊在隨后9d內重量增長比天然個體的慢,去雄雜交后10 d內胚珠退化率比天然個體高,并推測去雄后花器官乙烯含量上升是造成以上現象的重要原因之一。此外,從上述3個時期的統計結果看,各交配組合在授粉后第1周內落花率最高,直到果實成熟的三四個月時間內,落花率大大下降,坐果率變化相對較小。因此,研究去雄授粉后1周內花器官生理生化變化,對于了解去雄如何影響花發育及結實率的機理至關重要。綜上所述,去雄對刺槐花發育以及坐果率的影響是值得深入研究的問題。
通過本研究發現刺槐是以異交為主的樹種,因此,雜交育種中使用外源花粉進行授粉是可行的。另外,還發現了刺槐人工雜交結實率低的現象,如果該問題能夠得到解決,那么將極大地提升刺槐的雜交育種工作水平。
[1]Keeler H L.Our native trees and how to identify them[M].New York:Charles Scriber’s Sons,1900:97-102.
[2]張國君.飼料型刺槐優良無性系選育及其栽培利用研究[D].北京:北京林業大學,2010:15-23.
[3]Dini-papanastasi O,Filippos A.Aravanopoulosartificial hybridization betweenRobinia pseudoacaciaL.andR.pseudoacaciavar.monophyllaCarr[J].Forestry,2008,81(1):91-101.
[4]郝晨,李云,姜金仲,等.四倍體刺槐大小孢子發育時期與花器形態的相關性[J].核農學報,2006,20(4):292-295.
[5]姜金仲,郝晨,李云.四倍體刺槐花器原基分化及其成熟表型變異[J].林業科學,2008,44(6):34-41.
[6]Surles S E,Hamrick J L,Bongarten B C.Mating systems in openpollinated families of black locust(Robinia pseudoacacia)[J].Silvae Genetica,1990,29(1):35-40.
[7]原法憲.刺槐開花生物學特性觀察[J].山西林業科技,1987(3):1-10.
[8]Lian C,Oishi R,Miyashita N,et al.High somatic instability of a microsatellite locus in a clonal tree,Robinia pseudoacacia[J].Theor Appl Genet,2004,108:836-841.
[9]胡適宜.植物胚胎學實驗方法(一):花粉生活力的測定[J].植物學通報,1993,10(2):60-62.
[10]胡適宜.植物胚胎學實驗方法(五):檢查花粉在柱頭上萌發和花粉管在花柱中生長的制片法[J].植物學通報,1994,11:58-60.
[11]Suwan T,John N O.Floral biology,pollination,pistil receptivity,and pollen tube growth of teak(Tectona grandisLinn)[J].Annals of Botany,1997,79:227-241.
[12]李昆,尹偉倫,羅長維.小桐子繁育系統與傳粉生態學研究[J].林業科學研究,2007,20(6):775-781.
[13]Cruden R W.Pollen ovule ratios:A conservative indicator of breeding systems in flowering plants[J].Evolution,1977(31):32-36.
[14]Dafni A.Pollination Ecology[M].Oxford:Oxford University Press,1992:59-89.
[15]何亞平,劉建全.植物繁育系統研究的最新進展和評述[J].植物生態學報,2003,27(2):151-163.
[16]Hasegawa Y,Suyama Y,Seiwa K.Pollen donor composition during the early phases of reproduction revealed by DNA genotyping of pollen grains and seeds ofCastanea crenata[J].New Phytologist,2009,182:994-1002.
[17]Kristina M H,Hamrick J L.Viability selection at three early life stages of the tropical tree,platypodium elegans(Fabaceae,papilionoideae)[J].Evolution,2003,57(3):518-526.
[18]Woltering E J,Harren F.Role of rostellum desiccation in emasculation-induced phenomena in orchidfiowers[J].J Exp Bot,1989,40:907-912.
[19]Woltering E J,Somhorst D,de Beer C A.Roles of ethylene production and sensitivity in senescence of carnationfiower(Dianthus caryophyllus)cultivars white sim,chinera and epomeo[J].J Plant Physiol,1993,141:329-335.
[20]劉先斌,宿秀麗,溫海霞.提高長豇豆“去雄套袋雜交法”結實率的關鍵技術[J].作物雜志,2009(2):101-103.
[21]Brown S K,Iezzoni A F,Fogle H W,et al.Fruit breeding:VolⅠ tree and tropical fruits[M].New York:John Wiley& Sons,1996:213-255.
[22]Hedhly A,Hormaza J I,Herrero M.Flower emasculation accelerates ovule degeneration and reduces fruit set in sweet cherry[J].Scientia Horticulturae,2009,119(4):455-457.

