抗人紅細胞單鏈抗體與狂犬病毒G蛋白雙功能融合蛋白的構建及生物學活性檢測*
周松峰,廖文軍,覃紹敏,袁書智,白安斌,吳健敏
狂犬病是由狂犬病病毒(rabies virus,RV)引起的中樞神經系統感染的急性人畜共患傳染病。所有溫血動物都可感染,狂犬病一旦發病,病死率幾乎100%[1],是人類病死率最高的急性傳染病之一。狂犬病病毒G基因編碼的糖蛋白(glycoprotein,GP)是病毒唯一暴露在表面的蛋白[2],是唯一能刺激機體產生中和抗體的病毒蛋白[3],在狂犬病毒致病和免疫中起著關鍵作用[4]。
狂犬病的診斷方法目前主要有中和試驗、免疫熒光試驗、酶聯免疫吸附試驗(ELISA)、反轉錄聚合酶鏈式反應(RT-PCR)等,但這些檢測方法對儀器和專業人員的依賴性較高,檢測成本昂貴,且耗時相對較長,極大的限制了它們在基層單位的應用,由于我國面積遼闊,農村散養犬較多,在開展RV的監測及免疫效果評估時,急需建立一種快速、敏感、穩定,可以現場使用的檢測方法。
近年來自體紅細胞凝集試驗發展迅速[5],已在多個檢測領域得到應用[6-7]。該方法的基本原理是:以紅細胞作為指示細胞,利用基因工程方法構建一種重組雙功能融合蛋白(目標抗原或抗體與紅細胞非凝集型抗體[8]聯結而形成的抗原-抗體或抗體-抗體結合物),該融合蛋白既能與紅細胞結合又能與被檢抗體/抗原結合,通過樣品中被檢抗體/抗原的橋聯作用,使指示紅細胞發生凝集,根據指示紅細胞的凝集現象達到快速檢測的目的。
本實驗室利用該技術成功建立了檢測豬瘟、豬偽狂犬病毒的紅細胞凝集試驗[9-10]。因此本試驗擬在此基礎上利用(SOE)PCR技術,將狂犬病毒G基因主要抗原表位區kg與抗人紅細胞H抗原單鏈抗體2E8scFv[11]拼接成雙功能融合基因,進行表達復性并對表達蛋白進行檢驗,構建既能與人紅細胞結合,又能與RV抗體反應的雙功能融合蛋白。目的是為了進一步建立狂犬病毒抗體快速檢測紅細胞凝集試驗方法。
1 材料與方法
1.1 重組質粒、載體、菌株和血清 重組質粒pMD-G(含有狂犬病毒G基因主要抗原表位區)、鼠抗RV高免血清由軍事醫學科學院軍事獸醫研究所扈榮良研究員惠贈;重組質粒pMD-2E8scFv(含有抗人紅細胞H抗原單鏈抗體基因)[11]由軍事醫學科學院野戰輸血研究所章金剛研究員惠贈;原核表達載體pET-TrX、表達菌株BL21(DE3)pLysS均由本實驗室保存;7份RV陽性血清、7份RV陰性血清、犬細小病毒(CPV)陽性血清、犬瘟熱病毒(CDV)陽性血清均由本實驗室保存。
1.2 主要試劑 Kod-plus高保真酶為TOYOBO(日本)產品;T4DNA連接酶、限制性內切酶BamHI、EcoRI、及TaqDNA 聚合酶均購自 TaKaRa(日本)公司;IPTG購自Promega公司產品;BCA蛋白定量試劑盒購自TIANGEN公司;辣根過氧化物酶(HRP)標記羊抗鼠IgG為Beyotime產品;Ni-NTA蛋白純化樹脂為QIAGEN公司產品;氧化型谷胱甘肽和還原型谷胱甘肽均為Sigma公司產品;其它化學試劑均為南寧(中國)生化藥品儀器公司分析純產品。
1.3 重組PCR引物設計 根據重疊延伸PCR的原理和狂犬病毒G基因與2E8scFv基因序列,設計4條重組PCR引物 (表1)。其中引物2E8scFv-U/2E8scFv-D用于擴增合成2E8scFv基因,引物Kg-U/Kg-D用于擴增合成Kg基因。2E8scFv3′末端15個堿基和Kg5′端15個堿基為互補序列(陰影部分)用于基因的拼接,拼接順序為2E8-Kg。2E8scFv-U 和 Kg-D中的下劃線部分為引入的BamH I、EcoR I酶切位點。

表1 2E8scFv、Kg基因引物序列Tab.1 Primers of 2E8scFv and Kg
1.4 2E8Kg融合基因原核表達載體的構建及鑒定 以2E8scFV-U/2E8scFV-D和 Kg-U/Kg-D為引物,從pMD-2E8scFv和pMD-G重組質粒中分別擴增融合基因2E8Kg的5′端片段2E8scFv和3′端片段Kg基因。PCR擴增條件均為:95℃預變性5 min;95℃變性1min,60℃退火30s,72℃延伸70 s,30個循環;72℃延伸10min。以純化后的2E8scFv和Kg基因為模板,采用(SOE)PCR方法拼接成2E8Kg融合基因。第一輪PCR反應體系為:2E8scFv和 Kg基因各0.5μL、10× Buffer2.5 μL、5U/μL KOD-plus高保真酶0.5μL,10mmol/L dNTPs 2.5μL、用滅菌雙蒸水加至總體積25μL。PCR反應條件為:95℃預變性5min;95℃變性1 min,60℃退火1min,72℃延伸2min,7個循環。當第一步反應結束后,在反應體系中加入引物2E8scFv-U和 Kg-D各0.5μL,然后95℃預變性5 min;95℃變性1min,60℃退火1min,72℃延伸2min,30個循環;最后72℃延伸10min。將上述PCR產物純化回收后與pMD18-T Simple載體連接,轉化DH5α感受態細胞,提取質粒,經PCR及BamH I、EcoR I雙酶切鑒定后送測序公司測序。測序正確后將融合基因2E8kg亞克隆到原核表達載體pET-Trx中,構建了原核表達質粒pETTrx-2E8kg。
1.5 2E8Kg融合基因的誘導表達及SDS-PAGE分析 將鑒定正確的pET-Trx-2E8Kg原核表達質粒轉化入BL21(DE3)pLysS中進行誘導表達,表達后經SDS-PAGE電泳驗證其是否表達,用Band-Scan軟件測定目的蛋白相對含量。離心收集誘導表達菌液,用細菌洗滌液初步洗滌后,加入細裂解液作用30min后用細胞破碎儀菌破碎處理3遍,分別收集沉淀和上清,沉淀用包涵體洗滌液洗滌兩遍后,用包涵體溶解液溶解,將上述溶解液和上清樣品進行SDS-PAGE電泳,進行可溶性分析。
1.6 2E8Kg融合蛋白的純化與復性 將誘導菌液擴大培養,按上述方法制備包涵體后,采用親和層析法和谷胱甘肽再氧化法對融合蛋白進行純化和復性,復性24h后,用透析液透析48h,每6h換液一次,透析袋內的液體即為純化和復性后的蛋白。用PEG20000濃縮復性蛋白,并用BCA蛋白定量試劑盒測定其濃度。
1.7 2E8kg融合蛋白的 Western-blot檢測 將純化后的2E8kg融合蛋白經SDS-PAGE電泳后,轉移至硝酸纖維素膜(NC)上,將膜用封閉液(5%的脫脂奶粉)4℃封閉過夜,用TBST洗滌,一抗加入鼠抗RV高免血清,二抗為辣根過氧化物酶(HRP)標記羊抗鼠IgG,最后用二氨基聯苯胺(DAB)底物顯色液顯色,邊搖動邊觀察,至條帶清晰后加入雙蒸水終止其反應,觀察結果。
1.8 紅細胞凝集試驗檢測2E8kg融合蛋白的雙功能生物學活性 取7份RV陽性血清,同時設7份RV陰性血清作對照,取96孔血凝板,每孔中加入50μL,然后再向每個孔中依次加入10μL雙功能融合蛋白(1.2mg/mL)和20μL 2%O型人紅細胞,混勻后靜置30min觀察結果;分別取A、B、AB型人紅細胞,按同樣的方法操作,觀察結果。
2 結 果
2.1 2E8Kg融合基因原核表達載體的構建 以重組質粒pMD-2E8scFv和pMD-G為模板,分別擴增出兩條大小分別為732bp和999bp的目的片段,命名為2E8scFv和Kg(如圖1),與預期擴增片段一致。以瓊脂糖凝膠回收試劑盒回收目的片段2E8scFv和Kg為模板,通過(SOE)PCR拼接成2E8Kg融合基因,將其克隆到pMD18-T Simple載體上,鑒定正確后插入原核表達載體pET-Trx,通過PCR(如圖2)及BamH I、EcoR I雙酶切鑒定后測序,測序結果表明該片段與融合基因2E8Kg一致,大小為1 731bp且讀碼框正確。表明融合基因和原核表達載體構建成功。
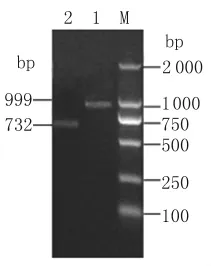
圖1 目的基因2E8scFv和Kg的PCR擴增圖M:DNA2000標準分子量;1:Kg基因;2:2E8scFv基因Fig.1 PCR amplification of 2E8scFv and Kg genesM:DNA Marker 2000;1:Kg gene;2:2E8scFv gene
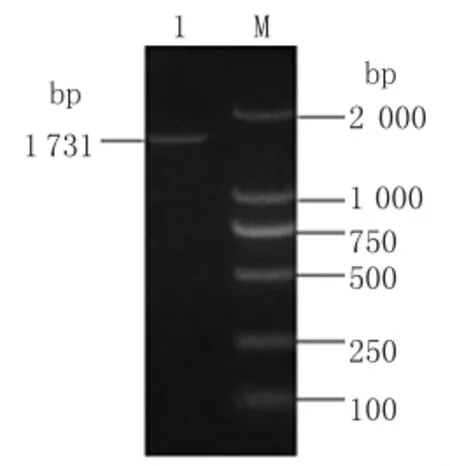
圖2 融合基因2E8Kg的SOE-PCR擴增圖M.DNA2000標準分子量;1.2E8Kg融合基因Fig.2 Amplification of 2E8Kg fusion gene by SOE-PCRM:DNA Marker 2000;1:2E8Kg fusion gene
2.2 2E8Kg融合蛋白的表達、可溶性分析、復性及純化 取pET-Trx-2E8Kg陽性轉化菌進行IPTG誘導表達,同時設pET-Trx空載體轉化菌為對照,結果在37℃,IPTG 濃度為0.7mmol/L,誘導3h時獲得最大表達,表達量占菌體蛋白總量23.5%左右。SDS-PAGE分析表明,表達產物主要以不溶的包涵體形式存在,相對分子質量約77.7kD(如圖3),與預期蛋白分子大小一致。利用親和層析法對變性溶解的目的蛋白進行純化并用BandScan生物學軟件進行分析,結果表明目的蛋白洗脫后的純度提高到了98.9%(圖略)。BCA蛋白定量試劑盒測定復性濃縮后蛋白含量約為1.7mg/mL。

圖3 pET-Trx-2E8Kg重組菌表達產物的SDS-PAGE電泳的結果M.低分子量蛋白marker;1.空載體對照;2.誘導后重組菌蛋白Fig.3 Identification on expressed product of pET-Trx-2E8Kg recombinant bacteria by SDS-PAGEM:Protein MW marker;1:Negative control;2:Recombinant bacteria protein after induction
2.3 2E8Kg融合蛋白 Western-blot檢測 用RV高免血清對2E8Kg融合蛋白進行 Western-blot檢測,結果發現約在77.7kDa處出現一條特異性條帶,而同時用CPV和CDV陽性血清對2E8Kg融合蛋白進行Western-blot檢測,結果無任何免疫印跡條帶出現(圖4),說明2E8kg融合蛋白能夠與RV高免血清發生特異反應,具有良好的免疫反應原性。
2.4 紅細胞凝集試驗檢測2E8Kg融合蛋白的生物學活性 用純化和復性后的2E8Kg融合蛋白、2%人“O”型紅細胞、7份RV陰、陽性血清進行紅細胞凝集試驗,結果7份RV陽性血清均可觀察到強凝集現象(圖5),而7份RV陰性血清未觀察到凝集現象(圖6)。用血型定型試劑盒篩選出A、B和AB型人紅細胞與RV陽性血清進行同樣的試驗,結果也觀察到強凝集現象(圖7)。用CPV,CDV陽性血清分別與2E8Kg融合蛋白作用,結果未發生凝集(圖8)。上述結果說明2E8Kg融合蛋白不但能夠與RV高免血清發生特異反應,而且能與人紅細胞結合(無血型限制),具有雙功能特性。
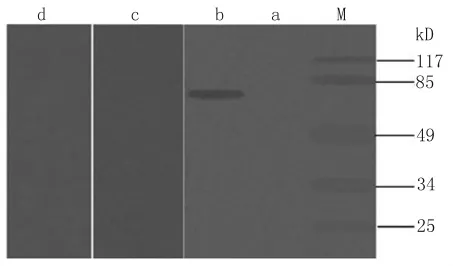
圖4 pET-Trx-2E8Kg重組菌表達產物的 Western-blot鑒定M.低分子量蛋白 marker;a.空載體對照;b.誘導后pET-Trx-2E8Kg重組菌蛋白;c.CPV陽性血清陰性對照;d.CDV陽性血清陰性對照。Fig.4 Identification on expressed product of pET-Trx-2E8Kg recombinant bacteria by Western-blotM:Protein MW marker;a:Negative control;b:Recombinant bacteria pET-Trx-2E8Kg protein after induction;c:Negative control of CPV positive serum;d:Negative control of CDV positive serum

圖5 狂犬病毒陽性血清與2E8Kg雙功能融合蛋白及人O型紅細胞的紅細胞凝集試驗Fig.5 Erythrocyte agglutination test of 2E8Kg fusion pro-tein,RV positive serum,and O type human red blood cells;

圖6 狂犬病毒陰性血清與2E8Kg雙功能融合蛋白及人O型紅細胞的紅細胞凝集試驗Fig.6 Erythrocyte agglutination test of 2E8Kg fusion pro-tein,RV negative serum,and O type human red blood cells;
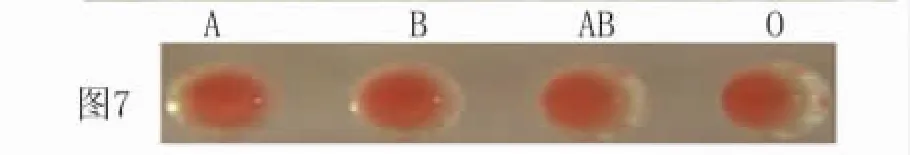
圖7 狂犬病毒陽性血清與2E8Kg雙功能融合蛋白及人紅細胞的紅細胞凝集試驗Fig.7 Erythrocyte agglutination test of 2E8Kg fusion pro-tein,RV positive serum,and human red blood cells;

圖8 犬不同病毒陽性血清與2E8Kg雙功能融合蛋白及人O型紅細胞的紅細胞凝集試驗Fig.8 Erythrocyte agglutination test of 2E8Kg fusion pro-tein,different virus-positive serum of dog,and O type human red blood cells.
3 討 論
狂犬病是人畜共患的自然疫源性傳染病,目前尚無有效的治療方法,疫苗免疫預防狂犬病的發生尤其重要[12]。我國狂犬病發病死亡人數位居重點傳染病死亡數和病死率榜首,易感動物發病呈逐年上升的趨勢,要徹底根除狂犬病,首先就必須消滅動物的狂犬病,特別是隱性帶毒動物及野生動物的狂犬病。針對狂犬病的現狀,如何利用有效的診斷方法對隱性帶毒動物快速診斷,對狂犬病疫苗免疫后的動物進行抗體監測及免疫效果評估,是保證人和動物安全的當務之急。
目前,狂犬病現有的診斷方法對儀器和專業人員的要求較高,檢測成本昂貴,且耗時相對較長,因而極大的限制了它們在基層單位的使用。從而導致動物狂犬病免疫效果評估的工作開展較為困難,這對控制和消滅動物狂犬病十分不利。自體紅細胞凝集試驗以其快速、簡便、不需要任何儀器,僅憑肉眼就可以觀察結果的特點在人類疾病快速診斷中得到了較好的應用。由于犬紅細胞表面抗原十分復雜,要尋找到各類血型的共有抗原十分困難,為此,本研究借助表面抗原背景清楚的人紅細胞作為指示劑建立檢測動物病原抗體的紅細胞凝集實驗方法。
由于本實驗拼接的融合基因長度較長,在初步PCR擴增和拼接的過程中,發生了基因突變,1 237位堿基由A突變為T,形成了一個終止密碼子TGA,無法正確表達此融合蛋白。為此改用Kodplus高保真酶對其進行擴增,擴增結果測序沒有發生堿基的突變。構建原核表達體系一般需要綜合考慮3大因素:表達載體、宿主菌株、表達誘導條件。本試驗在融合蛋白表達的過程中嘗試了多種可溶性原核表達載體,都沒有得到相應的可溶性表達或表達量太低。在經過表達誘導條件的篩選、優化后,最后選取原核表達載體pET-Trx,在37℃,IPTG濃度為0.7mmol/L,誘導3h時獲得較高的表達。由于表達產物以不溶的包涵體形式存在,該融合蛋白需要經過復雜的包涵體溶解、變性、復性過程,這極大的影響了融合蛋白的生物學活性,導致在目前建立的紅細胞凝集試驗過程中出現凝集的時間較長,與人血型檢測的速度相比仍有一定的差距,估計與2E8kKg雙功能融合蛋白生物學活性不高有關。為此本試驗擬從以下3個方面進行研究,一是篩選不同的宿主菌株;二是在2E8scFv與RV-Kg基因兩個功能區之間引入一個連接肽,以克服因直接拼接,造成兩個功能區相互遮掩而導致活性下降的可能。三是繼續尋找新的可溶性表達系統及可溶性表達條件,達到獲得雙功能融合蛋白的可溶性表達,減少因包涵體變性、復性造成活性降低的目的。
[1]Balsamo GA,Ratard R,Claudet A.The epidemiology of animal bite,scratch,and other potential rabies exposures,Louisiana[J].J La State Med Soc,2009,161(5):260-265.
[2]Gaudin Y,Ruigrok RWH,Tuffereau C,et al.Rabies virus glycoprotein is a trimer[J].Virology,1992,187 (2):627-632.DOI:10.1016/0042-6822(92)90465-2
[3]Benmansour A,Leblois H,Coulon P,et al.Antigenicity of rabies virus glycoprotein[J].J Virol,1991,65(8):4198-4203.
[4]Yin Z,Liu JH.Animal Virology[M].2ndedition.Beijing:Science Press,1997:780-781.(in Chinese)殷震,劉景華.動物病毒學[M].2版.北京:科學出版社.1997:780-781.
[5]Hu Y,Yang JY,Zhu L,et al.Expression,purification and characterization of an anti-human RBC scFv-HIV gpl60fusion protein for hemagglutination-based rapid detection of antibodies to HIV in whole blood[J].Chin J Exp Clin Virol,2007,21(1):76-78.(in Chinese)胡燕,楊健洋,朱雷,等.抗人紅細胞抗體和HIV抗原融合蛋白的構建及活性鑒定[J].中華實驗和臨床病毒學雜志,2007,21(1):76-78.
[6]Gupta A,Chaudhary VK.Whole-blood agglutination assay for on-site detection of human immunodeficiency virus infection[J].J Clin Microbiol,2003,41(7):2814-2817.DOI:10.1128/JCM.41.7.2814-2821.2003
[7]Siedenr M,Zapirz V,Ishida M,et al.Performance of rapid syphilis tests in venous and fingerstick whole blood specimens[J].Sex Transm Dis,2004,31(9):557-560.DOI:10.1097/01.olq.0000137903.48413.5e
[8]Li H,Pan JC,Liu Z,et al.Preparation and characterization of non-agglutinating mAbs against membrane antigen on human erythrocytes[J].J Cell Mol Immunol,2005,21(4):473-475.(in Chinese)李卉,潘紀春,劉子,等.抗人紅細胞膜抗原非凝集型單克隆抗體的研制及特性鑒定[J].細胞與分子免疫學雜志,2005,21(4):473-475.
[9]Liao WJ,Qin SM,Wu JM,et al.Construction and biological activity detection of an anti-human red blood cell single chain fragment variable-pseudorabies virus gE bifunctional fusion protein[J].J Agr Biotechnol,2010,18(3):562-566.(in Chinese)DOI:10.3969/j.issn.1674-7968.2010.03.023廖文軍,覃紹敏,吳健敏,等.抗人紅細胞單鏈抗體(scFv)-偽狂犬病毒(PRV)-gE蛋白雙功能融合蛋白的構建及生物學活性檢測[J].農業生物技術學報,2010,18(3):562-566.DOI:10.3969/j.issn.1674-7968.2010.03.023
[10]Qin SM,Bai AB,Wu JM,et al.Preparation and bioactivity of anti-human red blood cell scFv and CSFV E2bifunctional fusion protein[J].Chin J Biotech,2010,26(1):28-34.(in Chinese)覃紹敏,白安斌,吳健敏,等.抗人紅細胞單鏈抗體與豬瘟E2蛋白雙功能融合蛋白的構建及生物學活性檢測[J].生物工程學報,2010,26(1):28-34.
[11]Shao CL,Shi LJ,Yao ZX,et al.Cloning and expression of the variable region genes of the monoclonal antibody against H antigen on human erythrocyte[J].J Immunol,2008,24(2):238-242.(in Chinese)邵長利,史利軍,姚站馨,等.抗人紅細胞H抗原單鏈抗體基因克隆和表達[J].免疫學雜志,2008,24(2):238-242.
[12]Li ZS,Liu AL,Tan RR,et al.Research development of rabies[J].China Anim Husbandry Vet Med,2010,37(7):189-191.(in Chinese)李澤盛,劉愛林,譚榮榮,等.狂犬病研究進展[J].中國畜牧獸醫.2010,37(7):189-191.

