廣州管圓線蟲感染小鼠脾臟T淋巴細胞亞群和細胞因子的變化*
羅曉東,沈二霞,陳代雄,丁 雪,李 華
廣州管圓線蟲作為一種新發傳染病的病原,主要侵犯中樞神經系統,引起嗜酸性粒細胞增多性腦膜腦炎或腦膜炎。近年來在我國浙江、遼寧、福建、云南和北京等地先后出現廣州管圓線蟲病的暴發流行[1-2],其重要性已越來越引起醫學界的重視。而宿主感染后產生的針對廣州管圓線蟲的免疫應答的研究,對于我們了解宿主抗損害作用的特點、蟲體的致病機制和免疫學診斷等有重要意義。脾臟是哺乳動物最大的外周免疫器官和血源性抗原最主要的免疫應答場所,也是包括淋巴細胞在內許多免疫細胞定居區域。而感染后脾臟淋巴細胞學的改變能較好地反映宿主對寄生蟲免疫應答的特點。因此,本研究以小鼠為動物模型,采用流式細胞術和酶聯免疫吸附試驗(ELISA)等方法對其感染廣州管圓線蟲后脾臟T淋巴細胞亞群及其細胞因子分泌水平的變化進行了觀察。
1 材 料
1.1 實驗動物 雌性4~6周齡的BALB/c小鼠,SPF級,購自廣東省醫學實驗動物中心。
1.2 主要試劑和儀器 RPMI1640培養基、Hank’s液購自英維捷基公司;胎牛血清購自杭州四季清公司;Saponin、離子霉素及Brefeldin A(BFA)均購自Sigma公司;PerCP抗小鼠CD4單克隆抗體、FITC抗小鼠CD8a單克隆抗體、APC抗小鼠IL-4、APC抗小鼠IFN-γ、PE抗小鼠IL-17均購自BD公司;PMA 購自杭州聯科公司;IL-4(DY404)、IL-17(DY421)ELISA檢測試劑盒購自R&D公司。流式檢測采用BD公司Calibur流式細胞儀。ELx800型酶標儀由BioTek儀器公司生產。1267P型CO2培養箱由上海易亮醫療器械有限公司生產。
2 方 法
2.1 感染動物模型的建立 褐云瑪瑙螺由本實驗室飼養和人工感染。從感染褐云瑪瑙螺中分離廣州管圓線蟲第3期幼蟲,主要參照陳代雄等[3]報道的方法進行。將小鼠隨機分成3組,包括:對照組、實驗1組、實驗2組每組各10只鼠。其中對照組為正常小鼠,實驗1組和實驗2組分別感染廣州管圓線蟲第3期幼蟲20條/鼠和40條/鼠,感染采用腹腔注射法。
2.2 小鼠一般情況 感染后觀察各組小鼠活動、飲食及毛色等變化。
2.3 脾臟淋巴細胞分離 分別于感染后的第19d和第25d前后,斷頸處死小鼠,75%酒精消毒小鼠腹部,在無菌條件下取出脾臟;脾臟淋巴細胞的收集使用Anukumar B等[4]報告的方法,將收集的脾淋巴細胞用4mL RPMI1640培養液重懸,0.4%臺盼藍染色,鏡下計數。
2.4 脾臟淋巴細胞流式檢測 參照Anukumar B[4]、楊濱燕等[5]的方法,將收集的脾淋巴細胞懸液細胞數調整為2×106/mL,加入PMA 10ng/mL及離子霉素(Ionomycin)1μg/mL,于37℃的二氧化碳培養箱培養1h;加入BFA 1μL后繼續培養4h,培養細胞經PBS洗滌后加4%甲醛固定,加含通透劑Saponin的緩沖液重懸細胞,4℃過夜。將細胞分裝入流式管中,每管含細胞數約1×106/mL,加入相應的熒光抗體各1μL。流式細胞儀檢測小鼠脾臟T淋巴細胞,按儀器使用規程進行操作。
2.5 細胞因子ELISA檢測 將分離的脾淋巴細胞懸液細胞數調整為2×106/mL,加入PMA 10ng/mL及Ionomycin 1μg/mL后,分別加入細胞培養板中,每份細胞懸液同時做3孔培養,每孔200μL;于37℃、5%二氧化碳培養箱培養72h后取出并保存于-80℃。脾淋巴細胞培養上清中細胞因子IL-4和IL-17的雙抗夾心ELISA檢測,方法按照試劑盒說明書進行。每樣本同時進行3孔平行檢測,檢測值取3孔平均值;ELISA檢測OD值按照試劑盒標準品的標準曲線換算成濃度。
2.6 統計學方法 實驗數據以均數±標準差表示。實驗組和對照組的顯著性檢驗采用SPSS 19.0統計軟件分析處理,采用的統計學方法包括方差分析、t檢驗及秩和檢驗。
3 結 果
3.1 小鼠一般情況 對照組小鼠一般狀況良好,攝食活動正常。實驗組于感染第16d后,陸續出現打轉、癱瘓等中樞神經受損的表現。
3.2 脾臟T淋巴細胞流式檢測結果
3.2.1 CD4+T細胞 檢測結果見圖1。對照組、實驗1組和實驗2組檢測值分別為(15.79±5.57)%、(21.32±7.31)%和(25.25±10.74)%,3組間脾CD4+T細胞均值存在統計學上的顯著差異(F=3.446,P<0.05);其中,對照組與實驗2組間存在顯著性差異(t=2.474,P<0.05),而對照組與實驗1組、兩實驗組之間均無顯著性差異(t=1.906,P>0.05;t=1.013,P>0.05)。
3.2.2 CD8+T細胞 檢測結果見圖2。對照組、實驗1組和實驗2組檢測值分別為(2.51±0.60)%、(3.25±1.31)%和(3.76±1.58)%。與對照組比較,感染后小鼠脾臟CD8+T細胞水平呈上升趨勢,但3組間差異無統計學意義(F=2.582,P>0.05)。
3.2.3 CD4+IL-4+T細胞 如圖3所示,對照組、實驗1組和實驗2組檢測值分別為(0.64±0.25)%、(1.94±2.31)%、(2.49±2.38)%。經統計學分析,3組間存在顯著性差異(χ2=7.770,P<0.05);其中,對照組與兩實驗組間均存在顯著性差異(Z=2.342,P<0.05;Z=2.440,P<0.05);兩實驗組間無統計學差異(Z=0.832,P>0.05)。
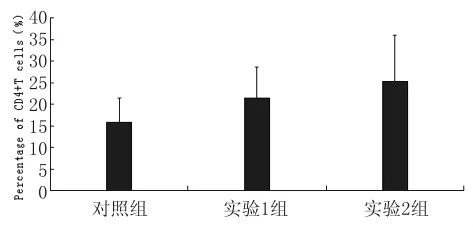
圖1 脾臟CD4+T細胞百分率Fig.1 Percentage of CD4+ T cells in spleen
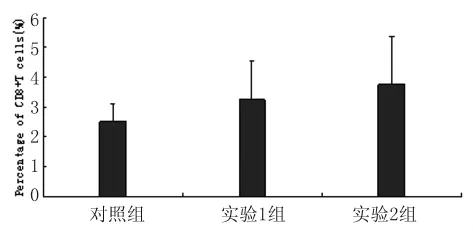
圖2 脾臟CD8+T細胞百分率Fig.2 Percentage of CD8+ T cells in spleen
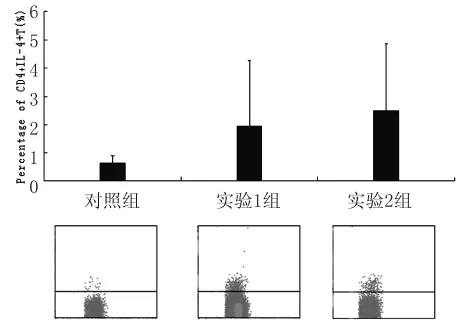
圖3 脾臟CD4+IL-4+T細胞百分率Fig.3 Percentage of CD4+IL-4+T cells in spleen
3.2.4 CD4+IL-17+T細胞 如圖4所示,對照組、實驗1組和實驗2組的檢測值分別為(1.18±0.26)%、(0.63±0.16)%和(0.65±0.29)%,3組間差異有統計學意義(F=12.620,P<0.05)。其中,對照組與實驗1組、實驗2組間均存在顯著差異(t=5.416,P<0.05;t=3.783,P<0.05),而兩實驗組間差異不顯著(t=0.223,P>0.05)。
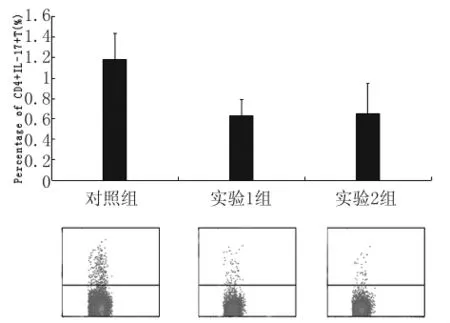
圖4 脾臟CD4+IL-17+T細胞百分率Fig.4 Percentage of CD4+IL-17+T cells in spleen
3.2.5 CD4+IFN-γ+T 細胞 如圖5所示,對照組、實驗1和實驗2組檢測值分別為(12.47±2.49)%、(5.80±2.39)%和(5.66±3.08)%。這3個組之間存在統計學上的顯著差異(F=15.695,P<0.05),其中,對照組與實驗1組、實驗2組間均存在顯著性差異(t=5.386,P<0.05;t=4.716,P<0.05),而兩實驗組間差異不顯著(t=0.114,P>0.05)。
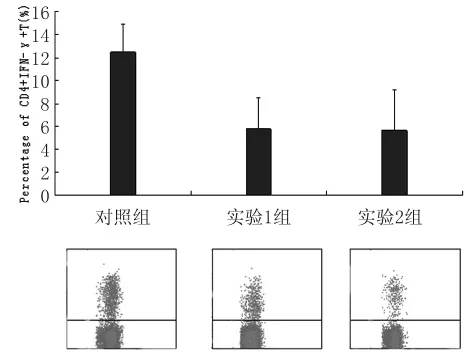
圖5 脾臟CD4+IFN-γ+T細胞百分率Fig.5 Percentage of CD4+IFN-γ+T cells in spleen
3.3 脾臟淋巴細胞培養上清中細胞因子的檢測
3.3.1 IL-4含量檢測 結果見圖6,對照組、實驗1組和實驗2組檢測值分別為(215.20±158.13)pg/mL、(453.43±246.07)pg/mL、(469.42±221.37)pg/mL。經統計學分析,3組間有顯著性差異(χ2=7.531,P<0.05);其中,對照組與實驗1組或實驗2組間均存在顯著差異(Z=2.146,P<0.05;Z=2.148,P<0.05),而兩實驗組間無顯著差異(t=0.153,P>0.05)。
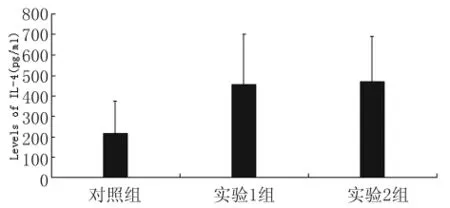
圖6 IL-4含量檢測Fig.6 Levels of IL-4in spleen cell supernatants
3.3.2 IL-17含量檢測 結果見圖7。對照組、實驗1組和實驗2組檢測值分別為(378.47±263.14)pg/mL、(97.85±95.41)pg/mL、(67.36±63.17)pg/mL。經統計學分析,3組間有顯著性差異(χ2=12.746,P<0.05);其中,對照組與實驗1組或實驗2組間均存在顯著差異(Z=3.027,P<0.05;Z=3.222,P<0.05);而兩實驗組間無顯著差異(Z=0.529,P>0.05)。
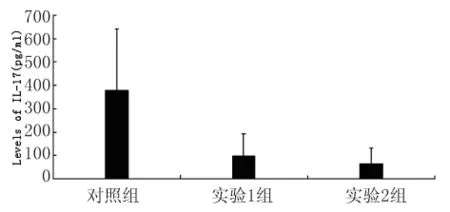
圖7 IL-17含量檢測Fig.7 Levels of IL-17in spleen cell supernatants
3.4 感染后不同時間免疫學檢測結果比較
3.4.1 流式檢測結果 見表1。實驗1組小鼠CD4+T細胞值感染后第25d稍高于第19d,而實驗2組則是第19d高于第25d;但經統計學分析,均無顯著性差異(P>0.05)。此外,脾CD4+T細胞中的IL-4+、IL-17+、IFN-γ+細胞,實驗1組和實驗2組均為感染后第25d高于第19d,但均無統計學意義的顯著差異(P>0.05)。
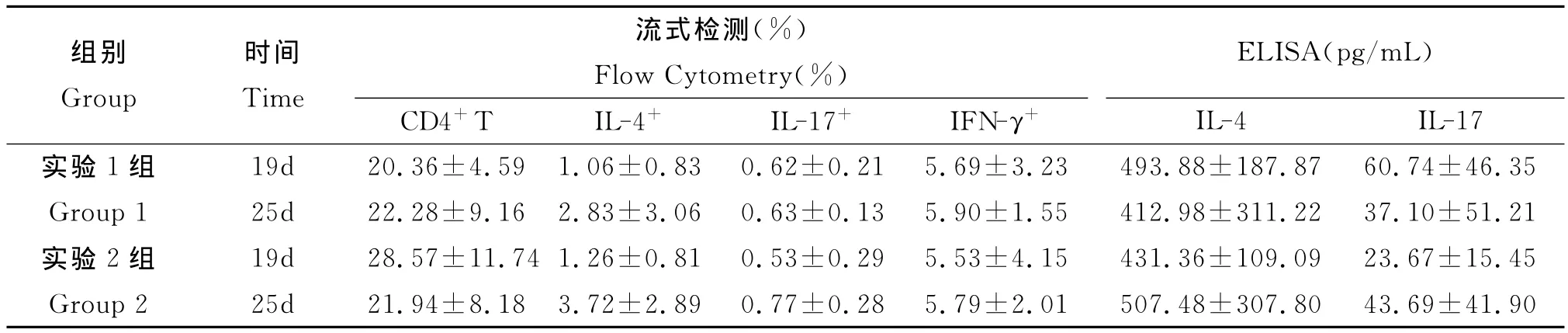
表1 感染后不同時間流式與ELISA檢測結果Tab.1 Results of Flow Cytometry and ELISA for different time points after infection
3.4.2 ELISA檢測結果 見表1。實驗1組和實驗2組小鼠感染后不同時間脾淋巴細胞培養上清中的細胞因子IL-4水平均無統計學意義的顯著差異(t=0.498,P>0.05;Z=0.104,P>0.05)。而兩實驗組IL-17水平,在感染第19d和第25d間亦無統計學意義的顯著差異(t=0.765,P>0.05;t=1.002,P>0.05)。
4 討 論
已有的研究[6-7]顯示,廣州管圓線蟲感染后宿主的免疫應答對于自身保護和蟲體的致病作用非常重要。T淋巴細胞包括CD4+的輔助性T細胞和CD8+的細胞毒性T細胞等亞群。CD4+T細胞主要生物學功能是激發和調節宿主的免疫應答;CD8+T細胞主要作用是對靶細胞進行特異性殺傷。流式細胞檢測結果顯示,實驗組CD4+T淋巴細胞檢測值與對照組比較顯著升高,而CD8+T淋巴細胞水平實驗組雖高于對照組,但變化不顯著,提示在廣州管圓線蟲感染后早中期的免疫應答中,CD4+T淋巴細胞可能起主要作用。這與Lee JD等[8]報告的結果基本一致。
輔助性T細胞(Th細胞)又可分為Th1細胞和Th2細胞,兩者在免疫應答過程中分泌不同的細胞因子;這些細胞因子有不同的功能,且相互拮抗,因此,占主導地位的Th細胞類型及其產生的細胞因子將決定感染的發展與轉歸[9-12]。IL-4主要是由Th2細胞產生的一種細胞因子,其生物學作用為促進B細胞增殖和分泌抗體以及誘導抗體的類別轉換;IL-4還以自分泌方式促進Th2細胞的增殖與功能。流式檢測結果顯示:實驗組CD4+IL-4+T細胞含量明顯高于對照組。同時脾淋巴細胞培養上清中的IL-4含量檢測結果,實驗組也明顯高于對照組,兩者結果一致。也與Sugaya H等[6]報告的結果基本相符。
IL-17是最近幾年受到關注的一類細胞因子,關于其在廣州管圓線蟲感染中的變化暫未見文獻報告。該因子主要由CD4+T細胞中的Th17細胞[13]產生,它通過誘導IL-6、TNF-α,以及趨化因子(如MCP-1、MIP-2)的表達參與炎癥反應及血管的生成[14]。在流式檢測結果中,CD4+IL-17+T 細胞實驗組明顯低于對照組,而在淋巴細胞培養上清中的IL-17的含量亦是實驗組明顯低于對照組。這可能與宿主感染廣州管圓線蟲后高表達的IL-4對于Th17細胞分化的抑制作用,從而抑制IL-17的分泌[13]有關。
IFN-γ主要由活化的Th1細胞和NK細胞產生。在寄生蟲感染中,其主要對胞內寄生原蟲感染發揮作用[15-17]。流式檢測結果顯示,小鼠脾臟CD4+IFN-γ+淋巴細胞亞群檢測值實驗組明顯低于對照組。這可能是由于小鼠感染廣州管圓線蟲后,CD4+IL-4+T細胞及IL-4的顯著升高對其產生的負調節作用。因為有研究[10]表明,IL-4能通過抑制STAT1的表達,從而抑制Th1細胞的分化和增殖。
實驗結果顯示,感染后上調性免疫因子包括CD4+T、CD8+T、IL-4+T淋巴細胞和細胞因子IL-4水平均隨著感染程度的增加而上升,而下調性免疫因子包括IFN-γ+細胞和細胞因子IL-17檢測值則隨著感染程度的增加而下降,但差異均無統計學上的顯著性;提示感染程度對T細胞亞群變化及其細胞因子的產生有一定的影響,但影響程度有限。
為了解感染后不同時間脾CD4+T淋巴細胞亞群和細胞因子產生的變化,我們對實驗組感染后第19d和第25d兩個時間點的檢測結果進行了比較,發現在流式檢測中,CD4+T淋巴細胞中的IL-4+、IL-17+、IFN-γ+亞群,感染后隨時間延長兩實驗組均表現為水平升高。在另一方面,細胞因子IL-4和IL-17的ELISA檢測結果,實驗1組為第19d高于第25d,實驗2組則為第19d低于第25d,是否是由于感染程度的差異導致的細胞因子產生的變化,值得進一步探討。總之,本實驗感染后第19d和第25d兩個時間點小鼠的檢測結果均無統計學上的顯著差異(P>0.05);因此,感染后不同時間脾CD4+T淋巴細胞亞群和細胞因子的變化特點,還有待擴大樣本做進一步的研究。
綜上所述,小鼠感染廣州管圓線蟲后,表現以脾臟CD4+T淋巴細胞大量增殖和Th2型細胞極化為特點。一般認為,抗體依賴的、嗜酸性粒細胞作為主要效應細胞的ADCC作用是人體主要的殺傷蠕蟲機制[18]。而嗜酸性粒細胞升高是廣州管圓線蟲感染的主要特征,結合本實驗觀察到的感染后Th2極化現象(Th2細胞的主要功能之一是促進抗體生成和介導體液免疫),我們推測上述ADCC效應也應該是小鼠抗廣州管圓線蟲感染的主要免疫應答機制。本研究結果使我們對于廣州管圓線蟲感染后宿主免疫應答的特性有了進一步的了解。
[1]Wang QP,Lai DH,Zhu XQ,et al.Human angiostrongyliasis[J].Lancet Infect Dis,2008,8(10):621-630.DOI:10.1016/S1473-3099(08)70229-9
[2]Qu ZY,Zhan XM,He A.The analysis on epidemic situation of angiostrongyliasis in China[J].Int J Med Parasit Dis,2007,34(5):279-282.(in Chinese)曲振宇,詹希美,何藹.廣州管圓線蟲病在我國的流行分析[J].國際醫學寄生蟲病雜志,2007,34(5):279-282.
[3]Chen DX,Zhang Y,Shen HX,et al.Epidemiological survey ofAngiostrongylus cantonensisin the west-central region of Guangdong Province,China[J].Parasitol Res,2011,109(2):305-314.DOI:10.1007/s00436-011-2255-1
[4]Anukumar B,Shahir P.Immune regulation in Chandipura virus infection:characterization of CD4+T regulatory cells from infected mice[J].Virol J,2011,8:259.DOI:10.1186/1743-422X-8-259
[5]Yang BY,Shen EX,Wu CY.Phenotype of mouse CD4+CD25+regulatory T cells in mouse splenocytes[J].Curr Immunol,2006,26(3):208-212.(in Chinese)楊濱燕,沈二霞,吳長有.小鼠脾細胞CD4+CD25+調節性T細胞的表型特征[J].現代免疫學雜志,2006,26(3):208-212.
[6]Sugaya H,Aoki M,Abe T,et al.Cytokine responses in mice infected withAngiostrongylus cantonensis[J].Parasitol Res,1997,83(1):10-15.DOI:10.1007/s004360050199
[7]Perez O,Capron M,Lastre M,et al.Angiostrongylus cantonensis:role of eosinophils in the neurotoxic syndrome(Gordon-like phenomenon)[J].Exp Parasitol,1989,68(4):403-413.DOI:10.1016/0014-4894(89)90125-2
[8]Lee JD,Wang JJ,Chang JH,et al.Role of T cell subpopulations in mice infected withAngiostrongylus cantonensis[J].J Helminthol,1996,70(3):211-214.DOI:10.1017/S0022149X0001542X
[9]Mosmann TR,Cherwinski H,Bond MW,et al.Two types of murine helper T cell clone.I.Definition according to profiles of lymphokine activities and secreted proteins[J].J Immunol,1986,136(7):2348-2357.
[10]Abbas AK,Murphy KM,Sher A.Functional diversity of helper T lymphocytes[J].Nature,1996,383(6603):787-793.DOI:10.1038/383787a0
[11]Chen ZL.Parasite infection and cytokine[J].Foreign Med Sci Parasit Dis,1998,25(5):223-227.(in Chinese)陳志琳.寄生蟲感染與細胞因子[J].國外醫學寄生蟲病分冊,1998,25(5):223-227.
[12]Chen P,Wang WL.Th1/Th2cytokines and helminth infections[J].J Pathog Biol,2009,4(4):318-320.(in Chinese)陳鵬,王文林.Th1/Th2細胞因子與蠕蟲感染[J].中國病原生物學雜志,2009,4(4):318-320.
[13]Harrington LE,Hatton RD,Mangan PR,et al.Interleukin 17-producing CD4+effector T cells develop via a lineage distinct from the T helper type 1and 2lineages[J].Nat Immunol,2005,6(11):1123-1132.DOI:10.1038/ni1254
[14]Kolls JK,Lindén A.Interleukin-17family members and inflammation[J].Immunity,2004,21(4):467-476.DOI:10.1016/j.immuni.2004.08.018
[15]Kushawaha PK,Gupta R,Sundar S,et al.Elongation factor-2,a Th1stimulatory protein ofLeishmania donovani,generates strong IFN-γand IL-12response in cured Leishmania-infected patients/hamsters and protects hamsters againstLeishmaniachallenge[J].J Immunol,2011,187(12):6417-6427.DOI:10.4049/jimmunol.1102081
[16]Langermans AM,Van der Hulst ME,Nibbering PH,et al.IFN-gamma-induced L-arginine-dependent toxoplasmastatic activity in murine peritoneal macrophages is mediated by endogenous tumor necrosis factor-alpha[J].J Immunol,1992,148(2):568-574.
[17]Su Z,Stevenson MM.Central role of endogenous gamma interferon in protective immunity against blood stagePlasmodium chabaudiAS infection[J].Infect Immun,2000,68(8):4399-4406.DOI:10.1128/IAI.68.8.4399-4406.2000
[18]Fabre V,Beiting DP,Bliss SK,et al.Eosinophil deficiency compromises parasite survival in chronic nematode infection[J].J Immunol,2009,182(3):1577-1583.

