預防性應用鹽酸氟桂利嗪對高血糖SD大鼠局部腦缺血再灌注模型ICAM-1表達的影響
高 政,姜麗杰,邢蕓蕓,王旭剛
(1.大連醫科大學附屬第二醫院北院神經內科,遼寧大連116031;2.大連市第三人民醫院神經內科,遼寧 大連116031;3.沈陽市第四人民醫院心內科,遼寧沈陽110031)
預防性應用鹽酸氟桂利嗪對高血糖SD大鼠局部腦缺血再灌注模型ICAM-1表達的影響
高 政1,姜麗杰2,邢蕓蕓3,王旭剛1
(1.大連醫科大學附屬第二醫院北院神經內科,遼寧大連116031;2.大連市第三人民醫院神經內科,遼寧 大連116031;3.沈陽市第四人民醫院心內科,遼寧沈陽110031)
[目的]探討預防性應用鹽酸氟桂利嗪對高血糖條件下SD大鼠局灶性腦缺血再灌注損傷是否有保護作用及其可能機制。[方法]雄性健康SD大鼠36只,建立高血糖模型后隨機分為兩組:高血糖組(n=18)與鹽酸氟桂利嗪+高血糖組(簡稱氟桂利嗪組,n=18),各組按腦缺血90 min再灌注3 h(n=6)、6 h(n=6)、24 h(n=6)分為3個亞組。比較氟桂利嗪組與高血糖組各再灌注時間點腦組織病理形態改變及ICAM-1表達的動態變化。[結果]腦組織病理形態觀察:氟桂利嗪組隨著再灌注時間的延長,腦組織受損程度逐漸加重,但與高血糖組各時間點比較,變性、壞死的神經元較少,組織間水腫較輕。ICAM-1表達:氟桂利嗪組于再灌注3 h可見ICAM-1陽性表達,24 h內逐漸增高(P<0.05)。氟桂利嗪組與高血糖組比較各時間點缺血區ICAM-1表達均減少(P<0.01)。[結論]預防性應用鹽酸氟桂利嗪能減輕高血糖條件下的局灶性腦缺血再灌注損傷。
鹽酸氟桂利嗪;高血糖;腦缺血再灌注;細胞間粘附分子-1
急性腦梗死是臨床上常見的急危癥之一,具有很高的致死致殘率,嚴重危害人類健康,而急性腦梗死患者在發病前常合并糖尿病或在發病急性期常可見血糖升高,許多臨床及動物實驗亦表明高血糖可加重腦缺血再灌注損傷[1-4]。細胞間粘附分子-1 (intercellular adhesion molecule-1,ICAM-1)是中樞神經系統中細胞表達最廣泛的粘附分子,它的含量變化被認為能反映顱腦損傷程度。本研究采用SD大鼠局灶性腦缺血再灌注模型,通過觀察腦組織病理形態改變和ICAM-1表達情況,探討預防性應用鹽酸氟桂利嗪(flunarizine hydrochlorid)對高血糖條件下的腦缺血再灌注損傷是否有保護作用,為預防性用藥提供一定的實驗依據。
1 材料和方法
1.1 實驗動物
健康雄性SD大鼠36只,體重180~220 g,血糖正常(<6 mmol/L),由大連醫科大學動物實驗中心提供,分籠溫室飼養,自由進食飲水,自然晝夜,術前禁食12 h。
1.2 主要藥品、試劑和儀器
兔抗大鼠ICAM-1抗體(福建邁新公司);SP試劑盒、DAB顯色劑(美國SANTAZ公司);氯化三苯四唑啉(TTC)(中國醫藥集團上海化學試劑公司);鹽酸氟桂利嗪(西安楊森公司5 mg/片);DS-88型電子稱(武漢自動化儀表廠);電熱恒溫水溫箱HW1型(北京市醫療設備廠);LEICA-RM-2145石蠟切片機(德國);NIKON數碼相機(日本);OLYMPUS光學顯微鏡(日本);微血糖儀(美國強生公司); HPIAS-1000高清晰度彩色病理圖文分析系統(同濟醫科大學千屏影像工程公司)。
1.3 實驗方法
1.3.1 實驗動物分組:36只健康雄性SD大鼠,按隨機化原理分為兩組:高血糖組(n=18)、鹽酸氟桂利嗪+高血糖組(簡稱氟桂利嗪組,n=18)。各組按腦缺血90 min再灌注3 h(n=6)、6 h(n=6)、24 h(n= 6)分為3個亞組。
1.3.2 給藥方法:鹽酸氟桂利嗪研磨成粉末狀,生理鹽水稀釋溶解成混懸液。給藥組大鼠在手術前3 d灌胃,1次/d,按分組情況分別給鹽酸氟桂利嗪(10 mg/kg)。
1.3.3 大鼠高血糖模型制備:大鼠術前禁食12 h,自由進水。各組在阻斷大腦中動脈(middle cerebral artery,MCA)前30 min腹腔注射50%葡萄糖溶液(3 g/kg)。于注射葡萄糖前及栓線前各取鼠尾血1滴,用血糖儀測定血糖濃度,栓線前血糖值>11.1 mmol/ L表示建模成功。
1.3.4 大鼠大腦中動脈閉塞的缺血再灌注模型制備:參照改良的Longa-Zea氏線栓法[5]制作大鼠大腦中動脈缺血再灌注模型。模型成功的標志是動物蘇醒后出現同側的Horner征(眼裂變小,眼球內陷)和對側以前肢為重的偏癱。
1.3.5 觀察指標:免疫組織化學法測定ICAM-1的表達。判斷標準:每張切片在40×10倍光鏡下隨機選取缺血區內5個不重疊的視野,顯微鏡下觀察并計數陽性細胞,應用HPIAS-1000圖像分析處理系統計數ICAM-1免疫反應陽性細胞數量,取均值作為各時間點陽性表達細胞數。
1.4 統計學方法
所有數據均以x ±s表示,應用SPSS13.0統計軟件進行統計分析。血糖值采用配對t檢驗;兩組間的比較采用成組t檢驗;ICAM-1在氟桂利嗪組的動態變化采用單因素方差分析。以P<0.05表示差異具有顯著性意義,P<0.01表示差異具有非常顯著性意義。
2 結 果
2.1 腦組織病理形態檢查結果
高血糖組:腦缺血區神經元數目減少,神經細胞皺縮、變性,可見空泡化改變,與周圍分界清楚,胞核固縮,組織間水腫明顯,隨著再灌注時間延長,缺血神經元損害加重,呈不可逆性神經細胞損傷性改變,絕大多數神經細胞壞死。見圖1。
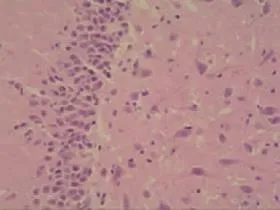
圖1 高血糖組(40×10)Fig 1 Hyperglycemia group(40×10)
氟桂利嗪組:隨著再灌注時間的延長,腦組織受損程度也逐漸加重,但與高血糖組相同再灌注時間點比較,變性、壞死的神經元減少,空泡化改變減輕,組織間水腫減輕。見圖2。
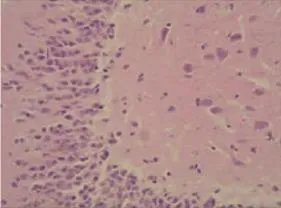
圖2 氟桂利嗪組(40×10)Fig 2 Flunarizine group(40×10)
2.2 ICAM-1表達結果
氟桂利嗪組于再灌注3 h可見ICAM-1陽性表達,24 h內逐漸增高,組內6 h與3 h比較P<0.01,24 h與6 h比較P<0.05;相同再灌注時間點氟桂利嗪組與高血糖組比較缺血區ICAM-1表達減少,且差異有非常顯著性意義,P<0.01。見表1。

表1 各組不同再灌注時間點ICAM-1的表達Tab 1 Different reperfusion time points ICAM-1 expression in each group (x ±s)
3 討論
腦血管病是嚴重危害人類生命安全的三大疾病之一,其中缺血性腦血管病占大多數,嚴重危害人類健康。而長時間的腦缺血后再灌注期間組織發生復雜的繼發性改變,加重組織損傷。目前認為腦缺血再灌注損傷的機制包括興奮性氨基酸的釋放、炎癥反應、基因表達的改變及細胞內鈣超載等。而細胞內鈣超載被認為是引起缺血再灌注損傷的重要環節。臨床發現腦缺血患者發病前常合并糖尿病或者在發病急性期常可見血糖升高,許多臨床及動物實驗也已證明高血糖可以加重腦缺血再灌注損傷。鹽酸氟桂利嗪作為第四代Ca2+拮抗劑,具有抑制病理性過量Ca2+內流而不影響正常Ca2+向細胞內流入的作用,是目前鈣通道阻滯劑中能透過血腦屏障的藥物之一,作用于神經元及血管的電壓依賴性鈣通道,從而阻滯腦缺血再灌注條件下的Ca2+內流,目前臨床已普遍應用于治療早期缺血性腦梗死。張秋鈴等[5]進行動物實驗研究發現預防性應用鹽酸氟桂利嗪能明顯減輕缺血再灌注對神經細胞的損傷,但至今為止,關于預防性應用鹽酸氟桂利嗪對高血糖條件下的腦缺血再灌注損傷保護作用的研究國內外尚未見報道。本實驗對腦缺血區的形態學觀察發現,高血糖組缺血區神經元數目減少,神經細胞皺縮,變性,可見空泡化改變,與周圍分界清楚,胞核固縮,組織間水腫明顯,隨著再灌注時間延長,缺血神經元損害加重,呈不可逆性神經細胞損傷性改變,絕大多數神經元壞死。氟桂利嗪組隨著再灌注時間延長,組織受損程度也逐漸加重,但與高血糖組各再灌注時間點比較變性、壞死的神經元減少,空泡化改變減輕,組織間水腫減輕。
炎癥反應是腦缺血再灌注損傷的重要因素,其最重要的功能是將白細胞輸送到損傷部位,而白細胞和血管內皮細胞之間的粘附是白細胞浸潤的關鍵步驟。此過程的始動因素部分是由于在腦血管內皮細胞表達的細胞間粘附分子ICAM-1和其配基,在白細胞表面表達的整合素分子CD11/CD18糖蛋白相互作用而引起的。ICAM-1屬粘附分子中的免疫球蛋白超家族,是中樞神經系統中細胞表達最廣泛的粘附分子,腦中幾乎所有的細胞如小膠質細胞、星形膠質細胞、少突膠質細胞、神經細胞均有ICAM-1的表達,但其在微血管內皮細胞表達最強[6]。正常情況下ICAM-1呈低表達,在感染、腦梗死等狀態下血清中ICAM-1含量出現顯著升高,尤其在急性腦梗死患者血清中ICAM-1增高程度與神經功能缺損程度及梗死灶大小密切相關,故認為ICAM-1含量變化反映出顱腦損傷程度[7]。動物實驗已經證實:通過針對ICAM-1拮抗劑或抑制劑可以明顯減輕腦損傷后的腦水腫[8]。另外,抗ICAM-1抗體使腦缺血后缺血區損傷減少,并可明顯減小腦梗死面積及缺血區組織中多型核白細胞的數目,推遲缺血后炎癥發生的時間,并可明顯降低缺血區凋亡細胞數,目前,已經有抗黏附分子單克隆抗體成功的用于實驗鼠治療腦缺血再灌注損傷,且收到良好的效果,并證明有神經保護、減輕腦損傷的作用[9-10]。本實驗發現氟桂利嗪組再灌注3 h可見ICAM-1陽性表達,24 h逐漸增高。周華東等[11]研究大鼠大腦中動脈缺血2 h再灌注不同時間內皮細胞ICAM-1表達發現,再灌注2 h ICAM-1開始升高,至48 h達到高峰,持續1周以上。
本實驗對氟桂利嗪組與高血糖組各再灌注時間點ICAM-1的表達情況進行了比較,發現相同再灌注時間點氟桂利嗪組ICAM-1的表達比高血糖組減少,且兩者差異具有顯著性意義。說明鹽酸氟桂利嗪對神經細胞的保護作用與減少ICAM-1表達,減輕炎癥反應有關。有文獻報道高血糖在缺血早期可以引發大量的白細胞在缺血區的聚集,這是高血糖加重腦缺血損傷的原因之一[12]。生理狀態下,粘附分子只有低水平的表達,而在缺血期間其在內皮細胞上的表達增加,這種反應對白細胞粘附尤為重要,是促進白細胞跨內皮遷移的必要過程[13]。而有研究發現ICAM-1與整合素分子CD11/CD18作用后能引起白細胞和內皮細胞內Ca2+濃度的增加[14],從而激活內皮細胞,使ICAM-1表達上調,介導更多的白細胞粘附,形成正反饋過程。Barnett等[15]的實驗亦發現穩定細胞內Ca2+濃度能阻止ICAM-1mRNA表達上調。而鹽酸氟桂利嗪作為電壓依賴性鈣離子通道阻滯劑可以通過阻止病理條件下的Ca2+內流,從而使ICAM-1表達減少。Etienne等[16]的實驗還觀察到ICAM-1能夠激活蛋白激酶c,催化ip3生成,引起細胞外Ca2+內流和細胞內鈣庫釋放Ca2+,引起細胞內鈣超載。Ca2+作為第二信使能夠啟動多種反應,包括引起細胞骨架修飾,進一步使血腦屏障內皮細胞間的連接松弛,以利于白細胞對缺血腦組織的趨化浸潤。綜上所述,鹽酸氟桂利嗪不僅可以阻止細胞內鈣超載,而且可以抑制ICAM-1的表達,從而打斷了這種ICAM-1偶聯的Ca2+信號轉導,阻止白細胞在缺血區的聚集,起到腦保護的作用。
本研究無論是從組織形態還是從分子水平上,都證實了預防性應用鹽酸氟桂利嗪對缺血前高血糖大鼠局部腦缺血再灌注損傷的保護作用。
[1]Els T,Klisch J,Orszagh M,et al.Hyperglycemia in patients with focal cerebral ischemia after intravenous thrombolysis:influence on clinical outcome and infarct size[J].Cerebrovasc Dis,2002,13(2):89-94.
[2]Li PA,Rasquinha I,He QP,et al.Hyperglycemia enhances DNA frag-mentation after transient cerebral ischemia[J].J Cereb Blood Flow Metab,2001,21(5):568-576.
[3]Kawai N,Keep RF,Betz AL,et al.Hyperglycemia induces progressive changes in the cerebral microvasculature and blood-brain barrier trans-port during focal cerebral ischemia[J].Acta Neurochir Suppl,1998,71:219-221.
[4]Baird TA,Parsons MW,Phanh T,et al.Persistent poststroke hyper-glycemia is independently associated with infarct expansion and worse clinical outcome[J].Stroke,2003,34(9):2208-2214.
[5]張秋鈴,邢國慶,宋希俊,等.預防性應用西比靈對腦缺血再灌注損傷保護作用的實驗觀察[J].中風與神經疾病雜志,2002,19(3):183-184.
[6]張麗慧,魏爾清.ICAM-1、VCAM-1在腦缺血損傷炎癥機制中的作用及調控[J].中國藥理學通報,2005,21 (11):1281-1285.
[7]Maier B,Laurer HL,Rose S,et al.Phys iological levels of pro-and anti-inflammatory mediators in cerebrospinal fluid and plasma:anorm ative study[J].J Neurotrauma,2005,22(7):822-835.
[8]Hailer NP,Vogt C,Korf HW,et al.Interleuk in-1 beta exacerbates and in terleukin-1 receptor an tagonist attenuates neuronal injury and microglial activation after excitotoxic damage in organotypic hippocampal slice cultures[J].Eur Neurosci,2005,21(9):2347-2360.
[9]Crucian B,Nelman Gonzalez M,Sams C.Rapid flow cytometry method for quantitation of LFA 1 adhesive T Cells[J].CVI,2006,13(3):403-408.
[10]Demirseren ME,Sarici M,Gokrem S,et al.Protective effects of monoclonal antibody to intercellular adhesion molecule-1 in venous ischemia reperfusion injury:experimental study in rats[J].J Reconstr Microsurg,2007,23 (1):41-44.
[11]周華東,張莉莉.腦缺血再灌注ICAM-1的表達與神經元損傷[J].第三軍醫大學學報,2000,22(2):115-118.
[12]Lin B,Ginsberg MD,Busto R,et al.Hyperglycemia triggers massive neutrophil deposition in brain following transient ischemia in rats[J].Neurosci Lett,2000,278(1-2):1-4.
[13]Small DL,Morley P,Buchan AM.Biology of ischemic cerebral cell death[J].Prog Cardiovasc Dis,1999,42(3): 185-207.
[14]Pfau S,Leitenberg D,Rinder H,et al.Lymphocyte adhesion-dependent calcium signaling in human endothelial cells[J].J Cell Biol,1995,128(5):969-978.
[15]Barnett CC Jr,Moore EE,Silliman CC,et al.Cytosolic phospholipase A(2)-mediated ICAM-1 expression is calcium dependent[J].J Srug Res,2001,99(2):307-310.
[16]Etienne Manneville S,Manneville JB,Adamson P,et al.ICAM-1 coupled cytoskeletal rearrangements and transendothelial lymphocyte migration involve intracellular calcium signaling in brain endothelial cell lines-1[J].J Immunol,2000,165(6):3375-3383.
Effect of pretreatment by flunarizine hydrochlorid on focal cerebral ischemia reperfusion damage and the expression of ICAM-1 in rats with hyperglycemia
GAO Zheng1,JIANG Li-jie2,XING Yun-yun3,WANG Xu-gang1
(1.Department of Neurology,The North Hospital of Dalian Medical University No.2 Affiliated Hospital,Dalian 116031,China;2.Department of Neurology,Third People’s Hospital of Dalian,Dalian 116031,China;3.Department of Cardiology,Fourth People’s Hospital of Shenyang,Shenyang 110031,China)
[Objective]To investigate whether pretreatment with flunarizine hydrochlorid could relieve the injury of local cerebral ischemia-reperfusion in rats with hyperglycemia.[Method]Thirty six healthy male SD rats(weight from 180 g to 220 g)were randomly divided into 2 groups:hyperglycemia group(n=18)and flunarizine+hyperglycemia group(flunarizine group n=18).The rats in each group were divided into 3 subgroups according to reperfusion 3 h(n=6),6 h(n=6) and 24 h(n=6)after ischemia for 90 minutes.The differences of cerebral pathological changes and the expressions of ICAM-1 among these groups.[Result]Compared with hyperglycemia group,the number of degenerative and necrosis neurons were less and tissue edema became was weaker.In the flunarizine group,the expression of ICAM-1 can be seen at 3 hours from reperfusion,and increase in 24 hours from reperfusion,P<0.05.Compared with hyperglycemia group at every reperfusion time:ICAM-1 expressions were decreased in flunarizine group,P<0.01.[Conclusion]The pretreatment of flunarizine hydrochlorid could decrease the expression of ICAM-1 and the focal ischemia-reperfusion damage of the ras with hyperglycemia.
flunarizine hydrochlorid;hyperglycemia;ischemia reperfusion;ICAM-1
Q95-33
A
1671-7295(2012)04-0339-04
2011-12-26;
2012-05-21
高政(1965-),男,遼寧大連人,教授,主任醫師。E-mail:bygzyz@163.com

