犬細小病毒的分離與鑒定
褚秀玲 段玉梅 曲緒友 李俊霞 蘇建青
摘要:采用細胞培養法對疑似犬細小病毒的糞便和內臟進行了分離和鑒定,并對分離到的病毒進行生物學特性鑒定和動物回歸試驗。結果共分離到3株CPV,分離株在貓腎細胞F81產生明顯細胞病變,血凝效價達1∶27~1∶210,細胞病變能被犬細小病毒陽性血清所抑制,接種幼犬后,分離株3可以引起試驗犬發病死亡。
關鍵詞:犬細小病毒;分離;鑒定
中圖分類號:S852.65+9.2文獻標識碼:A文章編號:0439-8114(2012)20-4576-03
犬細小病毒(Canine parvovirus,CPV)屬于細小病毒科細小病毒屬,為單股、負義、線形無囊膜的DNA病毒[1]。CPV可引起犬的出血性腸胃炎和心肌炎,并使白細胞大量減少,在幼犬中的發病率和死亡率都很高[2]。CPV對多種理化因素和常用消毒劑具有較強的抵抗力,在4~10 ℃存活6個月,37 ℃存活2周,56 ℃存活24 h,80 ℃存活15 min,在糞便中可存活數月至數年[3];該病毒對乙醚,氯仿和醇類有抵抗力[4]。CPV一年四季均可發病,以冬、春多發[5],飼養管理條件驟變、長途運輸、寒冷、擁擠均可促使該病發生[6]。病犬是主要傳染源,其嘔吐物、唾液、糞便中均有大量病毒[7]。根據臨床癥狀和血清學反應,可做出準確診斷[8-13]。本研究通過對山東毒株分離,并對其部分生物學特性進行研究,為該病的防治和后續研究提供一定的理論基礎。
1材料與方法
1.1材料
1.1.1主要試劑DMEM培養基為Gibco產品;小牛血清、谷氨酸胺、雙抗、胰蛋白酶等購自大連寶生物TaKaRa有限公司;其他化學試劑均為分析純試劑。
1.1.2病料病料為2009~2011年聊城大學獸醫院收集或其他養犬場送檢的可疑CPV病料,包括20份糞便樣品和10份臟器。
1.1.3試驗動物和細胞8只40~50日齡的山東細犬幼犬(抗CPV HI抗體效價小于1∶4),健康狀況良好;貓腎傳代細胞系(F81)和犬腎傳代細胞系(MDCK)等由聊城大學農學院實驗室保存。
1.2方法
1.2.1試劑的配制
1)1%豬紅細胞懸液的制備。用20 mL注射器內吸入阿氏液3~5 mL,于健康豬前腔靜脈采血10~15 mL,立即混勻,4 ℃保存備用。使用時用PBS洗滌保存的豬紅細胞,1 000 r/min離心5 min,洗滌3次,取紅細胞泥1 mL加稀釋液100 mL,再加入小牛血清白蛋白0.1 g,即為1%豬紅細胞懸液。
2)HA抗原配制。用移液器向V型血凝板每孔加稀釋液25 μL,然后吸取25 μL經福爾馬林滅活的CPV細胞培養物,在血凝板上倍比稀釋,最后1孔不稀釋,作為陰性對照;接著每孔加稀釋液25 μL和1%豬紅細胞懸液50 μL,于振蕩器上振蕩1 min混勻,于4 ℃冰箱靜置1~2 h,待紅細胞完全沉淀后判定。判定的方法是以50%紅細胞凝集為終點,在對照孔紅細胞完全不凝集,呈圓形小點沉于孔底時,凝集終點的稀釋倍數即為該抗原的HA效價,將此效價除以8,即是8單位血凝抗原的稀釋倍數。
1.2.2病料的處理
1)糞便樣品的處理:將病犬糞便用DMEM培養液稀釋(m∶m=1∶9),再加等量的氯仿混勻,4 000 r/min離心10 min,取上清,加入雙抗200 μL,4 ℃過夜,再經0.22 μm微孔濾膜過濾除菌,-20 ℃保存備用。
2)臟器樣品的處理。將臟器樣品用滅菌后的研磨器進行研磨,并反復凍融3次,同時加入9倍體積的DMEM細胞培養液,5 000 r/min離心25 min,取上清液,經過濾除菌。將處理好的樣品置-20 ℃保存,待分離鑒定。
1.2.3血清樣品HI抗體效價的測定取待檢血清0.2 mL,加入豬紅細胞懸液1滴,混勻于室溫吸收1 h,離心取上清液待檢。先用移液器向血凝板每孔加稀釋液25 μL,然后吸取待檢血清25 μL,在血凝板上倍比稀釋,最后2孔不稀釋作為對照,每孔加8單位HA抗原25 μL,最后1孔不加,作為血清對照。加完后振蕩混勻,于4 ℃冰箱靜置1~2 h判定。判定的方法是以完全不凝集為終點,在抗原對照孔完全凝集,血清對照孔完全不凝集的情況下,血清出現終點抑制的稀釋倍數,即為該血清的HI效價。
1.2.4病毒的分離采用同步接毒法,在F81細胞消化傳代后,按培養液量體積的1/10接入處理過的樣品,37 ℃靜置培養3~5 d,每天觀察有無細胞病變。如無細胞病變,則于培養的第4~5 d收取上清,繼續按常規傳代培養,至第5代仍無病變判為分離結果陰性;若出現細胞病變則分離結果為陽性,反復凍融3次,收毒,-20 ℃保存。
1.2.5生物學特性鑒定
1)理化特性。按《動物病毒學》[3]規定進行,取分離病毒的F81細胞培養物,分別做以下處理:50 ℃水浴作用60 min;加20%乙醚振蕩10 min,放4 ℃過夜,并無菌揮發除去全部乙醚;將病毒液調節pH為3時于4 ℃作用處理1 h,再用0.1 mol/L NaOH調至pH 7.2,進行耐酸性試驗,然后分別用F81細胞測定其TCID50變化。
2)紅細胞血凝試驗。采用微量血凝(HA)試驗,分別用0.5%的雞、豬、大鼠、兔和人(O型)的紅細胞懸液測定病毒培養液的HA效價。
3)細胞敏感譜。選用貓腎傳代細胞系(F81)、犬腎傳代細胞系(MDCK)作為接種對象,分別分離得到HA效價≥1∶128的細胞培養液。按常規方法進行同步接毒,37 ℃靜置培養24 h后,換液,每天觀察細胞病變(CPE),4~5 d收獲凍融,再以同樣方法連傳5代,以出現CPE作為感染指標。
1.2.6動物回歸試驗
用所分離的CPV分離株1,2和3(HA效價均為1∶512~1∶2 048)對試驗犬進行人工感染試驗。接種途徑為口服,劑量為5 mL,設空白對照組和試驗組。將幼犬隨機分為4組,每組2只。試驗Ⅰ組幼犬接種分離株1;試驗Ⅱ組幼犬接種分離株2;試驗Ⅲ組幼犬接種分離株3;將第4組設為空白對照,接種生理鹽水。對4組試驗犬進行隔離飼養。接種后,每天觀察試驗犬的臨床變化并進行體溫的測量,每3 d進行一次白細胞計數,自接種后5 d開始收集糞便,并進行CPV的HA/HI檢測。攻毒后觀察15 d,如無眼觀臨床癥狀、白細胞總數正常,則視為試驗犬健康。
2結果與分析
2.1病毒分離結果
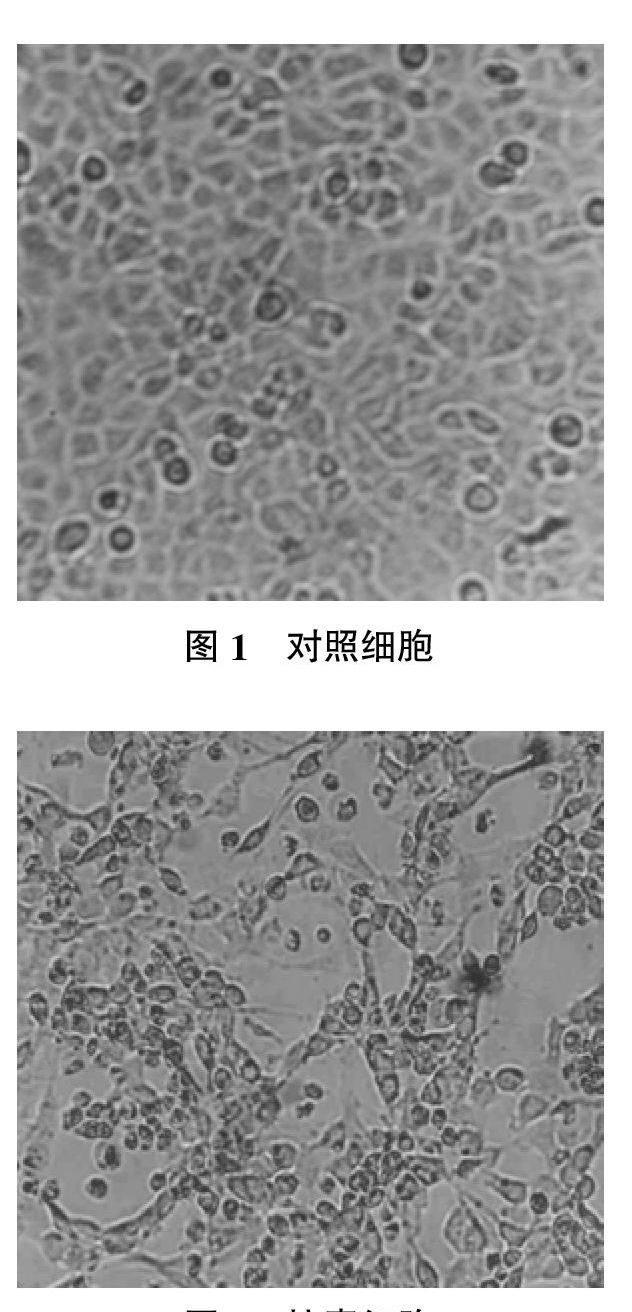
將處理后的病料接種F81細胞后,采用同步接毒進行病毒分離。在第一代細胞病變不明顯,但盲傳至第3~5代時,部分接毒細胞出現細胞圓縮、拉網和脫落等細胞病變,而對照細胞排列緊密,生長旺盛,呈不規則形(見圖1~2)。試驗共從3份病料中分離出病毒,分別命名為CPV分離株1、分離株2和分離株3。
2.2生物學特性
1)理化特性。經50 ℃、20%乙醚和酸(pH 3.0)處理后,通過比較處理前后TCID50的變化發現TCID50效價相差都小于2個數量級,變化不大。說明分離毒株能抵抗乙醚、酸(pH 3.0)和熱(50 ℃),這與細小病毒理化特性一致。
2)紅細胞血凝結果。采用微量血凝試驗測定各病毒分離株對雞、豬、大鼠、兔和人紅細胞的HA效價。分離株對豬紅細胞的凝集效價達到1∶27~1∶210;而對其他紅細胞的血凝效價為20,沒有血凝性。與文獻記載的CPV血凝譜相符。
3)細胞感染譜。將CPV分離株在多種細胞上同步接毒培養5代,并每天觀察CPE。結果表明,有3株CPV分離株連續傳代后出現細胞病變現象,分別命名為分離株1、2、3。
2.3動物回歸試驗結果
用病毒分離株感染幼犬后第5~6天,試驗組均發病。其中試驗Ⅲ組即接種CPV分離株3的2只幼犬在接種后第5天開始出現臨床癥狀,精神沉郁,嘔吐,排稀糞。隨后轉為拉血、脫水、食欲廢絕,最后死亡。
對病死幼犬病理剖檢發現空腸和回腸局部充血、粘膜脫落,腸系膜淋巴結腫脹,腸腔內有血樣糞便。其他2組試驗組犬接種后第6天表現出精神沉郁,體溫增高,食欲下降,拉稀便,但后來自行康復。所有接毒試驗犬的白細胞總數均出現不同程度的下降。但對照犬的白細胞總數沒有明顯變化。
試驗組犬在攻毒后5~8 d,幼犬糞便的HA效價為1∶128~1∶512,對照犬的糞便HA檢測結果均為陰性。
3討論
3.1病毒分離
本試驗通過采集疑似CPV感染犬的糞便和內臟,經處理后接種于貓腎細胞分離病毒,然后通過對分離病毒的生物學特性、血凝抑制試驗和動物回歸試驗等方法對病毒株進行了鑒定。
CPV無囊膜,用氯仿處理糞便可使有囊膜的病毒失活,有利于該病毒的分離和純化。部分出血很明顯的細小病毒樣本,反而沒有分離出病毒。可能因為在疾病中后期,由于腸道出血,血液中的犬細小病毒抗體和細小病毒形成抗原抗體復合物,造成樣品中的病毒量減少,細胞分離呈陰性。糞便中毒素和組織分解代謝產物會對培養細胞產生一定的影響。因此,如何處理糞便,盡量減少對細胞的毒性,成為能否成功分離病毒的關鍵。可以減少接種樣本數量(1/20~1/30),或接種后及時換液,可有效降低糞便中毒素對細胞的毒害作用,提高病毒分離率。CPV的復制須完全依賴宿主細胞DNA的復制機制,復制主要發生在細胞周期的S期晚期和G2早期,病毒的接種最好采用同步接種方式。所以,在試驗中采用了同步接毒的辦法。但由于樣本的毒性,可以在傳代后6~8 h再接種,能減少樣本對細胞的影響。
3.2病毒鑒定
通過對分離的病毒進行理化鑒定,發現所分離的病毒具有抗酸、抗脂溶劑和耐熱的特性,與文獻報道的細小病毒的理化性質一致。通過對不同動物紅細胞的血凝譜測定,所分離病毒能夠凝集豬的紅細胞,不能凝集雞、兔和人的紅細胞,與報道的CPV的血凝譜一致。病毒除了能在F81細胞增殖外,病毒株2還可以在MDCK細胞增殖。病毒血凝抑制試驗進一步確認所分離的病毒血凝特性能夠被犬特異性細小病毒血清抑制,證明試驗中分離到的病毒為犬細小病毒。
3.3動物回歸試驗
為了檢驗所分離犬細小病毒的致病性,進行了動物回歸試驗,分別將3株病毒人工接種試驗犬。動物試驗結果顯示,試驗組均發病,表現為拉稀、脫水、精神沉郁、食欲廢絕,對照組健康。
本試驗采用F81細胞同步接毒的方式從送檢的疑似CPV感染的30份樣品中分離出3份CPV陽性樣品。并對分離病毒進行了生物學和動物接種試驗,檢驗了分離病毒的致病性。其中分離株3可以引起接種幼犬死亡,表明是一株犬細小病毒的強毒株。本研究為犬細小病毒病的預防和控制提供了理論依據,同時為深入研究該病毒的致病機理奠定了基礎。
參考文獻:
[1] 馬景霞.犬細小病毒研究進展[J].山東畜牧獸醫,2008,29(5):47-49.
[2] 趙世華,宋愛軍,陳偉,等.犬細小病毒(CPV)內蒙古分離株的體外培養特性研究[J].畜牧與飼料科學,2010,31(9):168-169.
[3] 殷震,劉景華.動物病毒學[M].第二版.北京:科學出版社,1997.
[4] 王淑君,楊松濤,陳創夫,等.犬細小病毒四川流行株分離鑒定及其遺傳進化分析[J].現代生物醫學進展,2009,9(10):1888-1890.
[5] 劉志強,張小鶯,黃新,等.新疆石河子地區犬細小病毒的分離鑒定與基因型分析[J].中國獸醫雜志,2010,46(8):44-46.
[6] 蔡寶祥.家畜傳染病學[M].第5版.北京:中國農業出版社,2006:422-425.
[7] 戈銳,彭廣能,夏咸柱,等.犬細小病毒四川株的分離與鑒定[J].中國預防獸醫學報,2007,29(11):836-839.
[8] 楊龍峰,李英杰,艾萍萍,等.一株犬細小病毒的分離及VP2基因序列分析[J].山東畜牧獸醫,2011,32(1):6-8.
[9] 易立.犬細小病毒的分離鑒定、序列分析及VP2基因的融合表達[D].北京:中國農業科學院,2008.
[10] 杜強,邱薇,范泉水,等.犬細小病毒的分離鑒定[J].動物醫學進展,2009,30(3):55-58.
[11] 宋桂強,龍貴偉,范泉水,等.犬細小病毒病的研究進展[J].中國畜牧獸醫,2007,34(3):98-100.
[12] 張仁舟,楊松濤,馮昊,等.中國國內首次檢測到犬細小病毒CPV2c[J].中國病原生物學雜志,2010,5(4):246-249.
[13] 魏巍,李肖梁,帥江冰,等.犬細小病毒HZ0761株的分離與鑒定[J].畜牧與獸醫,2008,40(7):1-4.

