胰島素樣生長因子1在病理性瘢痕中的表達
梁茶 朱斌 唐冰 朱家源 蔡浩
[摘要] 目的 研究胰島素樣生長因子1(insulin-like growth factor 1,IGF-1)及其受體(IGF-1R)在病理性瘢痕中的表達及其意義,探討異常瘢痕發生的分子機制。 方法 收集增生性瘢痕、瘢痕疙瘩及正常皮膚標本,RT-PCR檢測不同組織中IGF-1、IGF-1R表達,并進行統計學分析。 結果 RT-PCR顯示瘢痕疙瘩中IGF-1R明顯高于正常皮膚,差異有顯著性(P=0.027<0.05);IGF-1R在增生性瘢痕中表達為弱陽性,與正常皮膚相比差異無顯著性(P = 0.894>0.05)。增生性瘢痕和瘢痕疙瘩中IGF-1明顯高于瘢痕周圍正常皮膚,差異有顯著性(P < 0.05)。 結論 IGF-1及IGF-1R在病理性瘢痕的形成過程中起重要作用。
[關鍵詞] 瘢痕疙瘩;增生性瘢痕;胰島素樣生長因子1受體;胰島素樣生長因子1
[中圖分類號] R622[文獻標識碼] B[文章編號] 1673-9701(2012)21-0024-02
病理性瘢痕是以成纖維細胞大量增生、膠原及基質等過度沉積為特征的皮膚結締組織的纖維化疾病,是臨床上常見的增殖性疾病之一,其發病機制尚未完全明了[1,2]。胰島素樣生長因子1(insulin-like growth factor 1,IGF-1)又稱生長介素和促生長因子,現有研究證實其與腫瘤等增殖性疾病關系密切[3]。本實驗旨在應用實時PCR(real time polymerase chain reaction,RT-PCR)檢測IGF-1及其受體(IGF-1R)在瘢痕疙瘩、增生性瘢痕以及正常皮膚中的表達,觀測IGF-1與IGF-1R在病理性瘢痕中表達的差異,探討IGF-1與病理性瘢痕的關系。
1 資料與方法
1.1 資料
本實驗中所有組織標本均采自2007年1月~2009年3月中山大學附屬第一醫院燒傷科、整形科住院病人的手術切除組織。納入標準:臨床確診的增生性瘢痕、瘢痕疙瘩和成熟瘢痕,簽署臨床研究的知情同意書。剔除標準:①瘢痕表面有皮膚破損、炎癥;②瘢痕局部接受外用藥物、注射藥物和放射等治療;③增生性瘢痕術后無剩余正常皮膚(<10 mg)作對照;④有糖尿病、周圍血管病、腫瘤及增殖性疾病史;⑤伴有嚴重心、肝、腎等臟器功能不全及重度營養不良。共納入18例,其中男9例,女9例。年齡18~48歲,平均23.3歲。
本實驗組織標本根據臨床診斷及病理學診斷[1,2]分類:①增生性瘢痕6例,位于燒傷創面愈合后3~6個月的四肢、軀干及面頸部瘢痕,瘢痕突出鄰近正常皮膚0.3~1.2 cm,充血明顯,質地硬實,無彈性,表面無破潰,有痛癢癥狀,病理切片結果為增生性瘢痕;②正常皮膚6例,取自身體鄰近增生性瘢痕的正常全層皮膚;③瘢痕疙瘩6例,4例為前胸部燒傷創面愈合后形成的瘢痕疙瘩,2例為穿耳環后形成的耳垂瘢痕疙瘩。受傷時間1~3年。瘢痕突出鄰近正常皮膚0.5~2 cm并侵襲周圍正常皮膚,充血明顯,質地堅硬,無彈性,表面無破潰,病理切片結果為瘢痕疙瘩;④成熟瘢痕6例,受傷后5年以上四肢瘢痕,瘢痕色白或接近正常皮膚,質軟,有彈性,無痛癢,表皮完整,病理切片結果為成熟瘢痕組織。24份組織標本共取自18例患者。
1.2 方法
所有組織標本于術后常規送病理切片檢查,剩余組織標本置于含有胎牛血清(20%)和二甲基亞砜(10%)的緩沖液中-80 ℃超低溫冰箱凍存,封口、編號并標記日期,備RT-PCR使用。
所有組織標本經病理學證實取材正確后,分為4組,對照組為正常皮膚組,實驗組為增生性瘢痕組、瘢痕疙瘩組和成熟瘢痕組,每組6份標本。利用RT-PCR檢測各組標本中IGF-1含量。RT-PCR程序按說明書進行,主要包括引物探針設計合成、組織總RNA的提取、逆轉錄反應、熒光定量PCR反應。按我們既往報道的方法進行[4]。
1.3 統計學方法
利用SPSS16.0統計軟件,以“最小值~最大值(中位數)”表示數據,對各實驗組中IGF-1含量進行方差齊性檢驗。
2 結果
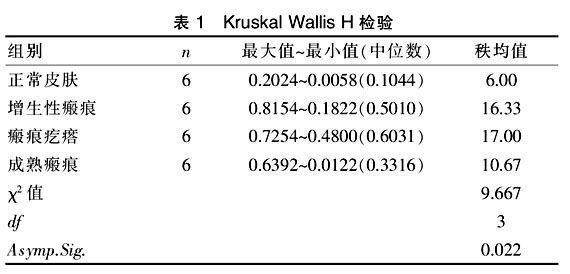
方差同質性Levene檢驗結果為P=0.006,說明方差不齊,進行非參數檢驗,取用Kruskal-Wallis H檢驗。Kruskal-Wallis H檢驗結果為漸近顯著性,(Asymp.Sig.)=0.022< 0.05,可以得出結論,四組組間的IGF-1含量是不同的,瘢痕疙瘩、增生性瘢痕的IGF-1含量高于正常皮膚。見表1。
表1 Kruskal Wallis H檢驗
3 討論
本研究中所有病理性瘢痕組織標本選擇除了依靠病史、體格檢查等診斷外,還對本研究中所有組織標本進行病理組織學檢測(于中山大學附屬第一醫院病理科及外科實驗室完成),剔除接受過局部外用藥物/注射藥物和放射治療者、合并其他疾病(如皮膚病、糖尿病、腫瘤等)及拒絕簽署組織標本臨床研究使用知情同意書者,所有納入研究的24份組織標本取材正確。
隸屬于胰島素樣生長因子范疇的IGF-I又稱生長介素和促生長因子,其氨基酸序列與胰島素原有同源性。由70個氨基酸組成具有內分泌、自分泌及旁分泌的單鏈多肽,IGF-1編碼基因位于12號染色體短臂上。人體的IGF-l主要由肝臟合成和分泌。IGF-1與胰島素樣生長因子-1受體(Insulin-like growth factor receptor-1,IGF-1R)結合后,通過受體自身磷酸化,激活酪氨酸激酶、磷脂酰肌醇(IP)-3激酶/蛋白激酶B (protein kinase B,PKB)等途徑,還可激活胰島素受體底物(insulin receptor substrate,IRS)家族蛋白1~42,同時抑制Caspase-3的活化而抑制細胞凋亡,通過這些方式發揮促進生長發育和物質代謝的作用[5-7]。
近年來國內外學者一致認為血IGF-1水平與生長密切相關。IGF-1具有以下的生理功能。①促進生長發育。人類IGF-1的主要作用是出生后通過自分泌和旁分泌機制促進局部組織的生長,在青春期前升高,后隨年齡的增長有所下降。②增進細胞增殖、分化。IGF-1是有絲分裂原,是細胞從G0期向S期轉變所必需的因子。IGF-1通過自分泌和旁分泌機制對許多組織細胞的增殖、分化起調節作用,如對骨組織的正常生長和成熟、肌母細胞的分化、皮膚組織的正常生長和分化、神經組織的生長等都有重要的調節作用[8,9]。
國內外研究同時認為:IGF-1通過促纖維化效應和絲裂原效應[10,11]刺激成纖維細胞增殖和瘢痕形成,是與凋亡抗性關系密切的細胞生長因子。以往各研究中IGF-1檢測均通過免疫組化的半定量檢測,實驗結果容易受染色時間、觀察時間等主觀因素影響,假陽性率高,結果不準確。本研究利用RT-PCR定量檢測IGF-1含量,具有準確率高、特異性強等特點。
本研究RT-PCR檢測中使用的正常皮膚組織標本取自增生性瘢痕鄰近皮膚,增生性瘢痕與正常皮膚的檢測結果可比性強。Kruskal-Wallis檢驗結果顯示增生性瘢痕中IGF-1含量較瘢痕周圍正常皮膚明顯增高(P < 0.05),證明IGF-1主要來自瘢痕組織細胞的自身分泌。而瘢痕組織細胞主要為纖維細胞,進而推測瘢痕組織IGF-1主要來自纖維細胞自分泌與旁分泌。
本研究發現各組織中IGF-1含量高低順序依次為:瘢痕疙瘩與增生性瘢痕,成熟瘢痕中IGF-1含量有所降低,但仍高于正常皮膚。研究認為:病理性瘢痕中IGF-1主要來源于瘢痕組織自分泌,在增生性瘢痕與瘢痕疙瘩中明顯高于周圍正常皮膚,隨著瘢痕的成熟、成纖維細胞不斷膠原化、合成及分泌功能下降,導致成熟瘢痕組織中IGF-1逐漸減少,因此成熟瘢痕中IGF-1含量比瘢痕疙瘩及增生性瘢痕都有所減少,推測IGF-1含量高低可能與瘢痕組織中成纖維細胞生長速度及分泌膠原功能同步。說明可能在瘢痕形成過程中,IGF-1與IGF-1R結合后,促進成纖維細胞分裂增殖及合成分泌膠原,IGF-1起到促增殖及促纖維化作用,在瘢痕形成和發展中起著重要作用。
在病理性瘢痕的形成過程中,IGF-1作為一個促纖維化效應和絲裂原效應,促進瘢痕組織中成纖維細胞增殖與分泌膠原,是病理性瘢痕形成過程中一個重要的生長因子。
[參考資料]
[1]蔡景龍,張宗學.現代瘢痕學[M]. 第2版.北京:人民衛生出版社,2008:88-156.
[2]李玉林. 病理學[M]. 第6版. 北京:人民衛生出版社,2008:32-46.
[3]Fumkawa M,Rafeld M,Mateo C,et al. Increased expression of insulin-like growth factor I and/or its receptor in gastrinomas is associated with low curability,increased growth,and development ofmetastases[J]. Clin Cancer Res,2005,11(9):3233-3242.
[4]Bing Tang,Jiayuan Zhu,Bin Zhu. Increased expression of TGF-β inducible early gene(TIEG1) in keloid scarrin[J]. Prog Biochem Biophys,2007,34(10):1033-10392.
[5]Yin D,Tamaki N,Parent AD,et al. Insulin-like growth factor-I decreased etoposide-induced apoptesis in glioma cells by increasing cl-2 expression and decreasing CPP32 activity[J]. Neurol Res,2005,27(1):27-35.
[6]Remaele-Bonnet M,Garronste F,Baillat G,et a1. Membrane rafts segregate profmm antiapeptoticinsulin-like growthfactor-l receptor signaling in colon carcinoma cells stimulated by membersof the tumor necrosis factor superfamily[J]. Am J Patho1,2005,167(3):761-766.
[7]Rosner M. The mTOR pathway and its role in human genetic diseases[J]. Mutat Res,2008,6(59):284-292.
[8]KohdaM,HoshiyaH,Katoh M,et al. Frequent loss of imprinting of IGF2 and MEST in lung adenocarcinoma[J]. Mol Carcinog,2001,31(4):184-191.
[9]Sarbassov DD. Prolonged rapamycin treatment inhibits mTORC2 assembly and Akt/PKB[J]. Mol Cell,2006,22(2):159-168.
[10]Ishihara H,Yoshimoto H,Fujioka M,et al. Keloid fibroblasts resist ceramide-induced apoptosis by overexpression of insulin-like growth factor I receptor[J]. J Invest Dermatol,2000,1l5(6):1065-l071.
[11]唐冰,朱家源,朱斌,等. 瘢痕疙瘩中TIEG1的高表達[J]. 生物化學與生物物理進展,2007,34(10):1033-1039.
(收稿日期:2012-05-18)

