鈣磷對酸鋁脅迫后紫花苜蓿-根瘤菌體系結瘤固氮的修復效應
王曉鋒,羅珍,劉曉燕,朱丹,夏志強,周建華,張磊
(西南大學資源環境學院,重慶 北碚400715)
*全世界約39.5億hm2土壤屬于酸性土壤,占耕地和潛在可耕地的50%以上[1]。2000年初,我國酸性土壤總面積為2.03×107hm2,占全國土地總面積的21%[2]。由于氣候和長期施用化肥等原因,酸性土壤及其酸度存在擴大和惡化的趨勢。同時,我國酸雨分布區與酸性土壤分布區重疊,也加劇了我國南方土壤的酸化進度,嚴重影響南方種植業及其相關產業的發展。在酸性土壤中,鋁離子從硅酸鹽或氧化物中釋放出來,溶解到土壤溶液中而對植物產生的毒害作用[3],已經成為一個世界性的限制酸性土壤上作物產量的主要因子。紫花苜蓿(Medicagosativa,俗稱alfalfa)是一種營養豐富的優良牧草,具共生固氮能力,根系非常發達,能有效防止雨水的沖刷,是理想的水土保持植物[4],擴大其種植已被列入國家重大規劃項目。但是,紫花苜蓿是對酸性土壤條件最為敏感的植物之一[5],酸性土壤的鋁毒脅迫更加限制了苜蓿的北草南引。因此,有必要建立高效耐酸鋁的豆科植物-根瘤菌共生體系,并結合物理化學手段,提高苜蓿耐受酸性土壤及其鋁毒脅迫的能力。
鋁毒(aluminum toxicity)對植物的毒性及其作用機理已有過許多報道[6-9]。對豆科植物而言,酸鋁脅迫不僅影響根瘤菌與宿主植物的接觸,而且限制根瘤菌結瘤因子(nod factor)的產生、宿主根毛去極化以及結瘤基因的表達[10,11]。進一步地,鋁離子交換量占土壤中陽離子交換總量的20%~80%,土壤溶液中過剩的鋁離子容易導致土壤陽離子流失,造成磷、鈣、鉬等營養元素缺乏[12]。研究表明,施鈣[13,14]和磷礦粉[15]能夠有效地緩解鋁毒。目前大部分相關研究都只對單獨施用鈣或磷以緩解鋁毒的效應進行探討,對同時補充鈣和磷的緩解效應鮮有報道。酸鋁脅迫主要對幼苗根系作用,而且毒害效應很快,研究鈣、磷對酸鋁脅迫之后豆科作物及其共生固氮性能的修復效應具有一定實踐意義。
許多細菌能夠通過小的可擴散的信號分子感知細胞密度和調控其各生理功能,該過程即“群體感應”(quorum sensing,簡稱QS)[16]。豆科根瘤菌(Rhizobium)的群體感應調控系統被證明會影響其生長和共生固氮[17]。根瘤菌與豆科宿主植物間共生關系的形成是宿主和根瘤菌間復雜的信號釋放和識別的結果[18,19],該識別過程首先引起大量根瘤菌在植物根系聚集,而細胞密度的增加受群體感應調控,是一種重要的信號感應過程[20]。據報導,苜蓿根瘤菌(Sinorhizobiummeliloti)的群體感應系統可能會影響結瘤數目和共生過程[21];苜蓿中華根瘤菌的群體感應系統控制胞外多糖EPSⅡ的產生,該多糖與根瘤的形成過程有關[22]。關于酸鋁脅迫對紫花苜蓿共生結瘤的影響已有一些研究報道[23,24]。在此基礎上,本研究從固氮酶活性、根毛變形、結瘤動力學等角度,探索鈣、磷恢復酸鋁脅迫后紫花苜蓿-根瘤菌共生固氮能力的效應,并從群體感應這一化學行為入手,初步探討修復機理。
1 材料與方法
1.1 試驗材料
紫花苜蓿為三得利紫花苜蓿(Medicagosativacv.Sanditi),購自江蘇省連云港草業中心。苜蓿根瘤菌91522為本研究室分離獲得,能在p H 4.8的YMA固體培養基上正常生長并能使紫花苜蓿植株結瘤,是一株耐酸根瘤菌[25-27]。根瘤菌培養基采用改進的 YMA 培養基:甘露醇10 g,酵母浸出粉5 g,NaCl 0.1 g,MgSO4·7H2O 0.2 g,K2HPO40.5 g[28]。供試Ca2+為分析純CaCl2,P素為 Na H2PO4。
自體誘導物(autoinducers,AI)高效檢測菌株KYC55由南京農業大學朱軍教授饋贈。檢測菌株采用改進的AT培養基:50 m L AT鹽,50 m L AT buffer,10 m L 50%葡萄糖,890 m L H2O[AT鹽:40 g(NH4)2SO4,1.56 g MgSO4,0.152 g CaCl2,0.1 g FeSO4·7 H2O,0.044 g MnSO4·H2O,1 L H2O;AT buffer:214 g KH2PO4,定容1 L,KOH調節p H=7.3;50%葡萄糖:消毒,常溫保存]。
1.2 試驗方法
1.2.1 紫花苜蓿無菌幼苗及苜蓿根瘤菌91522的培養 紫花苜蓿種子幼苗準備:先用95%乙醇浸泡5 min,再用0.1%HgCl2溶液滅菌6~10 min,無菌水沖洗5~6次,播種于滅菌的濾紙上[28],于(28±1)℃下暗培養1 d,再于(28±1)℃、16 h的光照下萌發2 d(用于根毛變形率檢測)和5 d(用于結瘤檢測)。
苜蓿根瘤菌91522的培養:取生長于p H 4.8斜面的供試菌株各1支,用5 m L無菌水洗下菌體,取1 m L接種于100 m L中性YMA培養液中進行快速培養復活,置于28℃恒溫震蕩器中培養24 h,調節其OD600值約為1.0。
1.2.2 紫花苜蓿結瘤試驗 試驗于2011年10-12月,在西南大學溫室內進行。用2 L不透明塑料桶作培養缽,每盆注入用無菌水配制的Fahraeus無氮營養液1 000 m L[14],營養液含 AlCl3濃度為20μmol/L[24],以HAc-Na Ac緩沖液調節溶液p H為4.8,取正常生長5 d的苜蓿幼苗分散固定在漂浮盤上,培養于各處理營養液中,每盆10株。同時,每盆中接種新培養的苜蓿根瘤菌9 1 5 2 2菌液1 0 m L。處理8 d后進行鈣、磷處理。鈣、磷水平如表1,每個處理設置3個重復;所有處理均在(28±1)℃、光照/黑暗為16 h/8 h條件下培養,期間每天通氣20 min,每周調節p H并補充營養液。從接入苜蓿根瘤菌91522開始起,前20 d每天觀察苜蓿根系結瘤情況,之后每2 d觀察結瘤,記錄現瘤日期和10株苜蓿各階段結瘤總數,培養60 d后收獲,統計最終結瘤率。
培養結束后,取出植株,剪掉地上部分,將結瘤的根系分別剪開。主根上的瘤子可用剝皮法取下,側根瘤要帶少量根剪斷,收集到150 m L血清瓶內,蓋上反口膠塞,立刻按瓶子體積用注射器注入占體積10%的C2H2,28℃保溫1 h。然后用注射器吸出一定體積的混合氣體,用氣相色譜儀測定C2H4產生量,獲得固氮酶活性。
將培養液通過真空泵進行抽濾,除去水體中的雜物或雜質,然后用等量的酸化乙酸乙酯(含0.5%的甲酸)提取,收集的有機相用旋轉蒸發儀蒸發至剩余4 m L左右,溶于一定量的甲醇中,-20℃保存作自體誘導物N-乙酰高絲氨酸內酯(AHLs)測定。

表1 水培條件不同鈣、磷水平試驗設計表Table 1 Design of different Ca2+and P levels
1.2.3 紫花苜蓿根毛變形試驗 試驗于2011年11月進行。分別設置酸鋁脅迫條件為p H=4.8和鋁濃度20 μmol/L和含鈣、磷水平如表1的Fahraeus營養液,裝于不透明塑料杯中,100 m L/杯。將在Fahraeus無氮營養液中培養的苜蓿幼苗(在人工氣候箱中培養2 d,根長3 cm左右)15株根浸入酸鋁營養液中處理24 h,之后將幼苗移入含鈣、磷的營養液中,并接種根瘤菌(菌株91522,OD600=1.0)1 m L,培養24和48 h后用0.5 mmol/L CaCl2洗根,濾紙吸干后用倒置顯微鏡鏡檢根毛變形,每個處理設置3個重復。分別統計根毛總數和變形根毛數,計算根毛變形率[24]。

1.2.4 測定方法 群體感應測定:β-半乳糖苷酶活法檢測自體誘導物活性,按照Zhu等[29]的方法進行操作,將檢測菌株KYC55在不含抗生素的新鮮AT培養基培養至OD600=0.5左右,搖勻,分裝到1.5 m L離心管中,加入150μL AHLs粗提液后搖勻,28℃過夜培養,約14 h;吸取200μL上述菌液加入到2 m L無菌離心管,然后依次加入0.8 m L Z-buffer,50μL 0.1%SDS,150μL氯仿,劇烈振蕩10 s后,加入100μL 4 mg/m L的鄰硝基苯-β-D半乳糖苷(ONPG),搖勻,待變黃后加入600μL Na2CO3(1 mol/L)終止反應,記變色時間;4 000 r/min離心5 min后,以新鮮培養基作陰性對照,分別測定上清液OD420和OD600;根據變色時間,計算β-半乳糖苷酶的活性。計算公式如下:

式中,T0表示起始時間;TS表示變色時間。
固氮酶酶活性測定主要參考張國霞等[30]的方法,采用氣相色譜測定根瘤還原乙炔為乙烯的量。
1.3 數據處理
原始數據在Excel中進行標準化處理,應用SPSS 17.0軟件對試驗數據進行方差分析,5%水平下LSD多重比較各處理平均值之間的差異顯著性。
2 結果與分析
2.1 鈣磷交互作用對酸鋁脅迫后苜蓿結瘤的影響
2.1.1 鈣磷交互作用對酸鋁脅迫后紫花苜蓿結瘤的恢復效果 酸鋁脅迫降低苜蓿結瘤率至36.67%。施加不同濃度P素能夠提高結瘤率,但不顯著(表2);10 mmol/L Ca2+可以將結瘤率提高到80.00%;在5和10 mmol/L Ca2+下,均表現出4μmol/L P素處理優于30μmol/L處理。

表2 不同鈣磷處理對酸鋁脅迫下紫花苜蓿結瘤的影響Table 2 Effects of Ca2+and P on nodulation of M.sativa under acid and aluminum stresses
4μmol/L P能夠顯著提高苜蓿結瘤總數,高濃度P(30μmol/L)則表現出一定的抑制作用;施加Ca2+后結瘤總數顯著提高,在處理濃度范圍內,Ca2+濃度越高,其影響越顯著,10 mmol/L Ca2+的最高,較不施鈣條件下結瘤數提高了207.5%;在同一Ca2+水平下,4μmol/L P素處理結瘤總數顯著高于0和30μmol/L,Ca2+10 mmol/L和P 4μmol/L處理下結瘤總數比無鈣磷處理提高了247.1%。
在酸鋁脅迫條件下,紫花苜蓿結瘤鮮重為38.4 mg/株,施加一定量P對瘤鮮重具有一定促進作用,但提高不顯著;Ca2+能夠顯著提高瘤鮮重,而且高濃度Ca2+效果優于低濃度,10 mmol/L Ca2+下瘤鮮重比不施鈣磷處理提高了183.1%。鈣磷交互作用表現為同一Ca2+水平下,4μmol/L P處理瘤鮮重均高于無P和高P(30 μmol/L)處理,Ca2+10 mmol/L和P 4μmol/L條件下苜蓿瘤鮮重較無鈣磷處理提高了254.7%。
在酸鋁脅迫處理1周后接種耐酸根瘤菌91522,紫花苜蓿現瘤時間為26 d,脅迫后只加入P,現瘤時間比對照提前了4~5 d;脅迫后施入不同濃度的Ca2+能夠使現瘤時間提前9~12 d,表現出良好的恢復效果;Ca2+、P交互作用下,10 mmol/L Ca2+和4μmol/L P處理苜蓿現瘤時間可提前至14 d。
2.1.2 鈣磷交互作用對酸鋁脅迫后紫花苜蓿根瘤菌結瘤動力學曲線的影響 圖1為統計各處理10株苜蓿結瘤總數構建的結瘤動力學曲線,結瘤過程可分為現瘤期(14~26 d)、結瘤中期(26~38 d)和平臺期(38~60 d)。酸鋁脅迫條件下,紫花苜蓿在接種根瘤菌后26 d出現結瘤,補充適當的P素現瘤時間提前到20~22 d(圖1),補充不同濃度Ca2+后現瘤時間提前到14~17 d,比無鈣磷處理提前了9~12 d(圖1);施加P和Ca2+對同期結瘤數均有促進(圖1),其中P素作用不顯著,Ca2+作用從現瘤起就表現出顯著效果,而且Ca2+10 mmol/L對同期結瘤數增效顯著高于Ca2+5 mmol/L處理。Ca2+5 mmol/L 條 件 下,施 加 P 4 μmol/L對同期結瘤數影響顯著,P 30μmol/L作用與不施磷相似;Ca2+10 mmol/L條件下,P 4μmol/L處理在結瘤中期對同期結瘤數有顯著提高,而P 30 μmol/L并未表現出促進作用。比較同水平P素條件下施加Ca2+后結瘤動力學曲線的變化,隨Ca2+濃度的提高,同時期結瘤數相應提高。
單獨補充Ca2+條件下,10 mmol/L處理現瘤時間比5 mmol/L處理提前3~5 d,在14~30 d結瘤數提高程度高于30 d之后(圖1);在P 4μmol/L條件下補充Ca2+,其促進作用貫穿整個培養過程,且促進程度穩定;P 30μmol/L條件下補充Ca2+5 mmol/L后,結瘤數增加程度有限,且至38 d達到平臺期,補充Ca2+10 mmol/L在中期有一段停滯期,總體的增加程度不如P 4μmol/L。
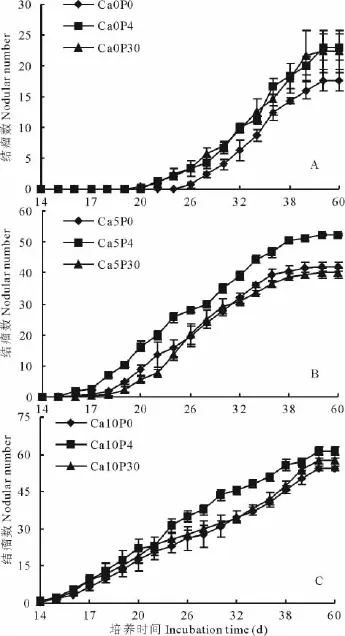
圖1 不同Ca2+、P交互對酸鋁脅迫條件下紫花苜蓿結瘤(個/10株)動力學曲線的影響Fig.1 Effects of Ca2+ and P on dynamic curves of nodulation(No./10 plant)on M.sativa under acid and aluminum stresses
2.2 根毛變形
酸鋁脅迫處理后,僅接種苜蓿根瘤菌91522處理,24 h苜蓿根毛沒有發生變形,不同濃度P素處理下少量根毛出現變形;Ca2+處理下根毛變形率顯著提高,而且效果隨Ca2+濃度增加而顯著提高。
接種苜蓿根瘤菌91522 48 h后,3.3%的苜蓿根毛發生變形,而且發生變形的根毛數量表現出隨Ca2+、P濃度提高而升高,但與P 0μmol/L處理相比,P素處理沒有顯著差異。Ca2+顯著提高根毛變形率,Ca2+10 mmol/L處理的根毛變形率顯著高于5 mmol/L處理。Ca2+、P處理存在交互效應(圖2):在Ca2+5 mmol/L條件下,添加P素根毛變形率顯著高于無P處理,Ca2+10 mmol/L時,添加P素處理根毛變形較無P處理有所提高,但不顯著。可見,P素在低鈣(5 mmol/L)條件下對根毛變形的修復效果好于高鈣(10 mmol/L)條件。在Ca2+存在時,P素30μmol/L對根毛變形反而有抑制作用,不利于對根毛變形的修復。
2.3 群體感應QS
β-半乳糖苷酶活性代表60 d培養結束后營養液中AHLs活性(圖3),即群體感應強度。不同濃度P素處理的群體感應強度沒有顯著差異,維持在40 Miller Units左右;加Ca2+處理下群體感應強度顯著高于零鈣處理,Ca2+5和10 mmol/L處理比Ca2+0 mmol/L群體感應強度分別提高了85.04%和75.43%;在同濃度Ca2+處理中,施加P素群體感應強度均表現為P 0μmol/L<P 30μmol/L<P 4μmol/L,但沒有顯著差異,其中以Ca2+5 mmol/L和P 4μmol/L處理群體感應強度最高,該條件下苜蓿根瘤菌91522自體誘導物的分泌顯著恢復和增加,進而促進修復苜蓿、根瘤菌的信息交流。
2.4 固氮酶活性
本試驗中對不同處理下根瘤固氮酶活性進行檢測。與不加Ca2+、P處理相比,P處理對酸鋁毒害下紫花苜蓿根瘤固氮酶活性具有顯著的恢復效應,P 30μmol/L處理固氮酶活性高于P 4μmol/L,但是沒有顯著差異(圖4);Ca2+也能夠顯著恢復固氮酶活性,但10 mmol/L Ca2+顯著低于5 mmol/L Ca2+處理,可見,Ca2+對酸鋁脅迫之后苜蓿根瘤固氮酶活性的恢復具有顯著作用,而高濃度Ca2+并不利于固氮酶活性的提高;在相同Ca2+濃度處理下,補充P素固氮酶活性較無P素處理均有提高,而且低磷(4μmol/L)處理效果顯著。

圖2 不同Ca2+、P交互對酸鋁脅迫條件下紫花苜蓿根毛變形率的影響Fig.2 Effects of Ca2+ and P on hair deformation rate of M.sativa after acid and aluminum stresses
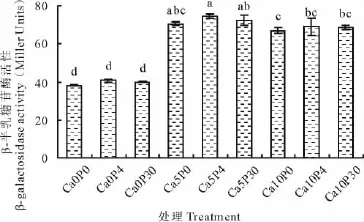
圖3 不同鈣磷交互處理對酸鋁脅迫下苜蓿根瘤菌91522群體感應的影響Fig.3 Effects of Ca2+ and P on QS of S.meliloti under acid and aluminum stresses

圖4 不同鈣磷交互處理對酸鋁脅迫下苜蓿根瘤固氮酶活性的影響Fig.4 Effects of Ca2+ and P on nitrogenase activity of S.meliloti under acid and aluminum stresses
3 討論
酸鋁脅迫條件下,Ca2+、P吸收受阻成為限制豆科植物結瘤固氮的重要原因。本研究對酸鋁脅迫7~8 d后的苜蓿根瘤菌91522和紫花苜蓿進行Ca2+、P處理,結果表明Ca2+能夠顯著促進酸鋁脅迫后苜蓿與耐酸根瘤菌的結瘤,緩解脅迫對結瘤過程的限制,提高結瘤率、結瘤總數以及瘤鮮重,而且隨Ca2+濃度的提高,對紫花苜蓿結瘤過程的修復效果越顯著。Ca2+在緩解酸鋁對苜蓿根瘤菌91522結瘤固氮中效果顯著;Ca2+、P處理的修復效果有交互作用,適當的P素(4μmol/L)可以在Ca2+基礎上進一步提高結瘤效果,對受到酸鋁脅迫后紫花苜蓿結瘤能力有良好的修復效果。一般對豆科植物而言,Ca2+被認為是結瘤因子信號轉導途中的第二信使[31]。當根毛接觸結瘤因子之后,胞內Ca2+通過細胞質膜上的配位體-通道釋放出來,耦合IIA型鈣離子泵形成Ca2+循環,引起結瘤基因被激活[32]。另外,磷素能夠通過影響豆科作物的生長間接影響根瘤的形成和生長[33],或是直接參與根瘤的形成和共生固氮[34-38]。所以 Ca2+、P緩解鋁毒害的作用得到共識[13,14,15,25],然而往往忽略了 Ca2+、P素對遭受酸鋁毒害后共生體系形成過程的恢復作用。本研究在苜蓿根瘤菌體系遭受短期酸鋁毒害之后補充Ca2+、P,得到了良好的修復效果,所以南方酸雨頻發地區可通過雨后補充少量Ca2+、P以恢復苜蓿生長,提高抗逆能力。
Soto等[39]研究表明,p H 5.6條件下耐酸苜蓿根瘤菌結瘤動力學曲線不受Ca2+影響。而張琴等[14]研究表明,p H 5.5,5.2,5.0,4.8條件下施加5 mmol/L Ca2+能夠促進耐酸苜蓿根瘤菌91522與紫花苜蓿結瘤,而且在整個培養時期效果都非常明顯。本試驗中,酸鋁脅迫處理7~8 d后,單獨施加Ca2+、P均能夠使酸鋁脅迫后苜蓿根瘤菌與紫花苜蓿結瘤時間提前,Ca2+恢復效果好于P素;Ca2+能夠顯著提高同期結瘤數,補充P素對結瘤數有增加效果。因此,在酸性土壤中種植紫花苜蓿,可以通過合理的補充Ca2+、P修復其與土著耐酸根瘤菌的結瘤固氮,進而可以作為修復酸鋁土壤的可行途徑。
根瘤菌根毛變形是根毛對根瘤菌入侵和結瘤因子誘導的結瘤反應,是苜蓿結瘤的第一步。根毛變形率提高意味著結瘤數的增加,固氮能力的提高。本研究證實,酸鋁脅迫處理24 h,接種根瘤菌后苜蓿根毛變形率僅為3.3%,這與楊敏等[24]結論相似。本研究發現,補充Ca2+和適當的P素使得酸鋁脅迫后紫花苜蓿根毛變形顯著恢復。一方面,施鈣提高根瘤菌在酸性脅迫土壤中的生長存活能力[14],而且本研究也表明Ca2+、P可能通過改善酸鋁脅迫后苜蓿根瘤菌的活力(結果未列出),進而影響結瘤因子分泌;另一方面,楊敏等[24]研究認為,酸鋁抑制結瘤信號傳遞導致苜蓿根毛變形受阻,而Ca2+作為結瘤因子信號轉導途中的第二信使,提高了經受酸鋁脅迫后的根毛感應結瘤因子的能力。Ca2+、P修復酸鋁脅迫后紫花苜蓿根毛變形,成為結瘤固氮恢復的重要原因之一。
王樹起等[40]研究表明,隨著磷濃度的增加,大豆根瘤固氮酶活性呈增加趨勢,而且隨著反應時間的延長,各磷處理間的差異有增大的趨勢,表明施磷對提高豆科根瘤的固氮效率有顯著的促進作用。Tang等[41]在苜蓿對磷素的反應試驗中表明,磷素能夠提高苜蓿根瘤固氮酶還原乙炔生成乙烯的量,即提高固氮酶活性。本試驗中酸鋁脅迫后,通過補充P素,紫花苜蓿根瘤固氮酶活性顯著提高;本試驗中Ca2+能夠有效地恢復固氮酶活性,但較高濃度Ca2+(10 mmol/L)對固氮酶活性有抑制作用;同水平Ca2+條件下,適當補充P素(4μmol/L)能夠顯著提高固氮酶活性。所以利用Ca2+對酸鋁毒害后苜蓿根瘤固氮酶活性具有良好的恢復能力,而且4μmol/L P濃度在Ca2+作用的基礎上也表現出促進作用。
根瘤菌產生AHLs可能參與其和宿主豆科植物形成有固氮活性共生體的過程中的信息交流[42]。祖慧琳等[43]分別采用3.0,6.0,9.0μmol/L AlCl3處理苜蓿根瘤菌1128后,其 AHLs的產生水平及胞外多糖的合成量顯著降低,進而抑制苜蓿根瘤菌1128對苜蓿幼根的根毛吸附,降低結瘤信號傳遞;另有研究表明,天山根瘤菌(Rhizobiumtianshanense)的群體感應突變株完全喪失了固氮結瘤能力[44];Gao等[45]的研究中,經過4 h的根系培養,華癸根瘤菌(Mesorhizobiumhuakuii)群體感應突變株僅有6×102依附在5條根系,同時約有7×105的野生型菌株附著,所以群體感應會影響根瘤菌與宿主植物根毛的識別依附,促進二者信號交流,從而影響根毛變形和共生結瘤。本試驗中通過補充Ca2+、P,使得酸鋁脅迫下苜蓿根瘤菌91522 AHLs的產生水平顯著提高。大量研究認為酰基高絲氨酸內酯(AHL)介導的群體感應(quorum sensing)不僅能調節根瘤菌自身的數目[20],還能影響根瘤菌胞外多糖的產生、根瘤菌與豆科植物的結瘤效率甚至共生體的建成[46]。因此,在酸性土壤中,通過施加Ca2+、P修復土著根瘤菌群體感應系統,能夠提高紫花苜蓿與土著根瘤菌的共生固氮能力,為紫花苜蓿在酸性土壤上良好結瘤提供了保障。
在利用植物改良土壤的研究中,苜蓿良好的共生固氮能力能夠促進土壤有機質及全氮在耕層的累積[47]。酸性土壤中紫花苜蓿共生結瘤受到抑制,從而限制紫花苜蓿在酸性土壤改良中的應用。通過施加鈣磷,根瘤菌自體誘導物的分泌量增加,促進其與宿主植物特異性識別依附過程,改善根瘤菌與宿主植物間的信號交流過程,最終促進結瘤。本研究中5,10 mmol/L Ca2+對苜蓿結瘤修復效果顯著,而在此基礎上補充4μmol/L P可進一步促進結瘤,而30μmol/L P則有一定抑制作用,可見在實際應用中合理的配施才能發揮良好的作用。影響苜蓿-根瘤菌高效共生的因素非常多,是復雜的綜合效應[48],有許多基礎性問題,如酸性土壤中耐酸根瘤菌的存活、遷移、對苜蓿根系信號物質的感知以及群體感應物質在酸性土壤中的作用等,均需要更深入的研究。而且,施用鈣磷對酸鋁脅迫后苜蓿-根瘤菌共生體系形成的恢復效果在實際生產環境如何尚待通過酸性土壤大田試驗進一步驗證。
4 結論
本研究探討了酸鋁處理苜蓿幼苗及其根瘤菌1周后,施加Ca2+、P對紫花苜蓿-根瘤菌結瘤固氮性能和群體感應的修復/恢復作用。結果表明,在受酸鋁毒害后,Ca2+對紫花苜蓿-根瘤菌結瘤過程有顯著的修復效應,補充5,10 mmol/L Ca2+條件下,根瘤菌群體感應、根瘤固氮酶活性有顯著的提高;4μmol/L P素營養與Ca2+的上述促進作用有交互效應,而且該交互效應導致苜蓿現瘤時間較未經修復處理的提前14 d,結瘤總數提高了247.09%,結瘤率可達到90%,使根毛變形率由無鈣磷處理的3.33%提高到28.89%。Ca2+、P對結瘤動力學曲線影響主要體現在Ca2+對同期結瘤數有顯著修復效果,并且這種修復從開始結瘤起就非常明顯,P素對結瘤數影響在Ca2+5 mmol/L條件下較顯著;Ca2+對固氮酶活性有顯著提高作用,但高濃度Ca2+(10 mmol/L)效果不如低濃度(5 mmol/L),同時4μmol/L P濃度可以進一步提高固氮酶活性。補充Ca2+、P能夠顯著提高酸鋁脅迫下根瘤菌AHLs分泌量,即提高了根瘤菌的群體感應水平,可能是Ca2+、P對紫花苜蓿-根瘤菌結瘤過程有顯著的修復效應的內在機理之一。
因此,在酸性鋁毒環境下,施入適當鈣、磷營養,能夠修復脅迫對苜蓿植物及其根瘤菌體系的負面影響,極大地恢復紫花苜蓿-根瘤菌結瘤固氮性能,提高紫花苜蓿在酸鋁脅迫條件下生長能力。
[1] Edwards D G,Sharifuddin H A H,Yusoff M N M,etal.The Management of Soil acidity for Sustainable Crop Production[M].Dordrecht:Kluwer Academic Publishers,1991:383-396.
[2] 楊昂,孫波,趙其國.中國酸雨的分布、成因及其對土壤環境的影響[J].土壤,1999,1:13-18.
[3] Ma J F,Furukawa J.Recent progress in the research of external Al detoxification in higher plants:a mini review[J].Journal of Inorganic Biochemistry,2003,97:46-51.
[4] 黃璽,李春杰,南志標.紫花苜蓿與醉馬草的競爭效應[J].草業學報,2012,21(1):59-65.
[5] 李劍峰,師尚禮,張淑卿.環境酸度對紫花苜蓿早期生長和生理的影響[J].草業學報,2010,19(2):47-54.
[6] 楊野,王偉,劉輝,等.鋁脅迫對不同耐鋁小麥品種根伸長生長影響的研究[J].植物營養與肥料學報,2010,16(3):584-590.
[7] 周楠,劉鵬,徐根娣,等.四種常見雜草根系及根邊緣細胞對鋁脅迫的響應[J].生態學報,2009,29(12):6512-6518.
[8] Tam’s L,Huttov J,Mistrik I.Inhibition of Al-induced root elongation and enhancement of Al-induced peroxidase activity in Al-sensitive and Al-resistance barley cultivars are positively correlated[J].Plant &Soil,2003,250:193-200.
[9] 閻君,于力,陳靜波,等.假儉草鋁耐性和敏感種源在酸鋁土上的生長差異及生理響應[J].草業學報,2010,19(2):39-46.
[10] Se F,Glenn A R,Dilworth M J.The interaction between aluminum and rood nodule bacteria[J].Soil Biology &Biochemistry,1993,25:403-417.
[11] Graham P H,Vance C P.Nitrogen fixation in perspective:an overview of research and extension needs[J].Field Crops Research,2000,65:93-106.
[12] 應小芳,劉鵬,徐根娣.土壤中的鋁及其植物效應的研究進展[J].生態環境,2003,12(2):237-239.
[13] 羅虹,劉鵬,李淑.硅、鈣對水土保持植物蕎麥鋁毒的緩解效應[J].水土保持學報,2005,19(3):101-104.
[14] 張琴,張磊,魏世清,等.鈣離子對紫花苜蓿及苜蓿根瘤菌耐酸能力的影響[J].應用生態學報,2007,18(6):1231-1236.
[15] 胡紅青,黃巧云,李學垣,等.磷礦粉緩解酸性土壤鋁毒的研究[J].中國農業科學,1995,28(2):51-57.
[16] Bassler B L.Small talk:Cell-to-cell communication in bacteria[J].Cell,2002,109:421-424.
[17] Daniels R,De Vos D E,Desair J,etal.The cin quorum sensing locus ofRhizobiumetliCNPAF512 affects growth and symbiotic nitrogen fixation[J].Biologicalogy Chemistry,2002,277:462-468.
[18] Broughton W J,Jabbouri S,Perret X.Keys to symbiotic harmony[J].Bacteriology,2000,182:5641-5652.
[19] Perret X,Staehelin C,Broughton W J.Molecular basis of symbiotic promiscuity[J].Microbiology and Molecular Biology Reviews,2000,64:180-201.
[20] Gonzalez J E,Marketon M M.Quorum sensing in nitrogen-fixing rhizobia[J].Microbiology and Molecular Biology Reviews,2003,67:574-592.
[21] Rodelas B,Lithgow J K,Wisniewski-Dye F,etal.Analysis of quorum-sensing-dependent control of rhizosphere-expressed(rhi)genes inRhizobiumleguminosarumbiovar viciae[J].Journal of Bacteriology,1999,181:3816-3823.
[22] Marketon M M,Glenn S A,Eberhard A,etal.Quorum sensing controls exopolysaccharide production inSinorhizobiummeliloti[J].Journal of Bacteriology,1995,185:325-331.
[23] 羅獻寶,黎曉峰,沈方科,等.苜蓿初生根的鋁脅迫與鈣對鋁脅迫的緩解作用[J].廣西農業生物科學,2006,25(3):243-247.
[24] 楊敏,黎曉峰,玉永雄,等.鋁對苜蓿生長、結瘤及根毛變形的影響[J].農業環境科學學報,2007,26(1):202-206.
[25] 張琴,龍娟,張磊,等.不同p H值下接種根瘤菌對紫花苜蓿產量和品質的影響[J].草業學報,2006,15(5):59-62.
[26] 韓華君,張磊,謝德體,等.耐酸苜蓿根瘤菌在酸性土壤中的定殖研究[J].西南農業大學學報(自然科學版),2006,28(5):722-726.
[27] 張學軍,張磊,張琴,等.苜蓿中華根瘤菌(Sinorhizobiummeliloti)的耐酸性研究[J].西南大學學報(自然科學版),2008,30(1):91-97.
[28] 李阜棣,喻子牛,何紹江.農業微生物學實驗技術[M].北京:中國農業出版社,1996:96.
[29] Zhu J,Chai Y R,Zhong Z T,etal.Agrobacteriumbioassay strain for ultrasensitive detection of N-acylhomoserine lactonetype quorum-sensing molecules:detection of autoinducers inMesorhizobiumhuakuii[J].Applied and Environmental Microbiology,2003,69:6949-6953.
[30] 張國霞,茅慶,何忠義,等.陵水普通野生稻(Oryzarufipogon)內生菌的固氮及溶磷特性[J].應用與環境生物學報,2006,12(4):457-460.
[31] Felle H H,Kondorosi E,Kondorosi A,etal.The role of ion fluxes in nod factor signalling inMedicagosativa[J].Plant,1998,13:455-463.
[32] Dorothe′e C,Jean L P,Mireille C,etal.Pharmacological evidence that multiple phospholipid signaling pathways link rhizobium nodulation factor perception inMedicagotruncatularoot hairs to intracellular responses,including Ca2+spiking and specificENODgene expression[J].Plant Physiology,2004,126:3582-3593.
[33] 任立飛,張文浩,李衍素.低磷脅迫對黃花苜蓿生理特性的影響[J].草業學報,2012,21(3):242-249.
[34] Israel D W.Sym biotic dinitrogen fixation and host-plant growth during development of and recovery from phosphorus deficiency[J].Physiologia Plantarum,1993,88:294-300.
[35] Drevon J J,Hartwig U A.Phosphorus deficiency increased the argon-induced decline of nodule nitrogen a se activity in soybean and alfalfa[J].Planta,1997,201:463-469.
[36] Almeida J P F,Hartwig U A,Frehner M,etal.Evidence that P deficiency induces feedback regulation of symbiotic N2fixation in white cloverTrifoliumrepensL.[J].Journal of Experimental Botany,2000,51:1289-1297.
[37] Hellsten A,Huss Danell K.Interaction effects of nitrogen and phosphorus on nodulation in red clover(TrifoliumpratenseL.)[J].Acta Agriculture Scandinavica,Section B,Soil and Plant Science,2001,50:135-142.
[38] 苗淑杰,喬云發,韓曉增.磷和根瘤菌交互作用對大豆結瘤和生長的影響[J].大豆科學,2009,28(2):271-274.
[39] Soto M J,Van D P,Martfnez A F,etal.Attachment to plant roots and nod gene expression are not affected by p H or calci-um in the acid-tolerant a1falfa-nodulating bacteriaRhizobiumsp.LPU83[J].FEMS Microbiology Ecology,2004,48:71-77.
[40] 王樹起,韓曉增,喬云發,等.缺磷脅迫對大豆根瘤生長和結瘤固氮的影響[J].大豆科學,2009,28(6):1000-1003.
[41] Tang C,Hinsinger P,Drevon J J,etal.Phosphorus deficiency impairs early nodule functioning and enhances proton release in roots ofMedicagotruncatulaL[J].Annals of Botany,2001,88:131-138.
[42] Li J Y,Wang R C,Xia S Q.Quorum sensing system and its application in water treatment with biofilm[J].Chinese Journal of Applied &Environmental Biology,2008,14(1):138-142.
[43] 祖慧琳,朱敏敏,李永春,等.酸性土壤中豆科植物根際微生物群體感應的初步研究[A].江蘇省遺傳學會第八屆會員代表大會暨學術研討會論文集[C].南京:《中國學術期刊(光盤版)》電子雜志社,2010.
[44] Zheng H M,Zhong Z T,Lai X,etal.A Lux R/LuxI-type quorum-sensing system in a plant bacterium,Mesorhizobiumtianshanense,controls symbiotic nodulation[J].Bacteriology,2006,188:1943-1949.
[45] Gao Y J,Zhong Z T,Sun K J,etal.The quorum-sensing system in a plant bacteriumMesorhizobiumhuakuiiaffects growth rate and symbiotic nodulation[J].Plant and Soil,2006,286:53-60.
[46] Redfield R J.Is quorum sensing a side effect of diffusion sensing[J].Trends Microbiology,2002,10:365-370.
[47] 馬其東,高振生,洪紱曾,等.黃河三角洲地區苜蓿生態適應性研究[J].草地學報,1999,7(1):28-38.
[48] Sultan A K,Gintzburger A G,Obaton B M.Growth and nitrogen fixation of annual medicago-rhizobium associations during winter inMediterraneanregion[J].European Journal of Agronomy,2001,15:221-229.

