鈍葉瓦松帶芽葉片的組織培養和快速繁殖
張彥妮,韓榮娜
(東北林業大學園林學院,黑龍江 哈爾濱 150040)
鈍葉瓦松(Orostachysmalacophyllus)[1]為景天科瓦松屬的二年生肉質草本植物。在我國東北、華北、內蒙古等地區均有分布,朝鮮、日本也有分布[2]。鈍葉瓦松系旱生植物,在內蒙古典型草原和草甸草原地區,為常見的伴生種,生于礫石性山坡或沙礫質土壤。全草皆可入藥,有止血通經之功效[3]。鈍葉瓦松第1年僅有蓮座葉,第2年抽莖[4]。葉片呈蓮座狀密集排列,總狀花序,花期在夏秋季節,開白色或者白綠色小花[5]。可作為花壇花卉植于山坡、巖石園或屋頂,是一種頗具開發價值的野生花卉。迄今為止,對景天科瓦松屬植物的組織培養研究較少,曲偉紅和趙建國[6]對瓦松愈傷組織的誘導進行了研究,而對于鈍葉瓦松組織培養方面尚未見報道。由于野生資源有限,為了快速繁殖出大量的鈍葉瓦松植株,本試驗以帶芽葉片為材料,進行組織培養研究,以期為鈍葉瓦松大量繁殖提供新的有效途徑,為優良種質資源保存、野生資源的保護以及鈍葉瓦松可持續開發利用的實現提供理論依據。
1 材料與方法
1.1試驗材料 鈍葉瓦松的植株由東北林業大學園林學院花圃提供。選取健康的鈍葉瓦松帶芽葉片為外植體。
1.2試驗方法
1.2.1帶芽葉片消毒時間的篩選 參照程林梅等[7]方法,將采集的鈍葉瓦松帶芽葉片用洗衣粉水浸泡10 min,在流水下沖洗1~2 h后,放入超凈工作臺,用75%的乙醇溶液消毒15~30 s,再用無菌水沖洗2次,再用0.1%的升汞(HgCl2)溶液分別消毒3、5、7、9、11 min,中間不斷晃動,然后用無菌水沖洗5~6次,無菌濾紙吸干外植體表面的水分,用消毒過的小刀將帶有腋芽的葉片切成大小約為0.5~1.0 cm的小塊,接種到MS培養基上。每個處理30個外植體,重復3次。2周后分別統計不同消毒時間的污染率、啟動率和死亡率。篩選出外植體最佳的消毒時間。本試驗培養基pH值均調至5.8~6.0,高壓滅菌(1.1 MPa,121 ℃)15 min。培養室培養溫度為(25±2)℃,光照強度為1 500~2 000 lx,光照時間為16 h·d-1。
1.2.2鈍葉瓦松帶芽葉片的啟動培養 將消毒后的帶芽葉片接種到添加不同質量濃度6-BA(1.0、2.0和3.0 mg·L-1)、NAA(0.1、0.3和0.5 mg·L-1)的MS培養基上,試驗采取二因素三水平的正交試驗設計,每處理接種30個外植體,30 d后統計鈍葉瓦松帶芽葉片的啟動率、出芽指數和出愈率。出芽指數等于發生芽的外植體上出芽數的平均數。
1.2.3腋芽的增殖培養 初代培養得到的腋芽,剪下后接種增殖培養基上進行叢芽的誘導,試驗采用三因素三水平的正交試驗設計,每處理接種30個外植體,30 d后統計腋芽的增殖倍數。
1.2.4組培苗的生根誘導 將高3 cm左右、未生根的組培苗轉至1/2MS +NAA(0.1、0.3 mg·L-1)培養基上進行生根誘導。20 d后分別統計生根率、根長及生根情況。
1.2.5無菌苗的移栽 選取高3 cm左右、根系健壯的鈍葉瓦松無菌生根苗進行移栽。用鑷子小心的取出生根苗,自來水沖洗掉根上附著的培養基,移栽到事先準備好的基質中,澆適量水,放置在通風良好、濕度較大、光照充足的環境下進行培養,觀察幼苗生長情況,30 d后統計移栽成活率,篩選出適宜的移栽基質。
1.3數據分析 數據采用EXCLE、SPSS 17.0軟件進行方差分析及多重比較分析(Duncan’s法)。
2 結果
2.1鈍葉瓦松帶芽葉片消毒時間的篩選 隨著0.1% HgCl2處理時間的延長,鈍葉瓦松葉片的污染率逐漸遞減,啟動率呈先升后降的趨勢(表1),而死亡率卻逐漸增加,可見,HgCl2消毒效果雖然較好,但對外植體的活化等方面影響很大,如果消毒時間過長,就會在殺死外植體表面微生物的同時對植物細胞也造成損傷,導致外植體死亡率的增加,從而影響到外植體愈傷組織的誘導。0.1%HgCl2處理5 min污染率和死亡率均較低,方差分析結果顯示,0.1%HgCl2處理5 min污染率與其他滅菌時間相比差異顯著,且啟動率最高,為56.67%,有利于帶芽葉片的啟動培養。說明0.1%HgCl2處理5 min最適合鈍葉瓦松帶芽葉片的消毒。
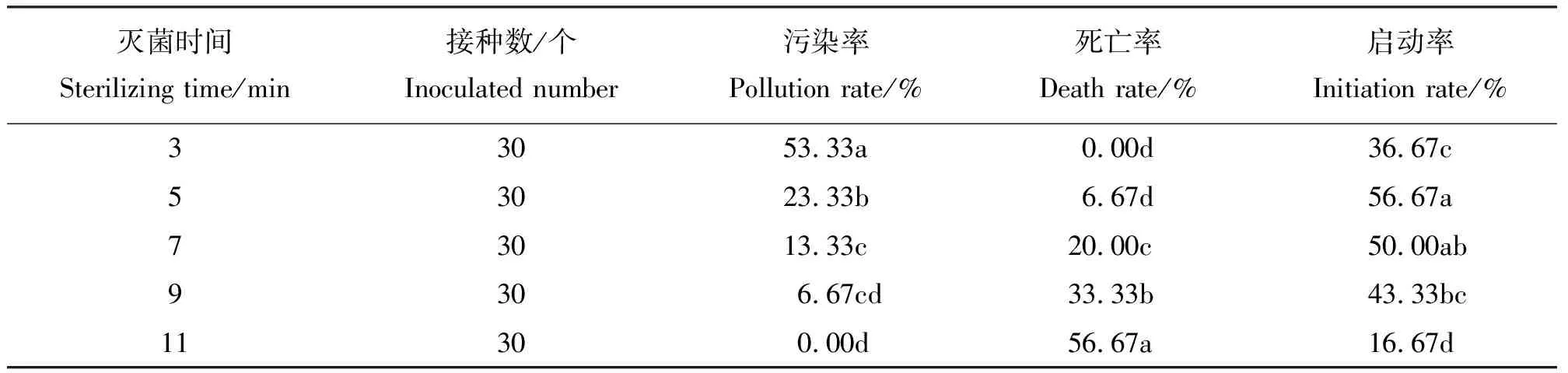
表1 不同滅菌時間對外植體消毒效果的影響及方差分析結果
2.2鈍葉瓦松帶芽葉片的啟動培養 將帶芽鈍葉瓦松葉片接種到不同激素組合的培養基上4 d左右,腋芽開始萌動,10 d左右差異并不顯著,有些腋芽基部開始產生愈傷組織經繼代后會分化出根和不定芽(圖1)。其中在A1、A3、A6和A9培養基上腋芽的萌發率均較高,但A1和A9腋芽長勢一般,A3、A6出芽指數相對較高且腋芽長勢較好(表2),可見高質量濃度的6-BA有利于鈍葉瓦松腋芽的萌發與生長,而高質量濃度的NAA(超過0.1 mg·L-1)對于鈍葉瓦松腋芽生長有抑制作用。因此高質量濃度的6-BA(3.0 mg·L-1)和低質量濃度的NAA(0.1 mg·L-1)組合是鈍葉瓦松帶芽葉片啟動的最佳培養基。
2.3腋芽的增殖培養 不同質量濃度6-BA、NAA和 2,4-D的組合對于腋芽的增殖及苗的長勢影響相差很大。高質量濃度的6-BA(1.5 mg·L-1)和NAA(0.1~0.2 mg·L-1)組合使用有利于帶芽葉片腋芽的增殖,隨著6-BA質量濃度的升高,腋芽增殖倍數呈增加的趨勢,最高達5.35。方差分析表明,此組合與其他組合之間存在顯著差異,且苗長勢很好(圖2A)。但是當低質量濃度的6-BA(0.5 mg·L-1)或6-BA與2,4-D組合使用時,腋芽增殖倍數較小,芽苗長勢也較弱,可見在腋芽增殖時低質量濃度的6-BA 或6-BA+2,4-D對于鈍葉瓦松葉片腋芽的增殖有抑制作用(表3)。因此最適宜帶芽葉片腋芽增殖的培養基為MS+6-BA 1.5 mg·L-1+NAA 0.2 mg·L-1。
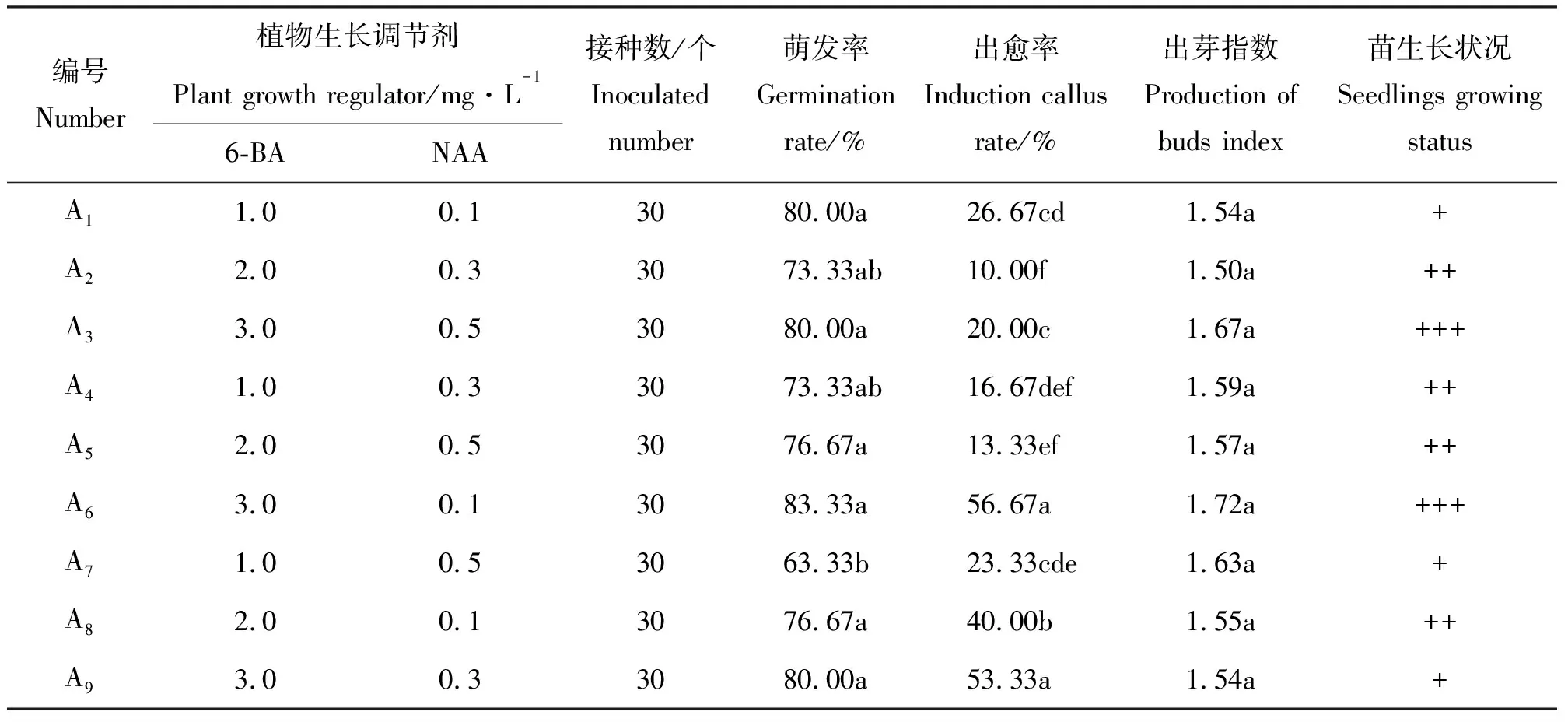
表2 帶芽葉片的啟動培養結果
2.4組培苗的生根誘導 叢生芽中未生根的苗高3 cm左右時,繼代到附加不同質量濃度NAA(0.1~0.3 mg·L-1)的1/2MS培養基中進行生根誘導。試驗中發現鈍葉瓦松無菌苗較易生根,在接種后4 d左右開始生根,20 d后統計結果,大部分苗已經生根,且生根率均在75%以上,其中,C3培養基的生根率最高,達96.67%,且平均誘導出14條根(表4),從方差分析可以看出,C3培養基的生根率與C1、C2培養基之間存在顯著差異,且誘導出的根較粗狀數量較多(圖2B)。因此鈍葉瓦松最適生根培養基為:1/2MS+NAA 0.3 mg·L-1。
2.5組培苗的移栽 選擇生根良好的鈍葉瓦松生根苗移栽到不同的基質中,30 d后統計不同移栽基質的移栽成活率。基質珍珠巖∶蛭石∶田間土(1∶1∶1)的移栽成活率最高,達76.67%(表5),與另外3種基質的成活率之間存在顯著差異,且苗的長勢較好(圖2C)。

圖1 愈傷組織增殖(A)和分化(B)

表3 帶芽葉片不定芽的增殖培養

圖2 鈍葉瓦松帶芽葉片腋芽的增殖(A)、生根誘導(B)及移栽(C)

表4 生根試驗結果

表5 不同栽培基質對組培苗移栽成活率的影響
3 討論與結論
關于景天科植物組織培養方面的試驗研究已有很多的報道[8-10],國內外有關瓦松屬植物的研究報道更多是圍繞藥理及分子方面[11-12],關于組培方面的報道卻很少。本試驗以鈍葉瓦松帶芽葉片為外植體,經過多次試驗研究,初步建立了組織培養再生體系,短期內獲得了大量的鈍葉瓦松的完整植株。
在鈍葉瓦松帶芽葉片的培養中,用0.1%升汞對外植體消毒5 min污染率較低且啟動率較高,滅菌效果最好。在帶芽葉片的啟動試驗中發現:帶芽葉片接種4 d左右,腋芽開始萌動,10 d左右葉片展開;另外試驗中發現激素種類和濃度對于葉片腋芽啟動培養有一定的影響,結果表明,高質量濃度的6-BA(3.0 mg·L-1)和低質量濃度的NAA(0.1 mg·L-1)組合使用腋芽萌發率最高,最適宜鈍葉瓦松帶芽葉片的啟動培養。有些腋芽在培養10 d左右,基部會產生黃綠色或綠色顆粒狀的愈傷組織,結構致密但易碎,經過繼代后會分化出根和不定芽,初步認定為胚性愈傷組織[13-15]。因此,有關葉片腋芽基部產生的是否為胚性愈傷組織以及進一步提高胚性愈傷組織的誘導率尚待進一步深入研究。
植物生長調節劑在組織培養的過程中有著重要的作用[16]。不同的激素組合對于腋芽增殖的效果各不相同[17]。對鈍葉瓦松來說,在培養基MS+6-BA 1.50 mg·L-1+NAA 0.2 mg·L-1上,腋芽增殖效果最好,增殖倍數為5.35,顯著高于其他組合的增殖倍數,苗的長勢也較好,因此是鈍葉瓦松帶芽葉片腋芽增殖的最佳培養基。在鈍葉瓦松組培苗的生根試驗中發現,NAA有利于促進鈍葉瓦松植株的生根,其生根的最適培養基為1/2MS+ NAA 0.3 mg·L-1,20 d后生根率高達96.67%,且根系粗壯、苗長勢較好。試驗苗移栽在基質珍珠巖∶蛭石∶田間土(1∶1∶1)中效果最好,成活率達到76.67%。
本試驗以鈍葉瓦松的帶芽葉片為外植體,首次成功的建立了組織培養再生體系,為組培苗的移栽、大面積的人工栽培及其工廠化生產提供了一定的理論基礎與科學依據,為鈍葉瓦松的可持續開發利用奠定了基礎。
[1]鄭萬金,張萍,仲英.瓦松屬植物的研究進展[J].齊魯藥事,2008,27(3):161-163.
[2]鄭艷,徐珞珊.中國瓦松屬(Orostachys)的藥用資源[J].中國中醫藥信息雜志,2003,10(11):41.
[3]國家藥典委員會.中國藥典,Ⅰ部[S].北京:化學工業出版社,2005:47.
[4]陳金法.瓦松的綜合利用[J].中國林副特產,2009,6:99-100.
[5]黃獻勝.奇趣的多肉花卉世界景天科瓦松屬[J].花木盆景,2002,10:63.
[6]曲偉紅,趙建國.瓦松愈傷組織誘導研究[J].時珍國醫國藥,2010,21(11):2832-2833.
[7]程林梅,高洪文,趙茂林.菊苣組織培養與植株再生的研究[J].草業學報,2002,11(4):105-107.
[8]劉海軍,郭斌,晏瓊,等.4種紅景天植物的組織培養研究[J].西北植物學報,2006,26(10):2023.
[9]胡挺松,馬蘭青,郭萬里,等.長鞭紅景天的組織培養和快速繁殖[J].植物生理學通訊,2004,40(3):335.
[10]白瑪玉珍,李寶海,次仁措姆.大花紅景天愈傷組織的誘導[J].西藏科技,2008,2:74.
[11]Jong C P,Won D H,Jeong R P,etal.Changes in hepatic drug metabolizing enzymes and lipid peroxidation by methanol extract and major compound ofOrostachysjaponicus[J].Journal of Ethnopharmacology,2005,102(3):313-318.
[12]Hyoung J K,Jun Y L,Sung M K,etal.A new epicatechin gallate and calpain inhibitory activity fromOrostachysjaponicus.Fitoterapia[J].Agricultural and Biological Sciences,2009,80(1):73-76.
[13]楊和平,程井辰.馬唐胚性與非胚性愈傷組織生理差異的初步研究[J].植物生理學通訊,1991,27(5):337-340.
[14]曲復寧,李麗霞,張敏,等.仙客來(CyclamenpersicumMill)胚性愈傷形態和組織結構的動態觀察[J].煙臺大學學報,2003,16(1):54-59.
[15]齊力旺,李玲,韓一凡,等.落葉松不同類型胚性和非胚性愈傷組織的生理生化差異[J].林業科學,2001,37(3):21-29.
[16]趙麗君,王雪芳,張金林,等.植物組織培養及其在草類植物中的研究和應用[J].草業科學,2011,28(6):1140-1148.
[17]張彥妮,邊紅琳,陳立新.蝴蝶蘭幼嫩花梗組織培養和快速繁殖[J].草業科學,2011,28(4):590-596.

