PEG模擬干旱脅迫對玉帶草生理特性的影響
劉曉東,李洋洋,何 淼
(東北林業大學園林學院,黑龍江 哈爾濱 150040)
近年來,隨著節約型社會的建設,可持續型園林的興起,觀賞草因具有實用性廣、管護成本低、莖稈姿態優美、色彩豐富等特點,越來越受到人們的關注,在國內外景觀設計和建設中日益受到青睞。因此對觀賞草的研究日益增多,但大多數研究主要集中在其觀賞特性和園林應用上[1-4],關于其抗逆的研究相對較少,對其耐旱性的研究更為少見,且在品種上有一定的局限性[5-7]。同時,東北地區草的應用品種和研究比南方的要少,因此加大北方觀賞草的研究、應用和推廣具有重大意義。
玉帶草[8-9](Phalarisarundinaceacv.Picta)為禾本科虉草屬多年生草本,分布于我國東北、華北、華中及歐洲和北美洲部分地區。生性喜光耐寒;植株高30~50 cm,具匍匐莖,葉扁平、線性;葉面綠色間有白色或黃綠色條紋,質地光滑、飄逸,形似玉帶,圓錐花序,分株繁殖。可植于花鏡草坪邊緣,山坡或路邊,是北方較優良的觀賞地被植物。目前對玉帶草的抗逆性研究還未見報道,僅見楊立賓和陳之歡[10]對玉帶草的營養解剖器官進行研究,其結果推測玉帶草是一種既抗旱又耐澇的植物。
研究植物抗旱性的方法有模擬滲透脅迫和土壤干旱。但土壤干旱研究過程中常被一些客觀因素所困擾:一是土壤的組分非常復雜,作為試驗系統常難以控制;二是有時難以將滲透脅迫效應與土壤系統中的其他脅迫效應有效區分開。因此,人們都在試圖找到一種能取代控制水分的辦法以模擬干旱逆境,而采用滲透調節劑模擬干旱就是其中一類。聚乙二醇6000(PEG-6000,以下簡稱PEG)是一種親水性很強的惰性高分子聚合物,近幾十年作為理想的滲透調節劑被廣泛應用于模擬干旱脅迫。研究表明[11-13],PEG能模擬干旱脅迫的原因是其可阻塞植物的輸導組織,且其模擬干旱脅迫與土壤控水的結果相同。本研究通過觀察和測定不同質量濃度的PEG模擬干旱脅迫下玉帶草形態及生理指標的動態變化,分析玉帶草對干旱的生理反應,對其耐旱性進行評價,旨為其在園林中的推廣應用提供理論基礎和依據。
1 材料與方法
1.1試驗材料 供試材料于2010年11月引種于遼寧省錦州市義縣北方苗木公司,栽種于哈爾濱東北林業大學園林學院溫室,2011年1月選取長勢一致的苗進行分株,栽種于直徑20 cm的盆中,培養土為黑土∶沙子∶松針土=2∶2∶1。2011年5月選取高度相同,長勢一致的單株,平均分成4組,每組30盆,每組3個重復。
1.2試驗方法 2011年5月20日將玉帶草從土壤中取出,避免損傷根系,并用清水沖洗干凈根系,移植到1/2 Hoagland’s營養液平衡培養3 d后,將其移入不同質量濃度的PEG溶液中(不同質量濃度的PEG溶液是用PEG溶解于1/2 Hoagland’s營養液中配制而成),對照(CK)為不加PEG的1/2 Hoagland’s營養液。PEG質量濃度設為100、200、300 g·L-1,分別為輕度脅迫、中度脅迫、重度脅迫,每個處理重復3次。放入培養箱中,培養條件為白天16 h,25 ℃,夜間8 h,15 ℃,分別于0、8、16、24和32 h取樣測定各項指標。
1.3測定項目及方法 枯葉率[6]為50%面積出現干枯癥狀的葉片數占總葉片數的百分比。
葉片相對含水量(RWC)采取烘干法測定[14];細胞質膜透性采用電導法[14]測定相對電導率(REC);丙二醛(MDA)含量采用硫代巴比妥酸法[15]測定;游離脯氨酸(Pro)含量采用茚三酮比色法[14]測定;可溶性蛋白含量采用考馬斯亮藍G-250染色法[15]測定;超氧物歧化酶(SOD)活性采用氮藍四唑法測定[16];過氧化物酶(POD)活性采用愈創木酚法測定[16]。
1.4數據處理 試驗所得數據使用Excel 2003和SPSS 17.0進行處理和分析。
2 結果與分析
2.1干旱脅迫對玉帶草枯葉率的影響 在干旱脅迫中玉帶草葉片出現干枯癥狀的順序為較幼小苗早于較強壯苗;同一植株下部葉片先于上部葉片。300 g·L-1脅迫的枯葉率隨脅迫時間的延長呈上升趨勢,8~24 h增幅最大,在32 h時枯葉率達到100%(圖1)。100和200 g·L-1脅迫下在16 h時枯葉率有小幅上升,之后保持平穩,且200 g·L-1脅迫下的枯葉率略高于100 g·L-1脅迫下的。200 g·L-1脅迫下在32 h時約70%玉帶草葉片葉尖2 cm左右出現萎蔫,但枯葉率為16%(圖2)。
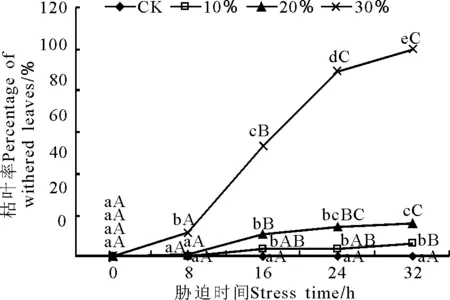
圖1 不同質量濃度PEG脅迫處理對玉帶草枯葉率的影響

圖2 玉帶草受不同質量濃度PEG脅迫處理32 h后的形態比較
2.2干旱脅迫對玉帶草生理指標的影響
2.2.1干旱脅迫對玉帶草葉片相對含水量的影響 PEG質量濃度為100 g·L-1時,玉帶草的RWC與對照之間無顯著差異(P>0.05)(圖3);為200 g·L-1時,RWC在8 h時與對照無顯著差異,脅迫8~16 h時出現顯著下降(P<0.05),24和32 h時保持穩定,與16 h時無顯著性差異;300 g·L-1時,RWC隨脅迫時間的延長呈下降趨勢,且均極顯著(P<0.01)低于對照,在32 h時達到最低值,僅為27.67%。
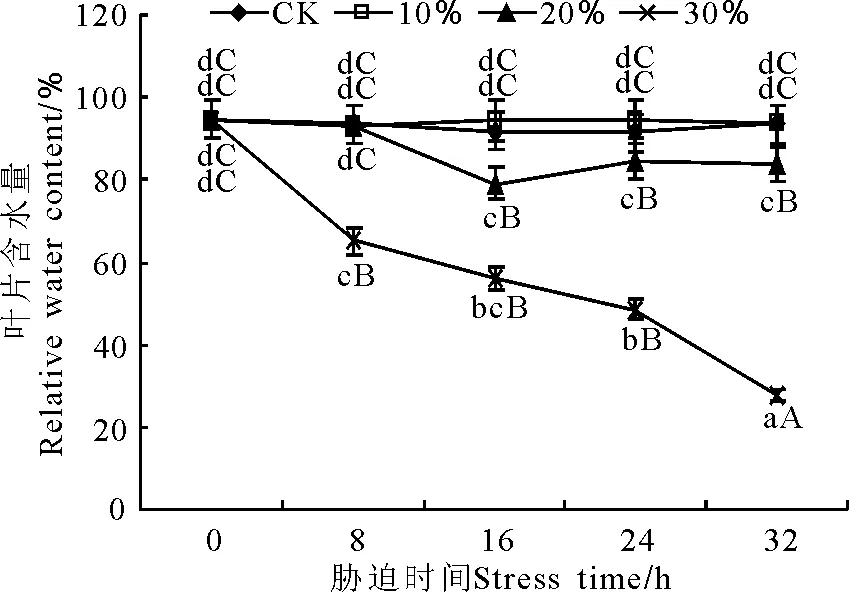
圖3 PEG脅迫處理對玉帶草葉片相對含水量的影響
2.2.2干旱脅迫對玉帶草質膜透性和丙二醛含量的影響 3個不同PEG質量濃度脅迫下玉帶草葉片的相對電導率均隨脅迫時間的延長而有所上升,上升幅度隨PEG質量濃度的增大而增大。100和200 g·L-1脅迫下在16 h時的葉片相對電導率與對照的存在顯著差異(P<0.05),之后保持相對平穩(圖4)。這表明,在短時間內輕度脅迫、中度脅迫沒有對細胞膜透性造成影響,但隨時間的延長,細胞膜透性受到一定的傷害。PEG質量濃度為300 g·L-1的處理,從8 h開始葉片相對電導率呈上升趨勢,且極顯著(P<0.01)高于對照,在32 h時達到最大值(91.67%),是對照的1.97倍。由此可見,重度脅迫下,細胞膜透性短時間內就受到嚴重傷害,隨脅迫時間的延長而逐漸加重。
不同質量濃度PEG脅迫下,MDA含量變化不同(圖5)。100 g·L-1脅迫下MDA含量和對照之間無顯著差異(P>0.05);200 g·L-1脅迫下在8 h內MDA含量沒有變化,16 h時顯著增加之后保持穩定;30%脅迫下MDA含量8 h內有顯著升高,但幅度不大,之后呈大幅度上升,在16、24和32 h時MDA含量分別為對照的2.22、3.03和4.33倍。
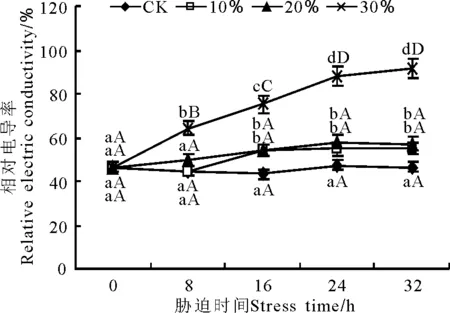
圖4 PEG脅迫處理對玉帶草葉片相對電導率的影響
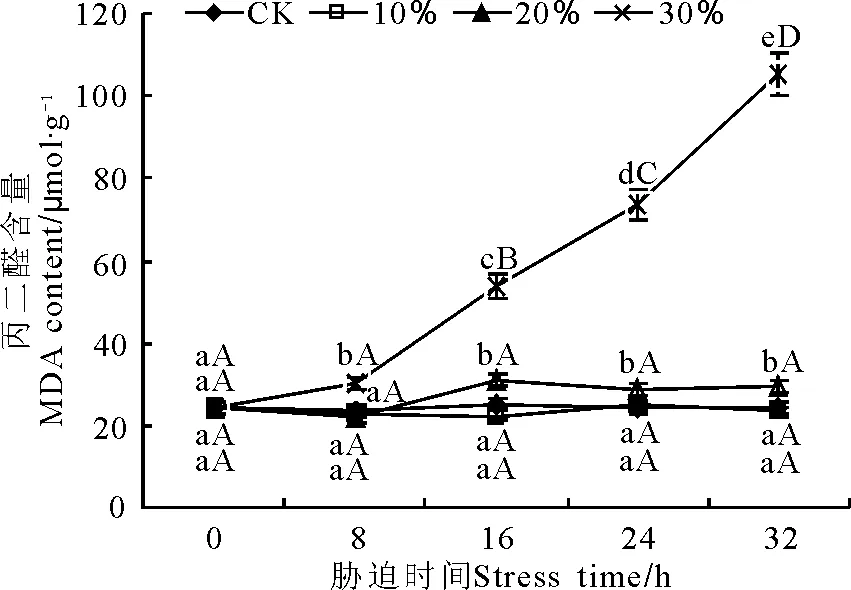
圖5 PEG脅迫處理對玉帶草葉片丙二醛含量的影響
2.2.3干旱脅迫對玉帶草滲透調節物質的影響 隨著PEG質量濃度的增大,Pro含量逐漸增加(圖6)。100 g·L-1脅迫下的Pro含量與對照間沒有顯著差異;200和300 g·L-1脅迫下在8 h時的Pro含量與對照間沒有顯著差異。200 g·L-1脅迫下16 h時Pro含量增加了0.54 mg·g-1,顯著(P<0.05)高于對照,之后保持穩定;300 g·L-1脅迫下16 h時Pro含量增加了3.71 mg·g-1,極顯著(P<0.01)高于對照,且隨脅迫時間的延長急劇增加,32 h時達到對照的79.67倍。
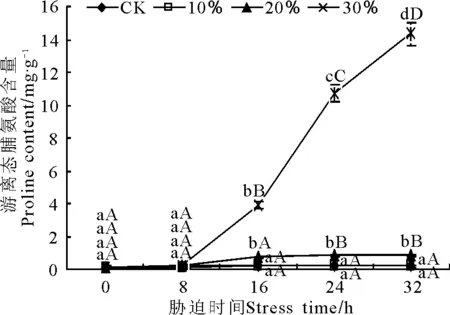
圖6 PEG脅迫處理對玉帶草葉片游離脯氨酸含量的影響
不同質量濃度PEG脅迫下,玉帶草葉片可溶性蛋白含量表現出不同的變化趨勢(圖7)。100和200 g·L-1脅迫下在不同脅迫時間的可溶性蛋白含量與對照相比均存在極顯著差異(P<0.01)。100 g·L-1脅迫下可溶性蛋白含量先降低后增高,在16 h時可溶性蛋白含量達到最低值,為3.28 mg·g-1;16~24 h時顯著上升,24~32 h保持穩定。20%處理在8 h時可溶性蛋白含量達到最低值,為4.13 mg·g-1,之后保持相對穩定。300 g·L-1脅迫下可溶性蛋白含量隨脅迫時間的延長而增加, 8 h時極顯著(P<0.01)高于對照,8~24 h之間雖有所增加但差異顯著,24~32 h極顯著增加,32 h時達到最大值為8.61 mg·g-1。
2.2.4干旱脅迫對玉帶草保護酶活性的影響 100 g·L-1脅迫下的SOD活性在8 h時略有升高,之后又恢復正常,與對照之間不存在顯著差異(圖8),說明100 g·L-1脅迫下SOD活性保持穩定且和對照之間沒有差異。在200 g·L-1脅迫下SOD活性呈逐漸上升趨勢,但是8~24 h均與對照沒有顯著差異,僅32 h時顯著(P<0.05)高于對照。300 g·L-1脅迫下在24 h內SOD活性呈極顯著上升,24 h時達到最大值,為174.72 U·g-1,之后呈極顯著下降,但32 h時的SOD活性仍極顯著(P<0.01)高于對照,為131.47 U·g-1。
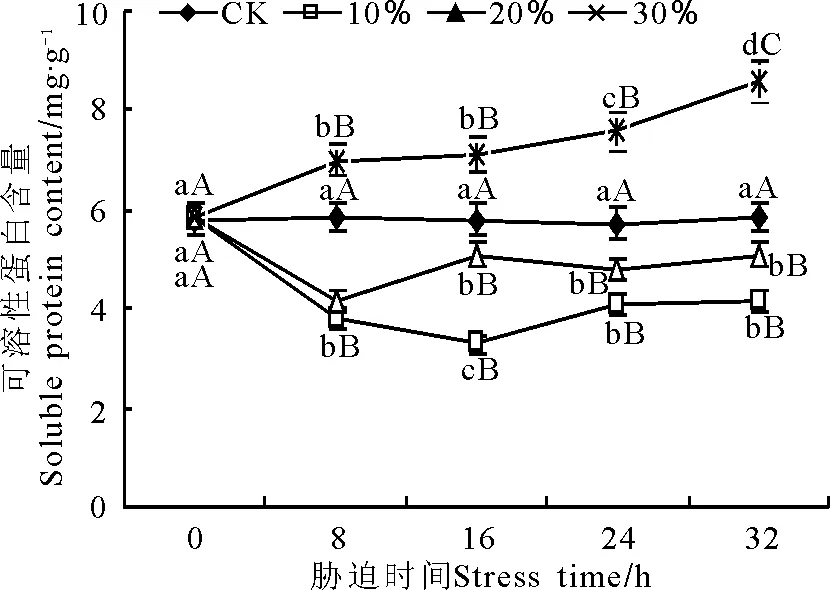
圖7 PEG脅迫處理對玉帶草葉片可溶性蛋白含量的影響
在100 g·L-1脅迫下,玉帶草的POD活性保持穩定,且在不同脅迫時間與對照之間沒有顯著差異(圖9)。200 g·L-1脅迫下, 0~24 h的POD活性之間沒有顯著差異,在32 h時顯著升高,比對照增加了30.70%,表明200 g·L-1脅迫下,短時間內POD活性基本穩定,長時間脅迫下會略有升高。300 g·L-1脅迫下的POD活性呈現先升后降的趨勢,在8~24 h時呈上升趨勢,極顯著(P<0.01)高于對照,24 h時POD活性達到最大值,為2 962 U·g-1·min-1,比對照增加了195.28%,24~32 h時POD活性大幅下降,32 h時為1 985 U·g-1·min-1,但仍極顯著高于對照。
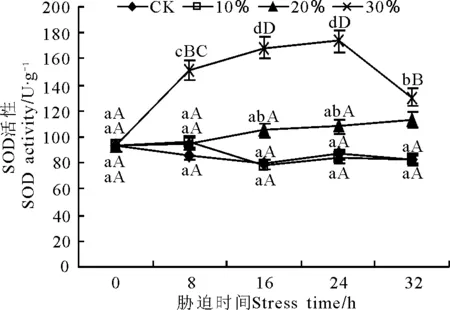
圖8 PEG脅迫處理對玉帶草葉片SOD酶活性的影響
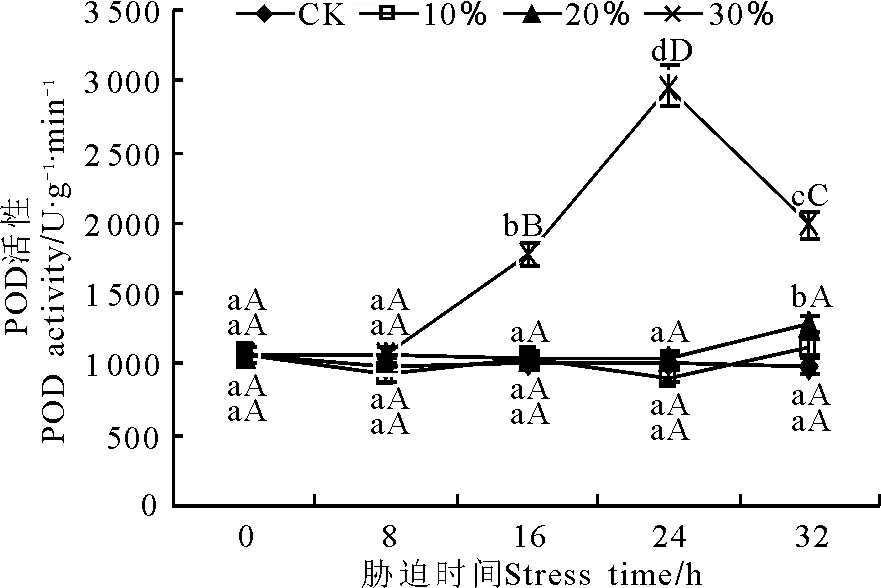
圖9 PEG脅迫處理對玉帶草葉片POD酶活性的影響
2.3干旱脅迫下玉帶草各個指標之間的相關性分析 PEG脅迫質量濃度與枯葉率、相對電導率和SOD活性呈極顯著正相關(P<0.01),與RWC呈極顯著負相關,與MDA含量、Pro含量和POD活性呈顯著正相關(P<0.05),與可溶性蛋白含量不相關(表1),說明隨脅迫質量濃度的增加,玉帶草受到的旱害程度加深。枯葉率與RWC呈極顯著負相關,與其他各生理指標呈顯著正相關,說明枯葉率作為玉帶草干旱脅迫的外部形態指標較好地反映了玉帶草的抗旱性。此外,除了葉片相對含水量與其他各指標呈極顯著負相關外,其余各項生理指標之間呈極顯著正相關。
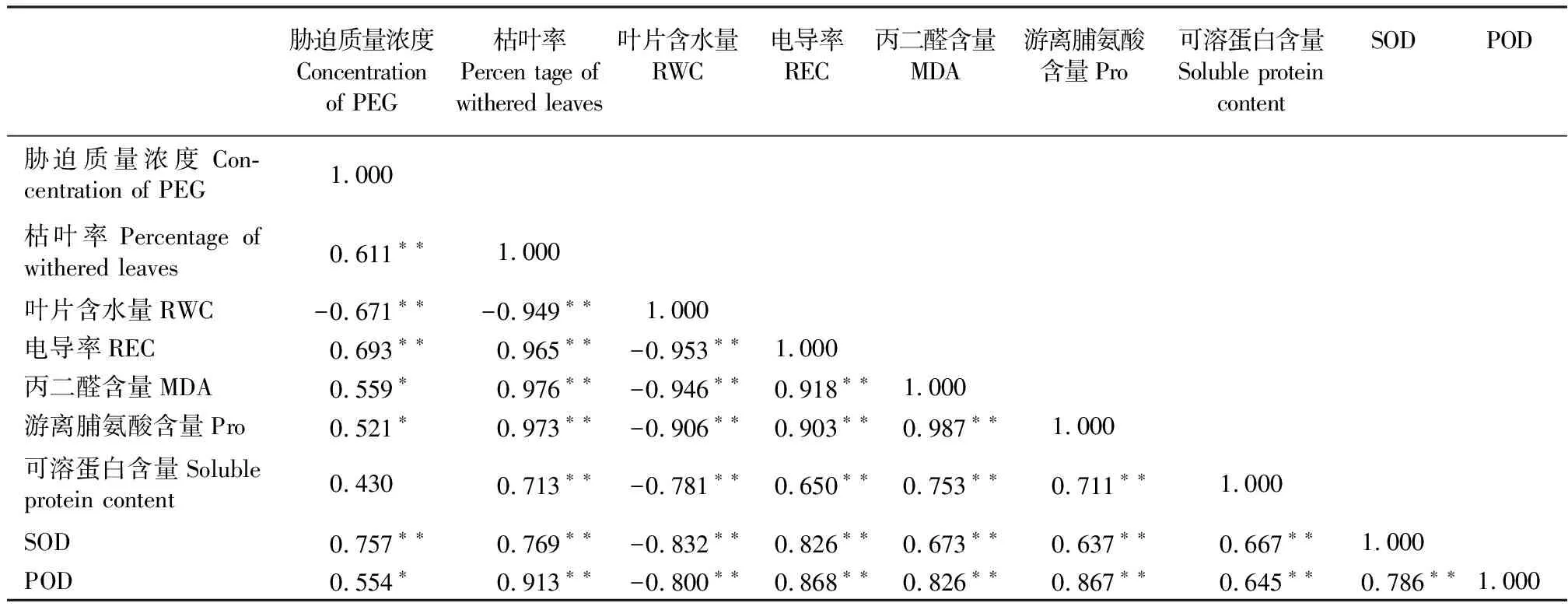
表1 PEG脅迫下玉帶草各指標之間的相關系數
3 討論
干旱脅迫下植物外部形態有明顯變化,受到直接影響的是葉片[17]。玉帶草作為觀賞性植物,其觀賞價值在園林應用中具有重要的影響,在干旱脅迫下的表現也應當給予考慮。因此本研究主要以玉帶草枯葉率作為外部形態指標,結果表明枯葉率能夠較好地反映出干旱脅迫對玉帶草的傷害程度。300 g·L-1脅迫32 h時玉帶草葉片全部萎蔫,完全喪失觀賞價值,此時對其進行復水,則葉片可以部分恢復正常,但大部分葉片的葉尖部分不能恢復正常狀態,說明此時的葉片雖受到嚴重旱害卻并未完全死亡,但可以預計隨著脅迫時間的延長,300 g·L-1脅迫下玉帶草葉片會逐漸死亡。玉帶草具有匍匐莖,其根狀莖是繁殖的主要材料,因此玉帶草葉片死亡的脅迫質量濃度并不代表玉帶草植株的致死干旱脅迫質量濃度。如果要確定玉帶草植株的致死脅迫質量濃度,需對玉帶草的根系進行研究。
植物在逆境條件下,細胞體內活性氧的不斷積累加速質膜過氧化的反應,引起丙二醛等有害物質的積累,嚴重損傷生物膜,導致細胞膜透性的增大和胞間物質的外滲,植物的相對電導率增大。所以質膜透性的大小是衡量膜結構和功能完整性的可靠指標[18],丙二醛含量是判斷細胞遭受脅迫程度大小的指標[19],且兩者呈顯著正相關關系[20]。本研究中,隨脅迫程度加深和脅迫時間延長,玉帶草的丙二醛含量和相對電導率逐漸增加,呈顯著正相關關系,說明干旱脅迫加劇了丙二醛等對細胞膜有害物質的積累,細胞膜受到損傷。
游離脯氨酸和可溶性蛋白等是植物體內的滲透調節物質,在干旱脅迫下細胞內滲透調節物質的增加,可以降低滲透勢,有利于植物在干旱條件下吸收水分,從而提高抗旱能力[21]。游離脯氨酸含量在一定程度上反映了植物遭受逆境的傷害情況及其對逆境的抵抗能力。在正常條件下,作物體內游離脯氨酸含量甚微(每克干質量0.20~0.69 mg),占游離氨基酸總量的百分之幾,但在受到干旱、鹽漬等滲透脅迫時,脯氨酸會大量積累,其含量甚至提高百倍以上[22]。本研究中,游離脯氨酸在不同質量濃度PEG的脅迫下均呈上升趨勢,重度脅迫下上升幅度很大,增強了玉帶草的抗旱性。而可溶性蛋白在100和200 g·L-1脅迫下先降后升,在300 g·L-1脅迫下呈上升趨勢,這與師進霖等[23]和劉丹等[24]的研究結果是一致的。這可能是在輕度和中度脅迫下,蛋白質的降解大于蛋白質的合成,從而使植株體內的總蛋白含量降低;在重度脅迫下,玉帶草體內迅速合成可溶性蛋白降低滲透勢以抵御脅迫造成的傷害。作為滲透調節物質的游離脯氨酸和可溶性蛋白在干旱脅迫下表現出不同的變化趨勢,可能是滲透脅迫物質所起的作用和調節機制存在一定的差異,其原因還有待于進一步研究。此外,研究[25-26]認為游離脯氨酸含量在一定程度上反映了植物受脅迫影響的程度與相對電導率和丙二醛之間呈顯著正相關關系,本研究的結果與之相一致。
4 結論
在干旱脅迫下玉帶草葉片的枯葉率、相對含水量、相對電導率、丙二醛含量和游離脯氨酸含量呈逐漸升高;可溶性蛋白含量呈先降后升;超氧化物歧化酶和過氧化物酶活性呈先升后降的變化趨勢。脅迫程度與枯葉率、相對電導率、丙二醛含量、可溶性蛋白含量、游離脯氨酸含量、超氧化物歧化酶和過氧化物酶活性呈正相關關系,與相對含水量呈負相關關系,且高質量濃度脅迫下各指標的變化幅度要大于低質量濃度脅迫下的。綜上所述,在適度的干旱條件下,玉帶草生長良好,具有一定的耐旱性,是優良的地被觀賞草本植物。
[1]宋希強,鐘云芳,張啟翔.淺析觀賞草在園林中的運用[J].中國園林,2004(3):32-36.
[2]武菊英.觀賞草及其在園林景觀中的應用[M].北京:中國林業出版社,2007:2-5.
[3]齊海鷹,安吉磊.淺談觀賞草在園林造景中的應用[J].現代園林,2007(7):63-67.
[4]Wolfe J,Zajicek J M.Are ornamental grasses acceptable alternatives for low maintenance landscapes[J].Journal of Environmental Horticulture,1998,16(1):8-11.
[5]孔蘭靜,彭衛東,柳玉芳,等.干旱脅迫對三種觀賞草葉片滲透調節的影響[J].中國草地學報,2010,32(3):82-87.
[6]張智,夏宜平,常樂,等.3種觀賞草在自然失水脅迫下的生理變化與耐旱性關系[J].東北林業大學學報,2007,35(12):17-20.
[7]Li K,Li H B,Zhao Y J,etal.Effects of NaCl stress on two blue fescue varieties (Festucaglauca)[J]. Frontiers of Agriculture in China,2010,4(1):96-100.
[8]劉延江,王洪力,曲素華.園林觀賞花卉應用[M].沈陽:遼寧科學技術出版社,2008:561.
[9]李作文,劉家禎.園林地被植物的選擇與應用[M].沈陽:遼寧科學技術出版社,2009:144.
[10]楊立賓,陳之歡.玉帶草營養器官解剖結構初探[J].黑龍江科技信息,2008(8):128.
[11]Atree S M,Fowke L C.Embryogeny of gymnosperms: advances in synthetic seed technology of conifers[J].Plant Cell,Tissue and Organ Culture,1993,35:1-35.
[12]Rawlor D W.Absorption of polyethylene glycol by plants and their effects on plant growth[J].New Phytologist,1970,69:501-513.
[13]Kaufmann M R,Eckard A N.Evaluation of water stress control with polyethylene glycol by analysis of guttation[J].Plant Physiology,1971,47:453-456.
[14]郝再彬,蒼晶,徐仲.植物生理實驗[M].哈爾濱:哈爾濱工業大學出版社,2004:22-108.
[15]李合生.植物生理生化實驗原理和技術[M].北京:高等教育出版社,2000:184-263.
[16]徐啟賀.蘋果砧木對干旱脅迫的生理響應及抗旱性評價[D].北京:中國農業科學院,2010:9-10.
[17]黃承玲,陳訊,高貴龍.3種高山杜鵑對持續性干旱的生理響應及抗旱性評價[J].林業科學,2011,46(6):48-55.
[18]肖用森,王正直,郭紹川.滲透脅迫下稻苗中游離脯氨酸積累與膜脂過氧化的關系[J].武漢植物學研究,1996,14(4):334-340.
[19]楊帆,苗靈鳳,胥曉,等.植物對干旱脅迫的響應研究進展[J].應用與環境生物學報,2007,13(4):586-591.
[20]韓永華.水分脅迫對大豆幼苗葉片細胞質膜的影響[J].廣西師范大學學報(自然科學版),1999,17(4):85-87.
[21]張玉霞,杜曉艷,張玉芹,等.PEG脅迫對苔草滲透調節特性的影響[J].內蒙古民族大學學報(自然科學版),2008,23(3):289-292.
[22]齊永清,肖凱,李雁鳴.作物在滲透脅迫下脯氨酸積累的研究進展[J].河北農業大學學報,2003,26(增刊):24-27.
[23]師進霖,陳恩波,姜躍麗.PEG-6000滲透脅迫對甜瓜幼苗葉片滲透調節物質及膜脂過氧化的影響[J].西北農業學報,2010,19(1):182-185.
[24]劉丹,陳國祥,魏曉東,等.干旱對銀杏生理生化特性及葉綠體超微結構的影響[J].南京師大學報(自然科學版),2011,34(2):64-69.
[25]范蘇魯,苑兆和,馮立娟,等.干旱脅迫對大麗花生理生化指標的影響[J].應用生態學報,2011,22(3):651-657.
[26]常雪剛,徐柱,易津,等.7種鵝觀草屬植物苗期干旱脅迫的生理評價[J].中國草地學報,2011,33(4):44-50.
[27]原向陽,郭平毅,楊麗光,等.干旱脅迫下草甘膦對抗草甘膦大豆幼苗保護酶活性及脂質過氧化作用的影響[J].中國農業科學,2010,43(4):689-705.
[28]夏新莉,鄭彩霞.土壤干旱脅迫對樟子松針葉膜脂氧化、膜脂成分和乙烯釋放的影響[J].林業科學,2000,36(3):25-34.
[29]趙麗英,鄧西平,山侖.活性氧清除系統對干旱脅迫的響應機制[J].西北植物學報,2005,25(2):413-418.
[30]胡景江,顧振瑜,文建雷,等.水分脅迫對元寶楓膜脂過氧化作用的影響[J].西北林學院學報,1999,14(2):7-11.
[31]姜慧芳,任小平.干旱脅迫對花生葉片SOD活性和蛋白質的影響[J].作物學報,2004,30(2):169-174.

