莖環法RT-qPCR定量檢測細胞抗豬瘟病毒siRNA的表達
劉帥,李江南,袁婷,楊凡力,逄大欣,涂長春
1 吉林大學畜牧獸醫學院,吉林 長春 130062
2 軍事醫學科學院軍事獸醫研究所,吉林 長春 130122
RNAi作為一種有效的抗病毒工具,已成功應用于抑制人體免疫缺損病毒Ⅰ型 (HIV-1)[1]、SARS冠狀病毒 (SARS-CoV)[2]等多種病毒的復制增殖。豬瘟 (Classical swine fever,CSF) 是由豬瘟病毒 (Classical swine fever virus,CSFV) 引起的一種高度接觸性傳染病,給養豬業帶來重大經濟損失。CSFV是有囊膜的正鏈RNA病毒,基因組RNA兼具復制和轉錄功能,且非結構蛋白基因保守性比較高[3],提供了理想的RNAi靶位點。為應用RNAi技術構建抗豬瘟病毒轉基因豬,本研究小組曾針對 CSFV非結構蛋白基因Npro成功設計了2個siRNA——siN1和siN2[4],并構建了相應的siRNA表達載體——pLox-siN1和pLox-siN2[5-6],在細胞水平通過檢測病毒的復制和增殖水平,證明了siN1和siN2對CSFV有顯著的抑制效果,但是,抗性細胞中siRNA的表達檢測卻制約了RNAi效果的評價。所以亟需建立一種準確而簡便的siRNA定量檢測方法,對抗豬瘟病毒轉基因豬 siRNA的表達水平及組織表達差異進行有效監測及評價。
目前,已有多種siRNA、miRNA (microRNA)等小RNA的檢測方法。Northern blotting[7]仍是小RNA檢測的金標準,但其特異性和靈敏度不高。而基于LNA (Locked nucleic acid) 標記探針的新型 Northern blotting[8]雖然顯著改善了檢測靈敏度和特異性,但仍存在操作步驟繁瑣、需樣品量大、可檢測范圍低等缺點,更難于準確定量。然而,多種實時定量PCR方法[9-16]被開發出來定量miRNA的表達水平,常用的包括Poly (A) 加尾法[15]和莖環引物法[16]。前者可同時逆轉錄細胞內所有的 miRNA,成本低但靈敏度和特異性均不如后者,適合于miRNA的大量篩選工作。后者創新地設計了具有穩定空間結構的莖環引物,比常規線性引物有更高的特異性和靈敏度,并聯合特異性MGB探針,使其可精確區分同家族高度同源的miRNA,重要的是僅對成熟miRNA進行檢測,而不受其前體 (Pre-miRNA) 干擾。但每種miRNA都需要設計一個對應的莖環引物和MGB探針,成本高且操作相對繁瑣,所以適于少數靶基因的定量檢測。2009年,Cheng等[17]將莖環法 RT-qPCR成功地應用于人工合成siRNA的檢測,并在分子、細胞和動物個體等水平準確定量了未修飾的單鏈siRNA,3末端有兩個突出的雙鏈Silencer?siRNA及LNA修飾的雙鏈Silencer?Select siRNA等3種形式的siRNA,有效地解決了對siRNA傳遞效率、分布和穩定性等難于評價的問題。
在本研究中,我們建立了檢測siN1和siN2兩個抗CSFV的特異siRNA表達水平的莖環法RT-qPCR,準確定量檢測了抗CSFV的PK-15細胞克隆的siRNA表達水平,特異性強,靈敏度高,可精確至100個拷貝,檢測范圍寬。可用于RNAi抗病毒效果的定量評價,為未來轉基因動物的抗病毒效果評價提供了參考。
1 材料與方法
1.1 材料
1.1.1 質粒和細胞
高效且特異抑制CSFV復制增殖的siRNA表達載體pLox-siN1和pLox-siN2及表達亂序siN1的對照載體pLox-siC均為本實驗室構建并保存[6];PK-15豬腎傳代細胞系 (85代) 由本室保存;豬胚胎成纖維細胞 (Porcine fetal fibroblasts,PFF) 由吉林大學歐陽紅生教授惠贈。
1.1.2 主要試劑和儀器
限制性內切酶Apal Ⅰ購自NEB公司;轉染試劑FuGENE?HD購自Roche公司;G418購自Gibco公司;總 RNA 提取試劑盒 (MirVana miRNA Isolation Kit),逆轉錄試劑盒 (TaqMan?MicroRNA Reverse Transcription Kit) 和實時定量PCR試劑 (TaqMan Universal Master Mix,No AmpErase?UNG) 均購自 ABI公司;豬抗CSFV陽性血清 (5號) 和陰性豬血清由本實驗室制備、鑒定并保存[18];異硫氰酸熒光素(FITC) 標記的兔抗豬IgG抗體購自Sigma公司;實時定量 PCR儀 Stratagene Mx3000P購自Agilent公司;核酸測定儀 NanoDrop 1000購自Thermo公司。
1.2 轉染及抗CSFV的陽性細胞克隆鑒定
用Apal Ⅰ雙酶切質粒pLox-siN1、pLox-siN2和pLox-siC并乙醇沉淀回收含抗性基因neo的目的片段。用含10%小牛血清的MEM營養液以每孔2.0×105個PK-15細胞傳代于6孔細胞培養板中,37 ℃、5% CO2培養箱中培養20~24 h,使細胞貼壁生長滿度達到85%~90%,用FuGENE?HD轉染24 h后1∶50傳代于6孔細胞培養板中,培養24 h后換用500 mg/L G418的MEM培養基篩選 12~14 d,質粒 pLox-siN1、pLox-siN2和pLox-siC挑取細胞克隆 (分別命名為 PK-N1、PK-N2和PK-siC) 各3個至24孔板中培養,擴大培養并進行neo基因PCR鑒定 (引物neo-FP和neo-RP序列見表1),以確定基因組中整合了目的基因片段。按以前所述方法[6]包括IFA (接毒后72 h)、病毒基因組拷貝數 (48 h和72 h) 和TCID50(48 h和 72 h) 測定以上陽性克隆抑制CSFV復制增殖的效果。
1.3 引物和MGB探針設計
參考 Chen等[16]和 Tang等[19]設計 siN1和siN2檢測用引物和探針 (表 1):莖環引物由 5′端通用莖環結構序列 (5′-CTCAACTGGTGTC GTGGAGTCGGCAATTCAGTTGAG-3′) 和3′端與siRNA 3′端反向互補配對的siRNA特異性序列組成,根據與siRNA配對的寡核苷酸數量 (6或8個) 不同對每個siRNA設計了兩種莖環引物(分別為 SLP-N1-6、SLP-N1-8和 SLP-N2-6、 SLP-N2-8)。實時定量PCR上游引物包括用于提高 Tm值并延伸 PCR產物的 5′端通用序列(5′-ACACTCCAGCTGGG-3′) 和3′端siRNA特異序列。MGB探針由5′端6-FAM標記的通用序列 (5′-TTCAGTTGAG-3′) 和 3′端 MGB標記siRNA特異序列組成。選擇表達豐度較高且穩定的豬內源性ssc-miR16為內參,監測樣本質量、RNA提取及 RT-PCR等過程。所用引物均由南京金斯瑞基因有限公司合成,MGB探針由上海基康基因有限公司合成,標準品ssiN1 (人工合成的siN1,序列見表1) 由TaKaRa公司合成。
1.4 莖環法RT-qPCR
1.4.1 總RNA提取
將獲取的抗CSFV的PK-15細胞克隆培養于6孔細胞培養板中,當滿度達90%至95%時,棄培養液,用1 mL冷PBS在冰上洗細胞2次,然后按MirVana miRNA isolation kit說明書建議加入 500 μL裂解液裂解后提取總 RNA,以正常PK-15細胞為陰性對照。用NanoDrop 1000測定RNA濃度及質量,分裝于?80 ℃保存備用。

表1 siRNA及引物和MGB探針序列Table 1 Sequence of siRNA, primer and MGB probe
1.4.2 莖環法逆轉錄反應
逆轉錄反應體系包括50 nmol/L莖環引物,0.25 mmol/L dNTPs,3.33 U/μL逆轉錄酶,0.25 U/μL RNA酶抑制劑,1倍逆轉錄緩沖液,10 ng總RNA,用無RNA酶水補至15 μL。反應條件為冰上放置5 min,16 ℃ 30 min ,42 ℃延伸30 min,85 ℃酶滅活5 min,4 ℃保存。所有逆轉錄反應均為兩個重復。
1.4.3 實時定量PCR反應
實時定量PCR反應體系為10 μL PCR預混液,1.5 μmol/L上游引物,0.7 μmol/L通用下游引物,0.2 μmol/L MGB探針,1.2 μL cDNA產物,去離子水補至 20 μL。在 Agilent Stratagene Mx3000P實時定量PCR儀上完成反應,條件為:95 ℃熱啟動10 min,95 ℃變性15 s,60 ℃退火1 min,在60 ℃收集熒光,共40個循環。所有反應包括陰性細胞對照 (NC) 和空白對照(NTC) 均為2個重復,結果取均值,產物連接T載體測序驗證。
1.4.4 標準曲線的繪制及靈敏度分析
為準確定量細胞克隆的siRNA表達水平,以10 mg/L濃度的PK-15細胞總RNA為稀釋液10倍梯度稀釋已知拷貝數的標準品ssiN1,取8個梯度 (拷貝數從 10到 1.0×108) 進行莖環法RT-qPCR檢測繪制標準曲線,計算細胞表達的siRNA拷貝數,并分析此方法檢測靈敏度。
1.4.5 特異性分析
因細胞表達數百種與siRNA大小相似的內源性 miRNA,可作為特異性分析材料,所以選擇PK-N1、PK-N2和 PK-siC細胞克隆及陰性細胞PK-15和PFF的總RNA為模板進行siN1和siN2的莖環法RT-qPCR檢測,以評價檢測特異性。
1.5 數據分析
用Agilent公司的Stratagene Mx3000P軟件分析 PCR結果。采取手動方式將閾值選定在固定熒光閾值 6000得到各反應管的 Cq值(Quantification cycle),軟件自動生成標準曲線。用SPSS軟件完成數據統計分析。
2 結果
2.1 抗CSFV PK-15細胞克隆的制備及鑒定
將 G418篩選獲得的 PK-15細胞克隆進行neo基因PCR鑒定,均成功擴增出了neo基因片段 (圖略),說明細胞克隆均整合了目的基因片段;抗CSFV檢測結果如圖1所示,IFA結果中陽性細胞克隆熒光比例為5%左右,遠遠低于對照細胞 PK-siC的 80%~85%,表明有效降低了CSFV抗原的合成;陽性細胞克隆的病毒基因組拷貝數和 TCID50測定結果均顯著低于對照細胞(P<0.01),表明有效抑制了病毒基因組復制和成熟病毒粒子裝配。以上結果共同表明已成功獲得了抗CSFV的PK-N1和PK-N2細胞克隆。
2.2 莖環逆轉錄引物篩選
應用兩種莖環引物分別以相應陽性克隆、PK-15細胞的總 RNA 為模板進行莖環法RT-qPCR檢測。為篩選出最佳莖環引物,以具有較高逆轉錄效率且較低的背景信號為篩選原則,并引入 ΔCq進行量化評價,每種逆轉錄引物的ΔCq=Cq(陰性細胞對照) –Cq(陽性細胞克隆),ΔCq越大,則逆轉錄引物具有越高的逆轉錄效率且產生越低的背景信號。結果如圖2所示,siN1檢測體系的莖環引物SLP-N1-6的ΔCq(7.09) 遠大于SLP-N1-8 (0.32),siN2檢測體系的SLP-N2-8的ΔCq(10.48) 遠大于SLP-N2-6 (5.93),所以均為最佳的莖環引物。
2.3 特異性分析
特異性分析結果如表 2所示,PK-N1和PK-15的siN2檢測結果相同,PK-N2和PK-15的siN1檢測結果也相同,說明siN1和siN2兩種檢測體系不會相互影響,均只能特異性地檢測各自目的siRNA;PK-siC和PK-15的siN1檢測結果相同,說明亂序的siN1分子不會影響siN1的檢測;而兩種陰性細胞PK-15和PFF的Cq均在35左右,且遠大于陽性克隆 (Cq為25-28),說明檢測背景底,可通過 Cq的差異有效地區分陰陽性結果。以上結果共同表明我們建立檢測 siN1和siN2的莖環法RT-qPCR受內源性miRNA的干擾很小,具有很高的檢測特異性。

圖1 抗CSFV PK-15細胞克隆鑒定Fig. 1 Identity results of anti-CSFV cell clones. (A) IFA results of PK-15 cell clones at 72 h after CSFV infection (40×). Mock transfection: stained with CSFV-negative serum. (B,C) Quantity of CSFV genomic RNAs and infectious CSFV production at 48 h and 72 h after CSFV infection. PK-siC: PK-15 cell clones expressing scrambled siN1. ** P<0.01, very signifcant difference with PK-siC control.

圖2 莖環引物的篩選結果Fig. 2 Results of screening stem-loop primers. (A) 1, 3: PK-N1 RNA reverse transcribed with SLP-N1-8 (Cq=25.71) and SLP-N1-6 (Cq=28.14); 2, 4: PK-15 with SLP-N1-8 (Cq=26.03) and SLP-N1-6 (Cq=35.23). (B) 5, 6: PK-N2 RNA reverse transcribed with SLP-N2-8 (Cq=25.97) and SLP-N2-6 (Cq=31.82); 7, 8: PK-15 with SLP-N2-8 (Cq=36.45) and SLP-N2-6 (Cq=37.75).
2.4 標準曲線的繪制及靈敏度分析
以ssiN1為標準品繪制標準曲線,結果如圖3所示,1~7個梯度有很高的重復性,并能與陰性對照相區分,能檢測100個拷貝的siRNA;檢測線性范圍寬,可達 7個數量級;平行性好(Rsq=0.999),擴增效率高 (Eff.=98.2%);可對目的siRNA進行定量分析。
2.5 PK-N1和PK-N2細胞克隆的siRNA定量檢測
以經抗CSFV鑒定的PK-N1和PK-N2細胞克隆各3個進行siRNA定量檢測,用2-ΔCq法計算目的 siRNA相對于內參 ssc-miR16的表達水平,如表2所示,結果表明陽性細胞克隆PK-N1和PK-N2均表達了目的siRNA,但每個克隆的siRNA表達水平不同,最高為內參ssc-miR16的 5.54倍,最低的為0.62倍,通過標準曲線計算其拷貝數在 1.0×104左右。產物經測序鑒定正確,表明成功建立了可準確定量檢測siN1和siN2的莖環法RT-qPCR。

圖3 ssiN1檢測動態范圍及靈敏度分析Fig. 3 Dynamic range and sensitivity of the ssiN1 assay. (A) Amplification plot of ssiN1 over eight orders of magnitude. 1-8: ssiN1 input ranged from 10 to 1.0×108 copies; NC: negative control; NTC: no template control. (B) Standard curve of the ssiN1.
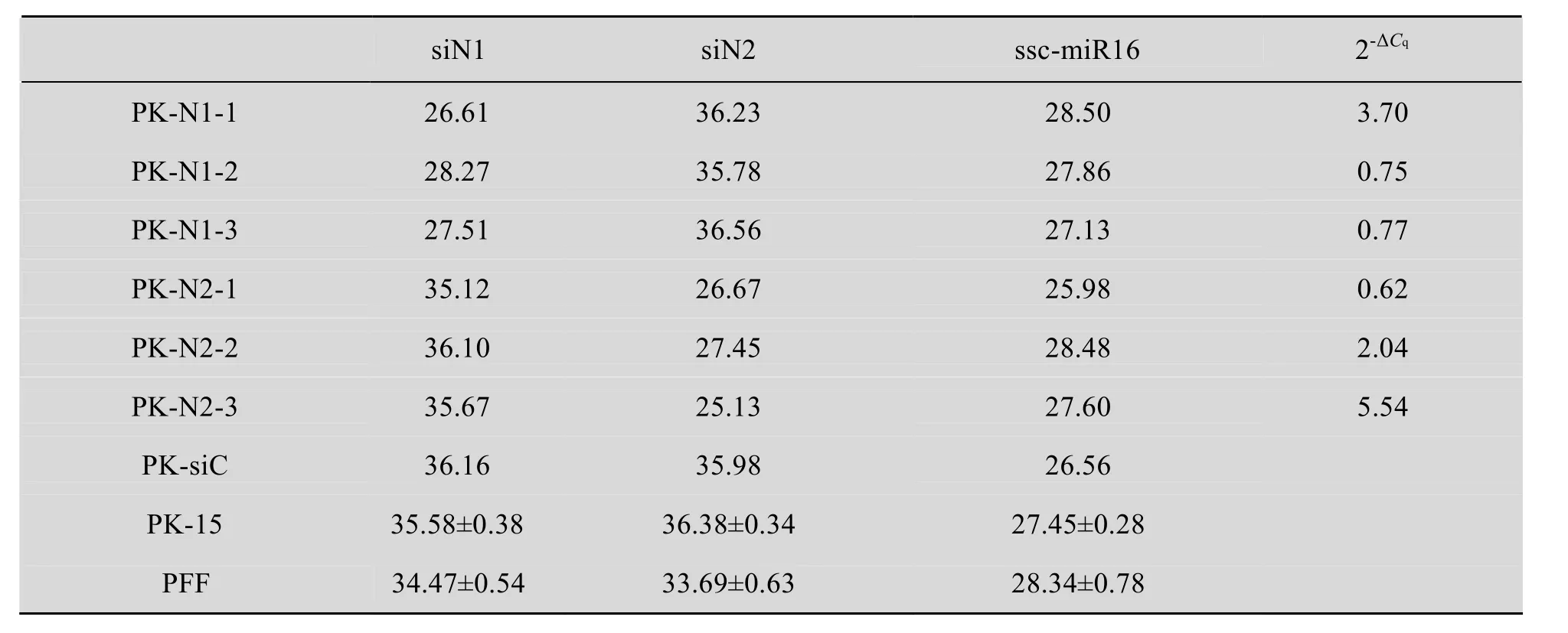
表2 陽性細胞克隆檢測及特異性分析結果Table 2 Results of positive cell clones and specificity analysis
3 討論
目前,RNAi已廣泛地應用于抗病毒治療研究,一般通過測定細胞接毒后病毒基因組拷貝數(Real time RT-PCR) 和蛋白表達水平 (IFA) 及成熟病毒粒子裝配水平 (TCID50)[4,6]來評價抗病毒效果,但在某些情況下定量檢測siRNA的表達水平是非常必要的。我們曾為確定siRNA四表達載體是否表達了每種siRNA而按ter Brake等[1]的方法構建了siRNA靶基因和報告基因GFP融合表達的報告質粒,與siRNA表達質粒共轉染細胞,可通過報告基因的表達來判斷siRNA是否表達及其抑制效果[6]。但這種間接的方法應用范圍窄,僅能評價siRNA載體的有效性,所以需要建立一種直接檢測siRNA的方法,以滿足廣泛的需要。
目前已有多種可用于檢測siRNA的方法,而選擇最適的方法是本實驗成敗的關鍵。熒光定量PCR是基因表達定量分析的金標準,盡管siRNA的短小對其提出了巨大挑戰,但仍有多種實時定量方法被開發出來[9-16],這些方法兼具了實時定量 PCR的高靈敏度、高特異性、準確定量及寬動態范圍的實時監測等優點。而莖環法RT-qPCR因創新地設計了莖環引物,其莖部的堿基堆積作用大大增加了RNA-DNA雜交雙鏈的熱穩定性,另外,莖環的空間限制作用使之比常規線性引物有更高的特異性,并聯合特異性MGB探針,使其成為準確定量siRNA的最佳選擇。
在莖環引物的篩選過程中,我們發現對于siN1檢測體系 (圖2A),用SLP-N1-8逆轉錄陽性細胞 (25.71) 和陰性細胞對照 (26.03) 的 Cq值基本相同,可能是體系中上游引物與莖環引物產生雜交反應,產生很高的假陽性信號,是不合格的引物;而 SLP-N2-6有較低的背景信號(35.23),可有效區分陰陽性結果,是較理想的逆轉錄引物。對于 siN2檢測體系 (圖 2B),無論SLP-N2-6 還是 SLP-N2-8的陰性細胞對照均有較低的背景信號,但 SLP-N2-8的陽性細胞(25.97) 的Cq遠小于SLP-N2-6 (31.82),而這種信號不可能來自于較低的背景信號,所以說明SLP-N2-8有更高的逆轉錄效率,為較佳的逆轉錄引物。根據以上研究結果我們發現莖環引物的3′端與siRNA配對的堿基個數對實驗成敗至關重要,配對8個可能會與上游引物重疊導致雜交反應,造成假陽性結果,而配對6個又可能會降低逆轉錄效率,所以本實驗設計兩種莖環引物,以實驗來篩選效果最佳者,并引入ΔCq來進行量化評價,結果選擇了SLP-N1-6和SLP-N2-8為最佳莖環引物。
因為 siRNA和 miRNA均為21 nt左右的RNA分子,所以siRNA的檢測一般會受到細胞內源性數百種且表達量較高的miRNA的干擾。我們曾用Shi等[15]的Poly (A) 加尾法RT-qPCR檢測目的siRNA,但其陰性細胞對照及水對照均有擴增曲線 (數據未顯示),可能是受miRNA的干擾所致,再加上引物二聚體與擴增產物的溶解曲線 Tm大小相近,給陰陽性結果的分析判斷帶來極大困難。而 Cheng等[17]報道了莖環法RT-qPCR也會產生非特異性曲線,他們設計的107個siRNA檢測體系,在以HeLa細胞RNA為陰性對照時,絕大多數體系 (101個) Cq值大于35,有5個Cq值在30至35之間,1個Cq值小于30,而陽性結果均小于 30,所以陰性細胞對照的Cq值大于35可說明體系有較低的非特異性擴增反應,不會影響目的siRNA的檢測。為了探明細胞內數百種 miRNA對我們所建立的siN1siN2檢測體系的影響,選擇了具有獨特miRNAs表達譜系的 PK-15和 PFF兩種陰性細胞,結果PK-15細胞 (見表2) 的Cq值均大于35,而PFF細胞的Cq值均在33到35之間,說明了細胞的miRNAs表達譜系會對檢測有所影響,但這種影響又是微乎其微的 (兩種陰性細胞僅相差1到2個Cq,而與陽性細胞相差7到10個Cq),綜上結果表明,我們所建立的檢測siN1和siN2的莖環法RT-qPCR均有很高的檢測特異性。
為了準確定量細胞siRNA的表達水平,曾應用Promega公司的 Riboprobe System-T7系統體外轉錄的 siN1分子為標準品,但因無法準確測定siN1拷貝數而選擇了ssiN1,并用10 mg/L的正常PK-15細胞總RNA為稀釋液進行10倍梯度稀釋,模擬細胞內的真實環境,充分考慮了細胞內源性miRNA的干擾,以達到準確定量siRNA的目的。
雖然篩選獲得的抗CSFV細胞克隆均表達了目的 siRNA,但每個克隆的siRNA表達水平顯著不同,這可能是由于外源基因隨機地整合到受體細胞染色體的任意位置,產生了位置效應,也可能是隨機整合了多個外源基因所致。
本研究建立的莖環法RT-qPCR,可用于準確定量檢測細胞抗病毒 siRNA的表達水平,聯合IFA等檢測病毒水平的方法定量評價RNAi抗病毒的有效性。在抗豬瘟病毒轉基因動物的構建過程中,此方法可用于篩選siRNA高效表達的供體細胞克隆,從而提高抗病毒轉基因動物的成功率,并可應用于未來轉基因動物的抗病毒效果的評價。另外,本方法對siRNA、miRNA等小RNA的檢測工作具有很好的參考價值。
REFERENCES
[1] ter Brake O, 't Hooft K, Liu YP, et al. Lentiviral vector design for multiple shRNA expression and durable HIV-1 inhibition. Mol Ther, 2008, 16(3): 557?564.
[2] Wu CJ, Huang HW, Liu CY, et al. Inhibition of SARS-CoV replication by siRNA. Antiviral Res, 2005, 65(1): 45?48.
[3] Ruggli N, Bird BH, Liu LZ, et al. Nproof classical swine fever virus is an antagonist of double-stranded RNA-mediated apoptosis and IFN-α/β induction. Virology, 2005, 340(2): 265?276.
[4] Xu XR, Guo HC, Xiao C, et al. In vitro inhibition of classical swine fever virus replication by siRNAs targeting Nproand NS5B genes. Antiviral Res, 2008, 78(3): 188?193.
[5] Li JN, Guo HC, Shi ZX, et al. In vitro inhibition of CSFV replication by retroviral vector-mediated RNA interference. J Virol Methods, 2010, 169(2): 316?321.
[6] Li JN, Dai YJ, Liu S, et al. In vitro inhibition of CSFV replication by multiple siRNA expression. Antiviral Res, 2011, 91(2):209?216.
[7] Pall GS, Codony-Servat C, Byrne J, et al. Carbodiimide-mediated cross-linking of RNA to nylon membranes improves the detection of siRNA, miRNA and piRNA by Northern blot. Nucleic Acids Res, 2007, 35(8): e60.
[8] Várallyay é, Burgyán J, Havelda Z. Detection of microRNAs by Northern blot analyses using LNA probes. Methods, 2007, 43(2): 140?145.
[9] Jiang M, Arzumanov AA, Gait MJ, et al. A bi-functional siRNA construct induces RNA interference and also primes PCR amplification for its own quantification. Nucleic Acids Res, 2005, 33(18): e151.
[10] Raymond CK, Roberts BS, Garrett-Engele P, et al. Simple, quantitative primer-extension PCR assay for direct monitoring of microRNAs and short-interfering RNAs. RNA, 2005, 11(11): 1737?1744.
[11] Ro S, Park C, Jin JL, et al. A PCR-based method for detection and quantification of small RNAs. Biochem Biophys Res Commun, 2006, 351(3): 756?763.
[12] Varkonyi-Gasic E, Wu R, Wood M, et al. Protocol: a highly sensitive RT-PCR method for detection and quantification of microRNAs. Plant Methods, 2007, 3: 12.
[13] Sharbati-Tehrani S, Kutz-Lohroff B, Bergbauer R, et al. miR-Q: a novel quantitative RT-PCR approach for the expression profiling of small RNA molecules such as miRNAs in a complex sample. BMC Mol Biol, 2008, 9(1): 34.
[14] Stratford S, Stec S, Jadhav V, et al. Examination of real-time polymerase chain reaction methods for the detection and quantification of modified siRNA. Anal Biochem, 2008, 379(1): 96?104.
[15] Shi R, Chiang VL. Facile means for quantifying microRNA expression by real-time PCR. Biotechniques, 2005, 39(4): 519?525.
[16] Chen C, Ridzon DA, Broomer AJ, et al. Real-time quantification of microRNAs by stem-loop RT-PCR. Nucleic Acids Res, 2005, 33(20): e179.
[17] Cheng AG, Li M, Liang Y, et al. Stem-loop RT-PCR quantification of siRNAs in vitro and in vivo. Oligonucleotides, 2009, 19(2): 203?208.
[18] Yu XH, Tu CC, Lu HW, et al. DNA-mediated protection against classical swine fever virus. Vaccine, 2001, 19(11/12):1520?1525.
[19] Tang FC, Hajkova P, Barton SC, et al. MicroRNA expression profiling of single whole embryonic stem cells. Nucleic Acids Res, 2006, 34(2): e9.

