植物類型III聚酮合酶超家族晶體結(jié)構(gòu)與功能
呂鶴書,柳春梅,路平,師光祿,馬蘭青,王有年
1 北京農(nóng)學(xué)院 農(nóng)業(yè)部都市農(nóng)業(yè) (北方) 重點(diǎn)開放實(shí)驗(yàn)室,北京 102206
2 北京農(nóng)學(xué)院 農(nóng)業(yè)應(yīng)用新技術(shù)北京市重點(diǎn)實(shí)驗(yàn)室,北京 102206
查爾酮合酶 (Chalcone synthase,CHS) 超家族,又稱植物類型Ⅲ聚酮化合物合酶超家族(Plant-specific type Ⅲ polyketide synthase superfamily) 催化合成多種植物次生代謝產(chǎn)物的基本分子骨架,包括查爾酮、白藜蘆醇、間苯三酚、間苯二酚、二苯甲酮、聯(lián)苯、色酮、異香豆素、吖啶酮、喹啉酮、吡喃酮等[1-2]。自1983年第一個(gè)chs基因從西芹Petroselium hortense中被分離以來[3],超過20種不同功能的植物和細(xì)菌的PKSs被相繼克隆和定性。其中包括了:CHS[4-8]、芪合酶 (Stilbene synthase, STS)[9-11]、苯亞甲基丙酮合酶 (Benzalacetone synthase, BAS)[12-17]、2-吡喃酮合酶 (2-Pyrone Synthase, 2-PS)[8,18]、吖啶酮合酶 (Acridone synthase, ACS[19-22]、戊烯酮-色酮合酶 (Pentaketide chromone synthase, PCS)[23-24]、辛烯酮合酶 (Octaketides synthase, OKS)[25]、4-香豆酰甘油酸合酶 (p-Coumaroyl triacetic acid synthase, CTAS)[26]、聯(lián)芐合酶(Bibenzyl synthase, BBS)[27]、二苯甲酮合酶(Benzophenone synthase, BPS)[28]、聯(lián)苯合酶(Biphenyl synthase, BIS)[29]、 蘆 薈 松 合 酶(Aloesone synthase, ALS)[30]、苯戊酮合酶(Valerophenone synthase, VPS)[31]、芪-羧酸酯合酶(Stilbenecarboxylate synthase, STCS)[32]、姜黃素合酶 (Curcuminoid synthase, CUS;Curcumin synthase 1-3, CURS1-3)[33-35,45-46]等。
植物類型 Ⅲ PKSs 家族成員具有30%~95%氨基酸序列同一性 (圖1),其結(jié)構(gòu)和催化機(jī)制不同于主要存在于微生物中的 I型和Ⅱ型 PKSs。可重復(fù)使用的約400個(gè)氨基酸構(gòu)成的多肽形成同源二聚體,利用輔酶A連接底物在酶活性中心進(jìn)行了完整的脫羧、縮合、環(huán)化反應(yīng)[1-3]。植物類型 Ⅲ PKSs 功能多樣性主要體現(xiàn)在:起始底物分子的不同,丙二酰輔酶A縮合數(shù)目的不同,以及環(huán)化機(jī)制的不同。其中,CHS、ACS、VPS、BPS利用Claisen型環(huán)化,STS利用aldol型環(huán)化,2PS利用lactonization型環(huán)化,而BAS和CUS只催化縮合反應(yīng)不進(jìn)行環(huán)化反應(yīng)。
由于聚酮化合物具有顯著多樣的生物學(xué)活性,參與多種重要生物學(xué)功能的行使,一直是研究蛋白結(jié)構(gòu)與功能關(guān)系、基于結(jié)構(gòu)進(jìn)行分子改造的重要模式分子家族[1-2]。就功能不同的植物類型 Ⅲ PKSs 成員的基因結(jié)構(gòu)、功能及代謝產(chǎn)物,本研究組已經(jīng)作了系統(tǒng)的總結(jié)[36]。本篇綜述主要針對(duì)目前NCBI結(jié)構(gòu)數(shù)據(jù)庫中報(bào)道的植物類型ⅢPKSs晶體三維結(jié)構(gòu)和定點(diǎn)突變功能研究的進(jìn)展進(jìn)行總結(jié),為超家族成員在酶工程、基因工程上的應(yīng)用奠定結(jié)構(gòu)基礎(chǔ)。

圖1 植物類型Ⅲ PKS超家族成員氨基酸序列比較. 參照M. sativa CHS2標(biāo)出重要氨基酸序列. 催化三聯(lián)體(Cys164,His303,Asn336) 和關(guān)鍵活性位點(diǎn)殘基 (Thr132,Ser133,Thr194,Thr197,Phe215,Gly256,Phe265,Asn336,Ser338) 序列參照紫花苜蓿CHS2序列被標(biāo)出Fig. 1 Sequence alignment of CHS superfamily type III PKSs. The catalytic triad (Cys164, His303, and Asn336), and the critical residues lining the active-site cavity (Thr132, Ser133, Thr194, Thr197, Phe215, Gly256, Phe265, Asn336, Ser338) are marked and numbered in M. sativa CHS2.
1 植物類型III PKSs結(jié)構(gòu)研究概況
在蛋白質(zhì)數(shù)據(jù)庫 (Protein Data Bank,PDB)中共報(bào)道了 81個(gè)不同種屬來源的類型Ⅲ PKSs的三維結(jié)構(gòu),其中包括了33個(gè)植物來源、32個(gè)微生物來源 (包括11個(gè)針對(duì)鏈霉素類型Ⅲ PKSs的NMR結(jié)構(gòu)),以及5個(gè)人類來源的結(jié)構(gòu)。除了最早發(fā)表的14個(gè)針對(duì)紫花苜蓿Medicago sativa CHS2野生型或突變體的Apo (Apoenzyme) 或復(fù)合物結(jié)構(gòu)外,陸續(xù)有幾個(gè)研究組報(bào)道了另外6種植物類型Ⅲ PKSs的晶體結(jié)構(gòu) (表1)。上述研究顯示植物類型Ⅲ PKSs超家族成員具有相似的三維結(jié)構(gòu)和催化機(jī)制,其中以M. sativa CHS2晶體結(jié)構(gòu)研究最為透徹[4]。CHS蛋白具有389個(gè)氨基酸殘基,催化來自丙二酰輔酶A (Malonyl-CoA) (延伸底物) 的 3個(gè)乙酰集團(tuán)通過連續(xù)的縮合反應(yīng)連接到 4-香豆酰輔酶 A (p-Coumaroyl-CoA) (起始底物) 分子上,之后通過克萊森 (Claisen)型環(huán)化反應(yīng)生成芳香族聚酮化合物柚皮素查爾酮 (Naringenin chalcone) (圖2),其為類黃酮化合物生物合成的前體[4-8]。
2 查爾酮合酶 (CHS) 晶體結(jié)構(gòu)和功能
2.1 M. sativa CHS2整體結(jié)構(gòu)
Noel等于1999年報(bào)道了M. sativa CHS2的第一個(gè)1.56 ?晶體結(jié)構(gòu)[4]。除了Apo結(jié)構(gòu)外,還包括了與多種底物、產(chǎn)物類似物相復(fù)合的共6個(gè)晶體結(jié)構(gòu)。基于結(jié)構(gòu)和重要?dú)埢c(diǎn)突變的生化結(jié)果提出了關(guān)于植物類型Ⅲ PKS的催化機(jī)制的詳盡信息[5-6]。如圖3A所示的M. sativa CHS2整體結(jié)構(gòu),約42 kDa的單體蛋白圍繞晶體學(xué)二重軸形成同型二聚體,作為行使功能的基本單位。由每個(gè)單體的 N端 α螺旋和 6個(gè)氨基酸環(huán)區(qū)(Thr132-Met137) 構(gòu)成了約 1580?2的分子間接觸包埋表面。每個(gè)單體包括2個(gè)結(jié)構(gòu)域,上部的結(jié)構(gòu)域呈現(xiàn)出αβαβα假對(duì)稱模塊樣式。CHS同型二聚體每個(gè)單體都含有2個(gè)功能上獨(dú)立的活性位點(diǎn),位于上下結(jié)構(gòu)域的交界處,每個(gè)單體中由6個(gè)氨基酸構(gòu)成的環(huán)區(qū) (Thr132-Met137) 將 2個(gè)單體的活性位點(diǎn)分隔開,其中每個(gè)單體蛋白的Met137突出到另一單體參與相鄰單體活性腔的構(gòu)成。
2.2 M. sativa CHS2活性腔結(jié)構(gòu)
M. sativa CHS2的活性腔由3個(gè)內(nèi)部相連的小腔構(gòu)成:包括長(zhǎng)約 16?的輔酶 A結(jié)合通道(CoA-binding tunnel)、 香 豆 酰 結(jié) 合 口 袋(Coumaroyl binding pocket) 和向下延伸口袋(Downward-expanding pocket)。后兩個(gè)小腔構(gòu)成了深埋在內(nèi)部的一個(gè)大的“起始、延長(zhǎng)、環(huán)化”活性腔 (Active site cavity)[4]。Cys164、His303和Asn336構(gòu)成酶活性中心催化三聯(lián)體,位于香豆酰結(jié)合口袋的頂部 (圖3B)。輔酶A結(jié)合通道與外界相通使底物能夠進(jìn)入到催化中心。結(jié)合通道相對(duì)于底物和產(chǎn)物而言略窄,暗示其具有一定的柔性便于芳香族底物和產(chǎn)物的結(jié)合和釋放。香豆酰結(jié)合口袋位于輔酶A結(jié)合通道的末端,選擇性結(jié)合香豆酰輔酶A的芳香基團(tuán)作為起始底物。伴隨著聚酮鏈的延伸,香豆酰衍生部分進(jìn)入到向下延伸口袋內(nèi)部。與 CHS產(chǎn)物柚皮素查爾酮的香豆酰衍生部分接觸的殘基主要包括了 Ser133、Glu192、Thr194、Thr197、Gly216、Ser338。丙二酰衍生部分與活性腔接觸的殘基主要包括了Thr132、Met137、Phe215、Ile254、Gly256、Phe265和Pro375。
位于活性腔的多個(gè)殘基被認(rèn)為對(duì)酶底物產(chǎn)物專一性具有決定意義,包括Thr132、Ser133、Thr194、Thr197、Gly256、Phe265和Ser338,它們?cè)贑HS中保守,在其他類型Ⅲ PKS中被相應(yīng)的氨基酸所替代[4](圖1)。

表1 植物類型Ⅲ PKSs超家族成員三維結(jié)構(gòu)Table 1 Summary of three-dimensional structures of plant type III PKSs

圖2 植物類型Ⅲ PKS超家族成員催化反應(yīng)過程及產(chǎn)物Fig. 2 Comparison of the reactions and products of divergent plant type III PKSs.
門衛(wèi)氨基酸Phe215和Phe265位于輔酶A結(jié)合通道和活性腔結(jié)合部的下部,具有調(diào)節(jié)其空間結(jié)構(gòu)的功能,被認(rèn)為能幫助丁烯酮中間體的正確折疊和在環(huán)化反應(yīng)中的正確定位[7]。F215S突變導(dǎo)致活性腔入口增大可以容納N-methylanthraniloyl輔酶A作為底物,而野生型CHS則不能接受其作為底物。
蕓香 Ruta graveolens ACS的 Ser132、Ala133和Val265 (基于M. sativa CHS2序列順序) 被認(rèn)為是ACS選擇以N-methylanthraniloyl輔酶A為底物具有吖啶酮生成活性的重要氨基酸[19-20,37-38]。
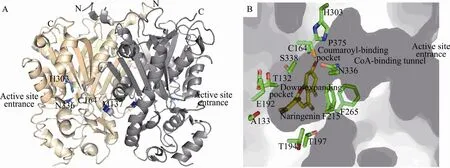
圖3 M. sativa CHS2三維整體結(jié)構(gòu)和活性位點(diǎn)腔結(jié)構(gòu). (A) 三維整體結(jié)構(gòu):?jiǎn)误w分別以橙色和灰色標(biāo)出,催化三聯(lián)體 (Cys164,His303,Asn336) 和 Met137以藍(lán)色球棍模型標(biāo)出. (B) 活性位點(diǎn)腔結(jié)構(gòu):催化三聯(lián)體(Cys164,His303,Asn336)、其他活性位點(diǎn)殘基 (Thr132,Ser133,Glu192,Thr194,Thr197,Phe215,Phe265,Ser338,Pro375) 側(cè)鏈結(jié)構(gòu)以球棍模型顯示,碳原子為綠色;柚皮素查爾酮結(jié)構(gòu)以黃色球棍模型顯示Fig. 3 Enzyme reaction, overall structure and detailed active site cavity structure of M. sativa CHS2. (A) The overall three-dimensional structure of the CHS2 homodimer. The monomers are colored in orange and grey. The catalytic triad (Cys164, His303, and Asn336), and Met137 are shown as blue stick models. (B) Detailed structures of the active-site cavity. The side chains of Thr132, Ser133, Thr194, Thr197, Phe215, Gly256, Phe265, Ser338, Pro375 are shown as stick models with carbons in green; Naringenin is shown as yellow stick models.
Gly256位于CHS活性腔表面直接參與接觸丙二酰輔酶A聚酮鏈,G256A,G256V,G256L和 G256F突變通過改變活性腔的體積影響聚酮鏈長(zhǎng)度,從而改變了產(chǎn)物構(gòu)成[5]。
3 植物類型III超家族其他成員晶體結(jié)構(gòu)和功能
3.1 2-吡喃酮合酶 (2-PS)
雜交非洲菊Gerbera hybrid cultivar 2-PS與M. sativa CHS2具有74%序列同源性。2-PS不能利用香豆酰輔酶A作為起始底物生成查爾酮,而是利用乙酰輔酶A和丙二酰輔酶A縮合生成三乙酸內(nèi)酯 (Triacetic Lactone,TAL) (圖2)。
G. hybrid cultivar 2-PS 2.05 ?的晶體結(jié)構(gòu)顯示具有與 CHS相似的三維折疊、相同的催化殘基、高度保守的輔酶A結(jié)合位點(diǎn),然而其活性腔的體積只有CHS的三分之一[8](圖4A、4B)。體積的減少是由于CHS的T197、G256和S338在2-PS中分別被Leu、Leu和Ile取代,它們被認(rèn)為是控制活性位點(diǎn)腔的體積和形狀的重要?dú)埢瑳Q定了起始底物選擇性和丙二酰輔酶 A的縮合次數(shù)。CHS三突變體T197L/G256L/S338I具有與2-PS相似的功能,即通過乙酰輔酶 A和兩分子丙二酰輔酶A產(chǎn)生TAL。這項(xiàng)結(jié)果第一次為活性位點(diǎn)的形狀和體積影響植物類型Ⅲ PKSs功能的多樣性提供了結(jié)構(gòu)基礎(chǔ)。
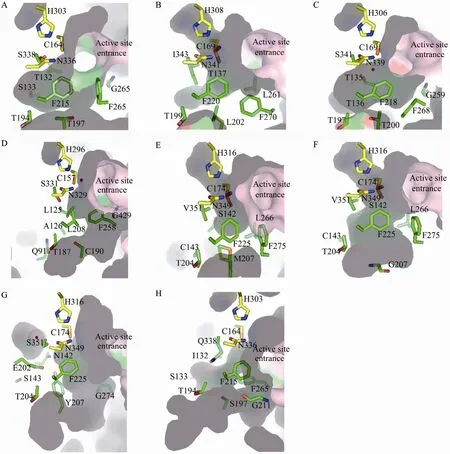
圖4 植物類型Ⅲ PKSs超家族成員活性位點(diǎn)腔結(jié)構(gòu)比較. (A) CHS. (B) 2-PS. (C) STS. (D) BAS. (E) PCS. (F) PCS M207G mutant. (G) CUS. (H) CURS1. 催化三聯(lián)體 (Cys-His-Asn) 以球棍模型顯示,碳原子為黃色;其他重要活性位點(diǎn)殘基側(cè)鏈結(jié)構(gòu)碳原子為綠色,以球棍模型顯示;所有的 Gly顯示為主鏈結(jié)構(gòu);活性水分子顯示為紅色圓點(diǎn)Fig. 4 Comparison of the active site cavities of type III PKSs. (A) CHS. (B) 2-PS. (C) STS. (D) BAS. (E) PCS. (F) PCS M207G mutant. (G) CUS. (H) CURS1. The catalytic triads (Cys-His-Asn) are shown as stick models with carbons in yellow. The side chains of critical active site residues are shown as green stick models, with exception of all Glycines shown as main chains. Active water molecules are shown as red dots.
3.2 戊烯酮-色酮合酶 (PCS) 和辛烯酮合酶(OKS)
PCS能夠催化丙二酰輔酶 A分子間連續(xù) 4步 的 縮 合 反 應(yīng) 產(chǎn) 生 5,7-dihydroxy-2-methylchromone[23],而 OKS催化丙二酰輔酶 A分子間連續(xù) 7步的縮合反應(yīng)產(chǎn)生辛烯酮產(chǎn)物—Octaketides SEK4和SEK4b[25,39]。定點(diǎn)突變研究顯示了 PCS中的 Met207 (對(duì)應(yīng)于 M. sativa CHS2的Thr197) 和OKS的Gly207決定了聚酮鏈的長(zhǎng)度和底物專一性[23,25]。掌葉大黃的 PCS和OKS具有91%的序列同源性,可以因?yàn)閱我话被崛鏟CS M207G的突變功能上可以與OKS互相轉(zhuǎn)化。而氨基酸側(cè)鏈增大的突變,如 OKS中 (G207A,G207T,G207M,G207L,G207F,G207W) 會(huì)導(dǎo)致不能合成辛烯酮,而產(chǎn)生短的聚酮鏈,如丁烯酮至庚烯酮。這個(gè)結(jié)果揭示了,單個(gè)活性腔殘基側(cè)鏈大小足以控制丙二酰輔酶 A縮合的次數(shù)和聚酮鏈的長(zhǎng)度。
木立蘆薈Aloe arborescens PCS野生型和合成辛烯酮M207G突變體的晶體結(jié)構(gòu)揭示了與M. sativa CHS2活性中心構(gòu)象相比活性腔的較大收縮[24](圖4E、4F)。PCS中對(duì)應(yīng)于M. sativa CHS2 Gly256的Leu266產(chǎn)生了明顯的橫向空間限制,結(jié)果PCS和OKS不再接受香豆酰輔酶A作為起始底物合成查爾酮,支持了之前 CHS定點(diǎn)突變研究結(jié)果[5],顯示了 256位點(diǎn)殘基決定了M. sativa CHS2和掌葉大黃ALS的底物選擇[41]。此外,PCS M207G突變體晶體結(jié)構(gòu)顯示,在殘基的主鏈構(gòu)象和野生型幾乎相同的情況下,M207G突變活性腔的體積被擴(kuò)增了超過2.6倍,幾乎與野生M. sativa CHS2的活性腔具有相同體積。PCS突變體活性腔具有獨(dú)特的形狀和位置,可以容納長(zhǎng)的底物分子。在野生型PCS中,大側(cè)鏈 Met207阻斷了向下延伸口袋的入口,而在M207G突變體為包埋的口袋開了一個(gè)入口,使聚酮鏈的長(zhǎng)度從5個(gè)丙二酰輔酶A分子間的縮合增加至8個(gè)分子。207位點(diǎn)對(duì)鏈長(zhǎng)度的控制同樣反映在合成辛烯酮的木立蘆薈PKS3[42]、合成庚烯酮的掌葉大黃ALS[41]的結(jié)構(gòu)中,暗示這些酶具有相似的活性腔構(gòu)造和催化機(jī)理。
F80A/Y82A/M207G突變體的構(gòu)建進(jìn)一步加長(zhǎng)了PCS中隱含的向下延伸的活性腔,同源模建結(jié)果顯示了PCS突變后的活性腔體積增大為野生型的4倍,以丙二酰輔酶A為起始底物催化合成了全新活性的九聚酮分子(Nonaketide)[43-45]。
3.3 芪合酶 (STS)
STS和 CHS利用相同的底物,即香豆酰輔酶A和丙二酰輔酶A形成相同的丁烯酮中間體。在后續(xù)反應(yīng)中STS通過催化C2/C7 aldol環(huán)化生成白藜蘆醇,而CHS通過催化C6/C1克萊森環(huán)化生成柚皮素查爾酮。
松樹 Pinus sylvestris STS和花生 Arachis hypogaea STS-白藜蘆醇 (Resveratrol) 復(fù)合物2.1?和2.4 ?的晶體結(jié)構(gòu)[9,11]被報(bào)道。活性腔結(jié)構(gòu)中 (圖4C),Thr 132的一個(gè)位移使其側(cè)鏈羥基基團(tuán)能夠與一個(gè)水分子形成氫鍵,從而使Thr 132在STS和CHS不同的環(huán)化機(jī)制中發(fā)揮了至關(guān)重要的作用[9]。由于Thr 132在類型Ⅲ PKS序列中高度保守,其位置的移動(dòng)改變了圍繞催化Cys164形成了“aldol-switch”硫酯酶樣氫鍵網(wǎng)絡(luò),從而使 STS采用了與CHS不同的環(huán)化機(jī)制。
Austin等基于以上假設(shè)進(jìn)一步對(duì) CHS序列中4段肽鏈上共18個(gè)位點(diǎn)的氨基酸進(jìn)行替代產(chǎn)生了功能上類似STS的產(chǎn)白藜蘆醇的M. sativa CHS分子 (STS-like 18xCHS),并解析了18xCHS apo和白藜蘆醇復(fù)合物[9]的晶體結(jié)構(gòu),進(jìn)一步確認(rèn)了由于“aldol-switch”類的結(jié)構(gòu)變化引起的區(qū)別于CHS的環(huán)化反應(yīng)機(jī)理。
3.4 苯亞甲基丙酮合酶 (BAS)
植物中的BAS催化4-香豆酰輔酶A與丙二酰輔酶 A通過一步脫羧縮合反應(yīng)生成苯亞甲基丙酮,苯亞甲基丙酮是一系列具有重要生物學(xué)活性苯丁烷類化合物及其衍生物的前體化合物[12]。Morita等報(bào)道了掌葉大黃Rheum palmatum野生型BAS和合成查爾酮I207L/L208F突變體1.8 ?晶體結(jié)構(gòu)、以及單酮香豆酰中間體共價(jià)交聯(lián)于催化Cys殘基的野生型BAS 1.6 ?的晶體結(jié)構(gòu),提供了類型Ⅲ PKS應(yīng)用Cys作為親核攻擊以及定位形成聚酮中間體的直接證據(jù)[17]。
R. palmatum BAS的門衛(wèi)氨基酸在 208位(對(duì)應(yīng)M. sativa CHS2的Phe215) 的Leu取代對(duì)于BAS的乙烯酮合成活性是必需的[13](圖4D)。晶體結(jié)構(gòu)中 Leu208殘基主鏈構(gòu)象與 M. sativa CHS2相似,而其側(cè)鏈伸進(jìn)BAS活性腔內(nèi)使其縮小。掌葉大黃BAS中Ser331 (對(duì)應(yīng)M. sativa CHS2 Ser338) 對(duì)于催化活力的調(diào)控同樣至關(guān)重要,BAS S338V突變體呈現(xiàn)出兩倍的苯亞甲基丙酮生成活性[13]。由于多個(gè)殘基取代的結(jié)果,BAS活性腔較M. sativa CHS2相比縮小僅為其體積的一半,提示活性腔的縮小導(dǎo)致了催化鏈延長(zhǎng)在乙烯酮階段被打斷,從而催化合成苯亞甲基丙酮。
BAS的Phe258對(duì)應(yīng)于M. sativa CHS2的門衛(wèi)氨基酸Phe265,與M. sativa CHS2結(jié)構(gòu)相比其側(cè)鏈更加靠近Leu208并形成疏水相互作用。兩個(gè)門衛(wèi)氨基酸Leu208和Phe258的構(gòu)象變化導(dǎo)致了BAS活性腔的入口擴(kuò)大為M. sativa CHS2的兩倍,改變了其底物專一性。
由于Thr123 (對(duì)應(yīng)M. sativa CHS2的Thr132)在BAS中被Leu所取代,結(jié)構(gòu)中沒有存在類似STS的圍繞 Thr132和親核水分子形成的氫鍵網(wǎng)絡(luò),而是存在另外一個(gè)位置不同的親核的水分子,與Cys-His-Asn催化三聯(lián)體形成氫鍵網(wǎng)絡(luò)。推斷BAS采用了一種區(qū)別于CHS和STS的獨(dú)特的催化機(jī)制進(jìn)行酶結(jié)合中間體硫酯鍵斷裂和最終脫羧反應(yīng),即His296 (對(duì)應(yīng)于M. sativa CHS2的 His303) 作用于活化的水分子進(jìn)行親核攻擊產(chǎn)生β-酮酸,最終經(jīng)歷脫羧產(chǎn)生了C6-C4苯亞甲基丙酮。
我們研究工作首次報(bào)道了蓼科(Polygonaceae) 植物虎杖Polygonum cuspidatum Sieb. et Zucc. 的1個(gè)BAS (PcPKS2) 和1個(gè)具有CHS和 BAS活性的雙功能酶 (PcPKS1)。在PcPKS2中Phe215和Phe265雙雙缺失,分別被Leu和Cys取代,導(dǎo)致聚酮鏈的延伸在乙烯酮中間體階段提前結(jié)束[49]。有趣的是,PcPKS1能同時(shí)催化合成柚皮素查爾酮和苯亞甲基丙酮,而且其催化活性、底物專一性與pH有關(guān)[50]。另外,PcPKS1呈現(xiàn)出極高的 BAS活性,其催化效率(Kcat/Km) 分別比Rp BAS和PcPKS2高1.5和70倍[50]。在 PcPKS1序列中,對(duì)應(yīng) CHS序列的Phe215和Phe265保守存在,預(yù)示PcPKS1須采用區(qū)別于典型 BAS的特異的重要氨基酸序列決定其BAS活性。為了闡明PcPKS1擁有CHS/BAS活性和高 BAS活性的結(jié)構(gòu)基礎(chǔ)和分子機(jī)理,針對(duì)PcPKS1和PcPKS2的突變和晶體結(jié)構(gòu)解析工作正在進(jìn)行中。
3.5 姜黃素合酶 (CUS) 和姜黃素合酶 1 (CURS1)
姜黃素是姜黃的主要成分,因其獨(dú)特的香氣和顏色廣被用于傳統(tǒng)的中藥和作為食物添加劑[1]。在近期有兩個(gè)研究組相繼報(bào)道了兩種不同的催化姜黃素合成的水稻CUS和姜黃CURS1的晶體結(jié)構(gòu)[33-35]。
3.5.1 姜黃素合酶 (CUS)
水稻Oryza sativa CUS催化兩分子的香豆酰輔酶A和一分子的丙二酰輔酶A縮合形成去二甲氧基姜黃素 (Bisdemethoxycurcumin) 的雙苯庚烷 (Diarylheptanoid) C6-C7-C6骨架[46]。Morita等報(bào)道的O. Sativa CUS晶體結(jié)構(gòu)與已知的類型Ⅲ PKS的整體結(jié)構(gòu)非常相似,呈現(xiàn)αβαβα折疊[33]。同時(shí),結(jié)構(gòu)揭示出其具有獨(dú)特的未被報(bào)道的向下擴(kuò)展的活性腔結(jié)構(gòu) (圖 4G)。擴(kuò)大的活性腔長(zhǎng)度足以容納C6-C3單元和1分子的香豆酰單元。酶結(jié)合中間體經(jīng)硫酯鍵斷裂產(chǎn)生香豆酰乙烯酮酸 (4-coumaroyldiketide acid),之后在向下延長(zhǎng)的口袋中進(jìn)行后續(xù)的第2個(gè)香豆酰輔酶A起始底物的脫羧縮合,產(chǎn)生去二甲氧基姜黃素(Bisdemethoxycurcumin)。基于結(jié)構(gòu)的定點(diǎn)突變M265L和G274F (對(duì)應(yīng)于M. sativa CHS2序列的G256和F265) 能夠改變底物產(chǎn)物專一性,接受4-hydroxyphenylpropionyl-CoA作為起始底物產(chǎn)生Tetrahydrobisdemethoxycurcumin。
Miyazono等幾乎同時(shí)報(bào)道了水稻CUS的結(jié)構(gòu),同樣具有加長(zhǎng)的活性腔[34],CUS活性腔的這種改變來自于門衛(wèi)氨基酸 Phe274 (對(duì)應(yīng) M. sativa CHS2 Phe 265) 被Gly所替代。活性腔最深部位距離Cys174位點(diǎn)約為15 ?,足以容納香豆酰乙烯酮酸作為延伸底物。
3.5.2 姜黃素合酶1 (CURS1)
姜黃Curcuma longa姜黃素合酶1 (CURS1)是另外一種催化姜黃素合成的家族成員,與CUS具有約45%的序列同一性[47-48]。在乙烯酮輔酶A合酶 (Diketide-CoA Synthase,DCS) 和CURS1同時(shí)存在時(shí),兩者順序作用對(duì)兩分子酵素輔酶A (Feruloyl-CoA) 和丙二酰輔酶A進(jìn)行高效縮合形成姜黃素C6-C7-C6骨架。在CURS1單獨(dú)存在時(shí),能以較低的活性利用同樣的底物獨(dú)立催化合成姜黃素分子骨架。除了CURS1外,在姜黃中還存在另外兩種姜黃素合酶CURS2和CURS3[48]。
C. longa CURS1的2.32 ?晶體結(jié)構(gòu)中顯示了輔酶A結(jié)合通道具有一個(gè)獨(dú)特的疏水腔[35](圖4H)。在生化實(shí)驗(yàn)中通過G211F突變能極大地降低酶的催化效力,在2.5 ?晶體結(jié)構(gòu)中顯示了這個(gè)疏水腔被Phe 211的側(cè)鏈占據(jù)。生化研究表明CURS1具有被擴(kuò)展的底物專一性,而且CURS1和β-酮酸之間的疏水相互作用對(duì)于CURS1利用缺少輔酶A基團(tuán)的底物非常重要。因此,結(jié)構(gòu)中出現(xiàn)的疏水腔可能負(fù)責(zé)CURS1和β-酮酸間相互作用,使β-酮酸基團(tuán)能夠有效進(jìn)入CURS1的催化位點(diǎn)進(jìn)行反應(yīng)。
4 總結(jié)和展望
植物類型Ⅲ PKS是植物聚酮化合物生物合成的關(guān)鍵酶,具有復(fù)雜多變的底物專一性、鏈延伸和不同的環(huán)化反應(yīng)機(jī)制。解析其三維空間結(jié)構(gòu)、對(duì)其活性中心構(gòu)象進(jìn)行精細(xì)的分析,以及基于定點(diǎn)突變的結(jié)構(gòu)功能分析是進(jìn)行酶工程、基因工程的基礎(chǔ)。基于結(jié)構(gòu)的分子改造不僅會(huì)產(chǎn)生具有合成全新化合物的蛋白分子,也會(huì)改變已有的蛋白催化效力。植物類型Ⅲ PKS結(jié)構(gòu)功能研究不僅具有理論研究?jī)r(jià)值,聚酮化合物的顯著多樣的生物學(xué)活性決定了,針對(duì)其結(jié)構(gòu)功能研究的應(yīng)用必將帶來巨大的社會(huì)價(jià)值。
[1] Schr?der J. Comprehensive Natural Products Chemistry. Elsevier: Oxford, 1999: 749?771.
[2] Austin MB, Noel JP. The chalcone synthase superfamily of type III polyketide synthases. Nat Prod Rep, 2003, 20(1): 79?110.
[3] Reimold U, Kr?ger M, Kreuzaler F, et al. Coding and 3’ non-coding nucleotide sequence of chalcone synthase mRNA and assignment of amino acid sequence of the enzyme. EMBO J, 1983, 2(10): 1801?1805.
[4] Ferrer JL, Jez JM, Bowman ME, et al. Structure of chalcone synthase and the molecular basis of plant polyketide biosynthesis. Nat Struct Biol, 1999, 6(8): 775?784.
[5] Jez JM, Bowman ME, Noel JP. Structure-guided programming of polyketide chain-length determination in chalcone synthase. Biochemistry, 2001, 40(49): 14829?14838.
[6] Jez JM, Ferrer JL, Bowman ME, et al. Dissection of malonyl-coenzyme A decarboxylation from polyketide formation in the reaction mechanism of a plant polyketide synthase. Biochemistry, 2000, 39(5): 890?902.
[7] Jez JM, Bowman ME, Noel JP. Expanding the biosynthetic repertoire of plant type III polyketide synthases by altering starter molecule specificity. Proc Natl Acad Sci USA, 2002, 99(8): 5319?5224.
[8] Jez JM, Austin MB, Ferrer JL, et al. Structural control of polyketide formation in plant-specific polyketide synthases. Chem Biol, 2000, 7(12): 919?930.
[9] Austin MB, Bowman ME, Ferrer JL, et al. An aldol switch discovered in stilbene synthases mediates cyclization specificity of type III polyketide synthases. Chem Biol, 2004, 11(9): 1179?1194.
[10] Morita H, Noguchi H, Schr?der J, et al. Novel polyketides synthesized with a higher plant stilbene synthase. Eur J Biochem, 2001, 268(13): 3759?3766.
[11] Shomura Y, Torayama I, Suh DY, et al. Crystal structure of stilbene synthase from Arachis hypogaea. Proteins, 2005, 60(4): 803?806.
[12] Abe I, Takahashi Y, Morita H, et al. Benzalacetone synthase. A novel polyketide synthase that plays a crucial role in the biosynthesis of phenylbutanones in Rheum palmatum. Eur J Biochem, 2001, 268(11): 3354?3359.
[13] Abe I, Sano Y, Takahashi Y, et al. Site-directed mutagenesis of benzalacetone synthase. The role of the Phe215 in plant type III polyketide synthases. J Biol Chem, 2003, 278(27): 25218?25226.
[14] Abe I, Abe T, Wanibuchi K, et al. Enzymatic formation of quinolone alkaloids by a plant type III polyketide synthase. Org Lett, 2006, 8(26): 6063?6065.
[15] Abe T, Morita H, Noma H, et al. Structure function analysis of benzalacetone synthase from Rheum palmatum. Bioorg Med Chem Lett, 2007, 17(11): 3161?3166.
[16] Morita H, Tanio M, Kondo S, et al. Crystallization and preliminary crystallographic analysis of a plant type III polyketide synthase that produces benzalacetone. Acta Crystallogr Sect F Struct Biol Cryst Commun, 2008, 64(4): 304?306.
[17] Morita H, Shimokawa Y, Tanio M, et al. A structure-based mechanism for benzalacetone synthase from Rheum palmatum. Proc Natl Acad Sci USA, 2010, 107(2): 669?673.
[18] Eckermann S, Schr?der G, Schmidt J, et al. New pathway to polyketides in plants. Nature, 1998, 396(6709): 387?390.
[19] Luka?in R, Springob K, Urbanke C, et al. Native acridone synthases I and II from Ruta graveolens L. form homodimers. FEBS Lett, 1999, 448(1): 135?140.
[20] Luka?in R, Schreiner S, Matern U. Transformation of acridone synthase to chalcone synthase. FEBS Lett, 2001, 508(3): 413?417.
[21] Wanibuchi K, Zhang P, Abe T, et al. An acridone-producing novel multifunctional type III polyketide synthase from Huperzia serrata. FEBS J, 2007, 274(4): 1073?1082.
[22] Morita H, Kondo S, Kato R, et al. Crystallization and preliminary crystallographic analysis of an acridone-producing novel multifunctional type III polyketide synthase from Huperzia serrata. Acta Crystallogr F, 2007, 63(Pt 7): 576?587.
[23] Abe I, Utsumi Y, Oguro S, et al. A plant Type III polyketide synthase that produces pentaketide chromone. J Am Chem Soc, 2005, 127(5): 1362?1363.
[24] Morita H, Kondo S, Oguro S, et al. Structural insight into chain-length control and product specificity of pentaketide chromone synthase from Aloe arborescens. Chem Biol, 2007, 14(4): 359?369.
[25] Abe I, Oguro S, Utsumi Y, et al. Engineered biosynthesis of plant polyketides: chain length control in an octaketide-producing plant type III polyketide synthase. J Am Chem Soc, 2005, 127(36): 12709?12716.
[26] Akiyama T, Shibuya M, Liu HM, et al. p-Coumaroyltriacetic acid synthase, a new homologue of chalcone synthase, from Hydrangea macrophylla var. thunbergii. Eur J Biochem, 1999, 263(3): 834?839.
[27] Preisig-Müller R, Gnau P, Kindl H. The inducible 9, 10-dihydrophenanthrene pathway: characterization and expression of bibenzyl synthase and S-adenosylhomocysteine hydrolase. Arch Biochem Biophys, 1995, 317(1): 201?207.
[28] Liu BY, Falkenstein-Paul H, Schmidt W, et al. Benzophenone synthase and chalcone synthase from Hypericum androsaemum cell cultures: cDNA cloning, functional expression, and site-directed mutagenesis of two polyketide synthases. Plant J, 2003, 34(6): 847?855.
[29] Liu B, Raeth T, Beuerle T, et al. Biphenyl synthase, a novel type III polyketide synthase. Planta, 2007, 225(6): 1495?1503.
[30] Abe I, Utsumi Y, Oguro S, et al. The first plant type III polyketide synthase that catalyzes formation of aromatic heptaketide. FEBS Lett, 2004, 562(1/3): 171?176.
[31] Zuurbier KW, Leser J, Berger T, et al. 4-Hydroxy-2-pyrone formation by chalcone and stilbene synthase with nonphysiological substrates. Phytochemistry, 1998, 49(7): 1945?1951.
[32] Suzuki H, Ikeda T, Matsumoto T, et al. Polyphenol components in cultured cells of Amacha (Hydrangea macrophylla Seiringe var. thunbergii Makino). Agric Biol Chem, 1978, 42(6): 1133?1137.
[33] Morita H, Wanibuchi K, Nii H, et al. Structural basis for the one-pot formation of the diarylheptanoid scaffold by curcuminoid synthase from Oryza sativa. Proc Natl Acad Sci USA, 2010, 107(46): 19778?19783.
[34] Miyazono KI, Um J, Imai FL, et al. Crystal structure of curcuminoid synthase CUS from Oryza sativa. Proteins, 2011, 79(2): 669?673.
[35] Katsuyama Y, Miyazono KI, Tanokura M, et al. Structural and biochemical elucidation of mechanism for decarboxylative condensation of β-keto acid by curcumin synthase. J Biol Chem, 2011, 286(8): 6659?6668.
[36] Ma LQ, Shi GL, Ye HC, et al. Plant-specific type III polyketide synthase superfamily: gene structure, function and metabolistes. Chin J Biotech, 2010, 26(11): 1482?1492.馬蘭青, 師光祿, 葉和春, 等. 植物類型 III聚酮合酶超家族基因結(jié)構(gòu)、功能及代謝產(chǎn)物. 生物工程學(xué)報(bào), 2010, 26(11): 1482?1492.
[37] Springob K, Luka?in R, Ernwein C, et al. Specificities of functionally expressed chalcone and acridone synthases from Ruta graveolens. Eur J Biochem, 2000, 267(22): 6552?6559.
[38] Luka?in R, Schreiner S, Silber K, et al. Starter substrate specificities of wild-type and mutant polyketide synthases from Rutaceae. Phytochemistry, 2005, 66(3): 277?284.
[39] Abe I, Watanabe T, Morita H, et al. Engineered biosynthesis of plant polyketides: manipulation of chalcone synthase. Org Lett, 2006, 8(3): 499?502.
[40] Morita H, Kondo S, Kato R, et al. Crystallization and preliminary crystallographic analysis of an octaketide-producing plant type III polyketide synthase. Acta Crystallogr Sect F Struct Biol Cryst Commun, 2007, 63(Pt 9): 947?949.
[41] Abe I, Watanabe T, Lou WW, et al. Active site residues governing substrate selectivity and polyketide chain length in aloesone synthase. FEBS J, 2006, 273(1): 208?218.
[42] Mizuuchi Y, Shimokawa Y, Wanibuchi K, et al. Structure function analysis of novel type III polyketide synthases from Arabidopsis thaliana. Biol Pharm Bull, 2008, 31(12): 2205?2210.
[43] Abe I, Morita H, Oguro S, et al. Structure-based engineering of a plant type III polyketide synthase: formation of an unnatural nonaketide naphthopyrone. J Am Chem Soc, 2007, 129(18): 5976?5980.
[44] Abe I. Engineering of plant polyketide biosynthesis. Chem Pharm Bull, 2008, 56(11):1505?1514.
[45] Abe I, Morita H. Structure and function of the chalcone synthase superfamily of plant type III polyketide synthases. Nat Prod Rep, 2010, 27(6): 809?838.
[46] Katsuyama Y, Matsuzawa M, Funa N, et al. In vitro synthesis of curcuminoids by type III polyketide synthase from Oryza sativa. J Biol Chem, 2007, 282(52): 37702?37709.
[47] Katsuyama Y, Kita T, Funa N, et al. Curcuminoid biosynthesis by two type III polyketide synthases in the herb Curcuma longa. J Biol Chem, 2009, 284(17): 11160?11170.
[48] Katsuyama Y, Kita T, Horinouchi S. Identification and characterization of multiple curcumin synthases from the herb Curcuma longa. FEBS Lett, 2009, 583(17): 2799?2803.
[49] Ma LQ, Pang XB, Shen HY, et al. A novel type III polyketide synthase encoded by a three-intron gene from Polygonum cuspidatum. Planta, 2009, 229(3): 457?469.
[50] Ma LQ, Guo YW, Gao DY, et al. Identification of a Polygonum cuspidatum three-intron gene encoding a type III polyketide synthase producing both naringenin and p-hydroxybenzalacetone. Planta, 2009, 229(5): 1077?1086.

