人參皂苷F1轉化菌株的原生質體誘變育種
孟飛,高紫維,孫明波,張怡軒
(沈陽藥科大學生命科學與生物制藥學院,遼寧沈陽110016)
人參皂苷F1(Ginsenoside F1,GF1)于1976年由Yahara等[1]在人參(Panax ginseng C.A.Meyer,Asian ginseng)葉中分離得到。經藥理研究表明,稀有GF1能夠抑制人體骨肉瘤細胞U2OS的增殖[2],減少UV-B導致的細胞死亡并防止UV-B誘發的人類HaCaT角化細胞凋亡[3]、拮抗人的血小板凝集[4]。但GF1在人參葉、花、果中的含量甚微,從天然人參中提取十分困難,因此GF1的獲得十分有限。然而人參皂苷Rg1(Ginsenoside Rg1,GRg1)獲得相對容易,它的結構與GF1十分相似[5],僅在C6位多一個糖基,去掉GRg1分子C6側鏈的O-Glc中的β-葡萄糖基,即可得到GF1。如何高效地獲得更多更純的GF1,具有極其重要的藥用價值和經濟意義。利用微生物轉化制備稀有人參皂苷已成為獲得稀有人參皂苷的有效途徑[6-8]。目前采用微生物轉化GRg1的研究報道較少,且產物多為GRh1[9]。本實驗室篩選保藏的1株真菌菌核青霉(Penicillium sclero-tiorum)2246,所產生的酶能特異性水解GRg1C6位上的葡萄糖基,生成GF1[10],但其轉化率不高,且轉化能力不穩定。原生質體誘變技術是一種行之有效的菌種選育技術,由于微生物原生質體去除了細胞壁,外界的物質很容易穿透細胞膜進入細胞內,造成原生質體對外界各種誘變因子的敏感性大大增強,應用誘變劑對原生質體進行處理,有可能在短期內獲得產量高、生產性能好的菌株。本實驗通過對菌株2246原生質體制備和再生過程中的幾個重要影響因素進行研究,確定了原生質體制備和再生的最佳條件,并對原生質體進行了亞硝基胍(NTG)復合紫外誘變,以期提高菌株2246將GRg1轉化為GF1的能力,提高其轉化率。
1 材料與方法
1.1 材料
1.1.1 菌株菌核青霉2246(Penicillium sclerotiorum)[11],本實驗室保藏。
1.1.2 培養基①生孢培養基(PDA):葡萄糖10.0 g,瓊脂20.0 g,馬鈴薯浸汁(去皮馬鈴薯200.0 g,切成塊狀,加蒸餾水1 L煮沸30 min,4層紗布過濾得浸汁)定容至1 L,pH 7.2~7.5;②菌絲生長培養基:葡萄糖10.0 g,蔗糖10.0 g,花生餅粉5.0 g,蛋白胨10.0 g,KH2PO43.0 g,MgSO4·7H2O 3.0 g,NH4Cl 10.0 g蒸餾水定容至1 L。121℃滅菌20 min;③查氏培養基:NaNO32.0 g,K2HPO41.0 g,KCl 0.5 g,MgSO4·7H2O 0.5 g,FeSO40.01 g,蔗糖30.0 g,瓊脂20.0 g,蒸餾水1 L,pH自然。121℃滅菌20 min;④沙氏培養基:蛋白胨10.0 g,葡萄糖40.0 g,NaCl 5.0 g,瓊脂20.0 g,蒸餾水1 L,pH自然。121℃滅菌20 min;⑤再生固體培養基:PDA培養基中加入相應的滲透壓穩定劑;⑥初篩培養基:PDA培養基中加入0.3%的GRg1作為底物;⑦復篩培養基:葡萄糖20.0 g,玉米粉5.0 g,藥媒10.0 g,酵母粉10.0 g,KH2PO43.0 g,MgSO4·7H2O 3.0 g蒸餾水定容至1 L。121℃滅菌20 min。
1.1.3 試劑溶壁酶(Lywallzyme)購自廣東省微生物研究所,纖維素酶(Cellulase)與蝸牛酶(Snailase)購自索來寶公司,亞硝基胍(NTG)購自Fluka公司。
1.2 方法
1.2.1 原生質體的制備取新鮮斜面孢子適量,接種于菌絲生長培養基,28℃搖瓶振蕩(160 r/min)培養24 h,4 000 r/min離心10 min收集菌絲體,蒸餾水洗滌2次,滲透壓穩定液洗滌1次,離心得菌絲體,并用滅過菌的濾紙吸干菌絲體上的水分。按照每200 mg菌絲體加入1 mL混合酶液(酶液配制:稱取一定量的酶,用滲透壓穩定劑配制成一定濃度,用微孔濾膜過濾除菌),向上述菌絲體中加入相應體積的酶解液,31℃酶解2 h,每30 min鏡檢1次觀察原生質體形成情況。酶解后,原生質體與菌絲碎片混雜,用3層無菌擦鏡紙過濾除去菌絲碎片和未被酶解的菌絲體分離出原生質體。將濾液3 000 r/min離心10 min,棄去上清液,用滲透壓穩定液(用0.1 mol/L pH 5.5~6.0的磷酸緩沖液配制0.8 mol/L KCl)洗滌原生質體沉淀2次,以解除酶解作用。將得到的原生質體懸浮于滲透壓穩定液中,顯微鏡下計數。
1.2.2 原生質體再生將制備的原生質體懸液用滲透壓穩定液適當稀釋后,取0.2 mL涂布再生平皿,同時將原生質體懸液用無菌水適當稀釋后,靜置裂解30 min,取0.2 mL涂布再生平皿作為對照。所有平皿置28℃培養,計算原生質體再生率。原生質體再生率=((高滲培養基菌落數-普通培養基菌落數)/培養基上接種的原生質體個數)×100%。
1.2.3 原生質體的誘變取上述制備的原生質體懸浮液,加入適量濃度為20 mg/mL的NTG溶液使其終濃度為0.6 mg/mL,30℃水浴保溫30 min,然后用滲透壓穩定液進行梯度稀釋涂再生平板,并用紫外燈(30 W距離30 cm)照射30 s,28℃避光培養。以未經過NTG和紫外復合誘變的原生質體為對照。計算原生質體再生株致死率。
1.2.4突變株的篩選方法①初篩:將誘變后再生培養基上生長好的單菌落,用竹簽轉接到含有GRg1的初篩培養基制成的瓊脂塊上,每1菌株點2個瓊脂塊,并且同時做斜面,保留備用。接種后的瓊脂塊在28℃條件下,保濕培養3~4 d。將培養好的瓊脂塊放入EP管中,加入1 mL正丁醇萃取12 h,進行TLC檢測,點樣量5 μL,展開劑CHCl3/MeOH/H2O(7/3/1,體積比)展開,揮干溶劑,噴10%(體積比)H2SO4-EtOH于105℃下顯色。選取轉化產物GF1斑點顏色較深的菌株進行復篩;②復篩:將初篩獲得的菌株,接入三角瓶復篩培養基中,于28℃160 r/min的搖床上培養36 h,以10%轉種量轉種,培養48 h后,投入GRg1(終濃度為0.6%,質量體積比)28℃繼續培養4 d。轉化結束后,HPLC測定GF1含量,色譜條件為檢測波長203 nm,流動相為甲醇、水,體積比為65∶35,柱溫40℃,流速為1 mL/min。
1.2.5 遺傳穩定性試驗連續傳代5次并搖瓶發酵培養,測定GF1的產量,并觀察其遺傳穩定性。
2 結果與分析
2.1 原生質體制備
2.1.1 培養基對原生質體形成的影響培養基成分不同可導致細胞壁結構的差異,這種差異又導致了細胞壁對酶的敏感度不同,從而使菌絲細胞釋放的原生質體量有差別[12]。本實驗考察了PDA、菌絲生長培養基、查氏培養基、沙氏培養基對原生質體形成的影響,結果菌株在PDA、查氏、沙氏3種液體培養基中極易結團形成致密的小球,阻礙酶和菌絲體的接觸,不利于原生質體形成。而菌絲生長培養基培養的菌絲體量大,菌絲舒張,狀態好,結團不明顯,能夠較好地形成原生質體。
2.1.2 菌齡對原生質體形成的影響微生物的生理狀態是決定原生質體產量的主要因素之一,絲狀真菌一般在菌絲體對數生長的早期階段產生原生質體的數量多,但并非菌絲越嫩越利于酶解。菌絲只是在其生長的某個階段對混合酶液最為敏感,在此階段酶解效果較好,過早或過晚都不利于酶解,這有可能是因為菌絲生長的不同階段其細胞壁的結構組成不同,從而導致對混合酶液的敏感度不同[13]。因此有必要對用于原生質體制備和再生的菌絲體菌齡進行考察。分別取培養18、24、30、36 h的菌絲體制備原生質體,從實驗結果(圖1)可見菌齡對原生質體的形成影響很大,培養24 h的菌絲其原生質體的產量最高,達到1.8×106個/mL。
2.1.3 酶濃度對原生質體形成的影響適宜的酶濃度是影響原生質體制備的重要因素,酶濃度過大或過小都不利于原生質體形成。本實驗選取不同質量濃度的蝸牛酶、溶壁酶、纖維素酶來探討混合酶液對原生質體形成量的影響。從表1中可以看出,當溶壁酶、蝸牛酶、纖維素酶配比為1∶1∶1,且濃度為5 mg/mL時原生質體形成率和再生率最高。
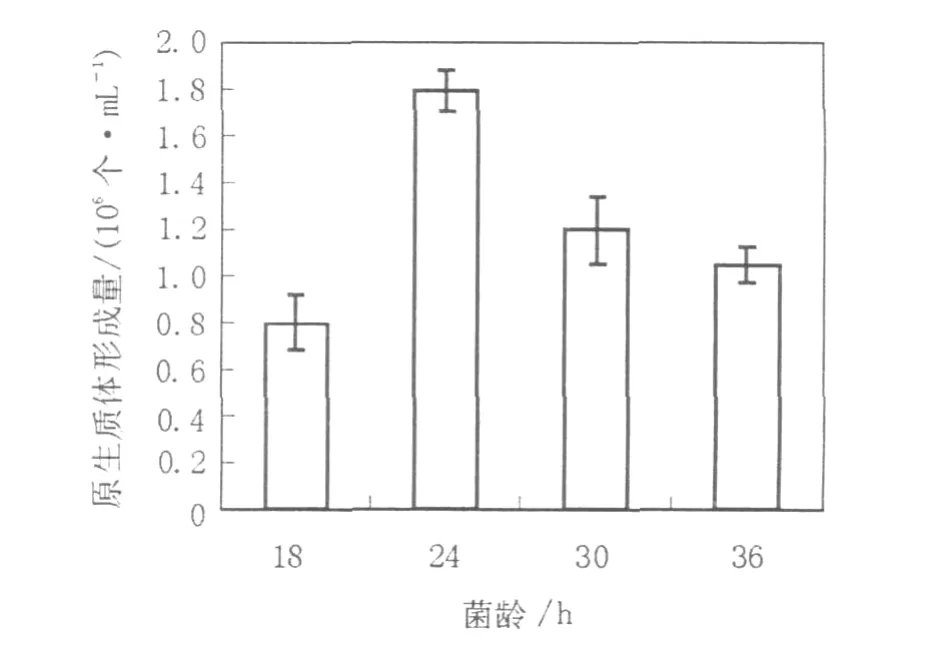
圖1 菌齡對菌核青霉2246原生質體形成的影響Fig.1 Effect of incubation time on the protoplasts release of P.sclerotiorum 2246
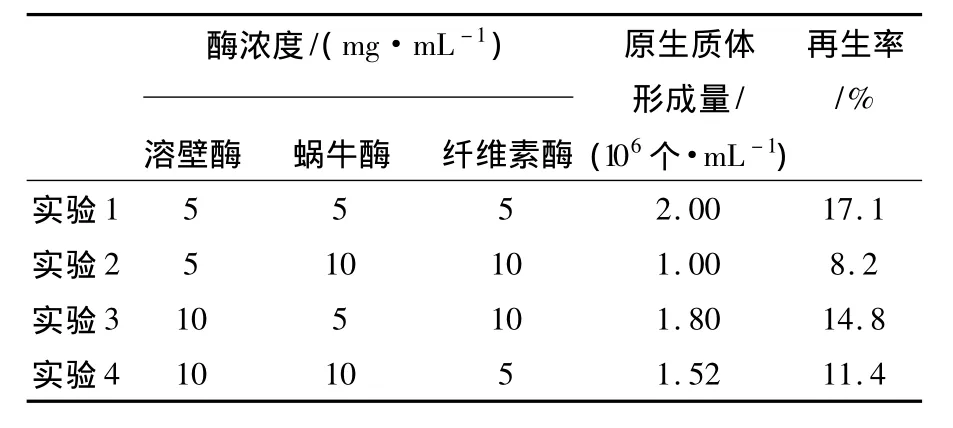
表1 酶濃度和配比對菌核青霉2246原生質體形成的影響Table 1 Effect of concentrations and ratio of the enzymes on the protoplasts release of P.sclerotiorum 2246
2.1.4 滲透壓穩定劑對原生質體形成的影響分別選用0.8 mol/L的NaCl、KCl、MgSO4、蔗糖、甘露醇等5種溶液作為滲透壓穩定劑,比較各種滲透壓穩定劑對原生質體形成量的影響,結果見圖2A。實驗結果顯示,不同的滲透壓穩定劑對原生質體的形成有著明顯的影響,無機鹽類NaCl、KCl均能有效地制備原生質體,與文獻[14]報道一致。對0.6、0.7、0.8、0.9 mol/L 4個不同濃度的KCl滲透壓穩定劑進一步深入考察,發現0.8 mol/L的KCl溶液作為滲透壓穩定劑得到的原生質體數目最多(圖2B),制備的原生質體數可達到3×106個/mL。
2.1.5 酶解時間和溫度對原生質體的影響由于裂解細胞壁的酶中含有幾丁質酶、蛋白酶等多種酶組分,酶解時間過長或溫度過高可能會損害原生質體質膜,影響原生質體的形成,因此本實驗采用了不同的酶解時間和不同的酶解溫度,考察酶解時間和酶解溫度對原生質體形成的影響。確定最佳酶解時間為1.5~2 h(圖3A),溫度為31℃(圖3B)。
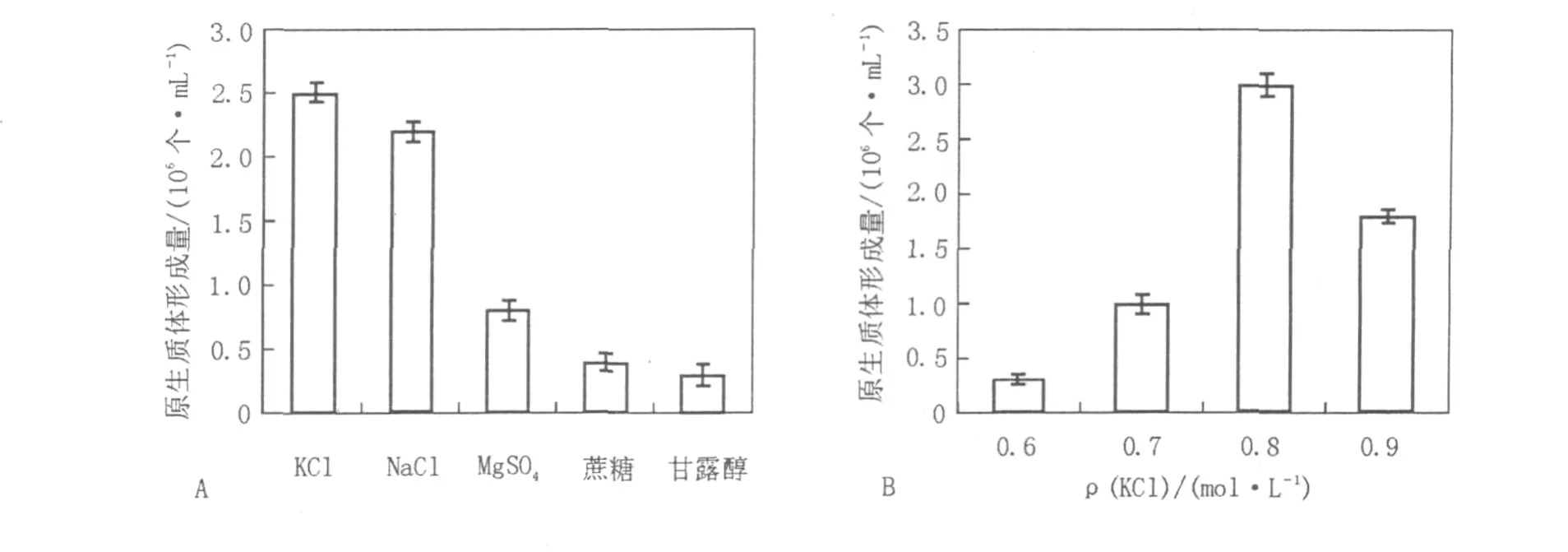
圖2 滲透壓穩定劑對菌核青霉2246原生質體形成的影響Fig.2 Effect of osmotic pressure stabilizer on the protoplasts release of P.sclerotiorum 2246
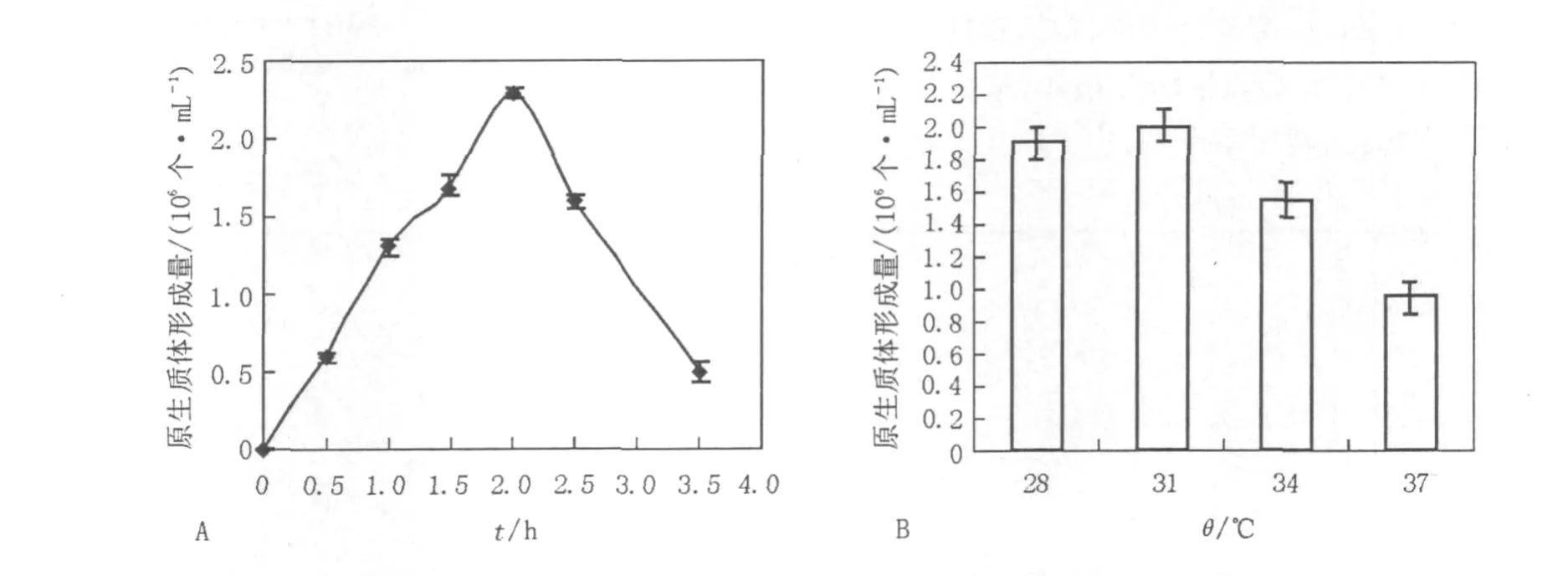
圖3 酶解時間和溫度對菌核青霉2246原生質體形成的影響Fig.3 Effect of digesting time and temperature on the protoplasts release of P.sclerotiorum 2246
2.2 原生質體再生
2.2.1 再生培養基的選擇本實驗比較了PDA、查氏、沙氏3種不同的再生固體培養基對原生質體再生的影響,結果見表2。PDA與沙氏培養基有利于原生質體再生,原生質體在PDA培養基與沙氏培養基上的再生率分別為10.6%和18.2%。但沙氏培養基上生長的菌落較小,生長緩慢,而查氏培養基再生效果較差,再生率只有1.17%。因此,選用PDA高滲培養基作為原生質體再生培養基。

表2 不同再生培養基對原生質質體再生的影響Table 2 Effect of different regeneration media on the regeneration rate of protoplasts
2.3 原生質體形成過程觀察
取不同酶解時間的酶解液觀察原生質體的形成情況,酶解0.5 h后開始有原生質體釋放,大多數原生質體從菌絲頂端釋放,但是形成的量較少。酶解1 h后,菌絲碎片增多,原生質體開始大量形成。酶解1.5~2 h時形成大量菌絲片段,原生質體呈圓球形,且大小不一,同時原生質體數達到最大值,繼續酶解原生質體開始破裂,數量減少。
2.4 原生質體的誘變
2.4.1 原生質體再生株致死率曲線將稀釋到(1~2)×105個/mL的原生質體與不同濃度的NTG作用30 min后終止反應,各取0.2 mL菌懸液、稀釋涂平板,紫外線照射30 s,避光培養72 h,計算致死率,致死曲線見圖4。由圖4可知,致死率隨NTG濃度的升高而增加,NTG濃度在0.6 mg/mL,菌體致死率在80%左右。但采用高致死率的誘變劑量會大大影響原生質體的再生,因此,綜合考慮原生質體再生率與正突變機率存在范圍,選取0.6 mg/mL作為最佳誘變劑量。
2.4.2 誘變育種結果從原生質體誘變后的再生菌株中,選取680株菌進行初篩,挑選在薄層板上GF1斑點顏色比出發菌株深的菌株,按照復篩方法進行生物轉化,轉化結束后,用HPLC外標法測定GF1的產量,結果見圖5。出發菌株經過多次的誘變篩選,最后得到1株轉化率高達30.5%的菌株(NU-1),較出發菌株16.7%的轉化率提高了13.8%。
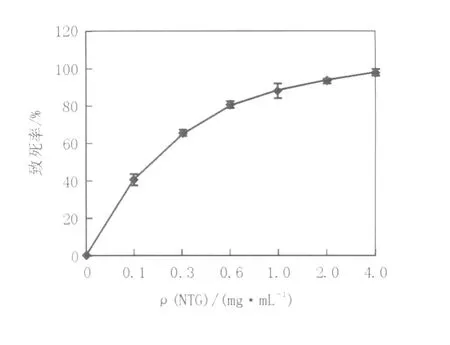
圖4 不同濃度NTG對原生質體致死率的影響Fig.4 Effect of different NTG concentrations on the death rate of protoplasts
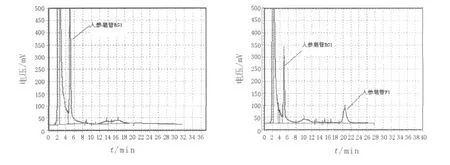
圖5 GRg1與轉化產物GF1的HPLC檢測圖Fig.5 HPLC analysis of GRg1and its transformation product GF1
2.4.3 遺傳穩定性試驗將篩選獲得的高轉化率菌株(NU-1)連續傳代培養5次,搖瓶發酵培養,HPLC測定GF1的產量,觀察其遺傳穩定性。試驗結果表明,此菌株遺傳穩定性強,連續傳代的轉化率穩定在28.5%~31%之間。
3 討論
在影響菌核青霉2246菌株原生質體形成的因素中,主要影響因子為酶系統。不同的微生物細胞壁的組成不完全相同,霉菌細胞壁的主要成分為纖維素、幾丁質,通常采用蝸牛酶、纖維素酶等來水解細胞壁,通過對酶解濃度、溫度、時間、菌齡等因素的考察分析,確定菌株原生質體形成與再生的最佳條件為菌絲體培養24 h,用5 mg/mL溶壁酶、5 mg/mL纖維素酶、5 mg/mL蝸牛酶的混合酶液酶解,以0.8 mol/L的KCl作為滲透壓穩定劑,31℃水浴中酶解2 h。在此條件下原生質體的形成量達到(2.0~3.0)×106個/mL,再生率為18.2%。
不同的青霉菌原生質體制備的條件也不相同,比較斜臥青霉[13]、指狀青霉[14]、蕁麻青霉[15]等原生質體的制備條件,菌齡大都采用對數期較幼嫩的菌絲,由于不同的菌株細胞壁結構成分存在差異,所以需要采用的酶的種類、酶的配比和濃度、酶解時間、酶解溫度也不盡相同。由此可見,雖然有些菌同屬,但進行原生質體制備時,也有必要探討其最佳的原生質體形成條件。
原生質體由于失去了細胞壁,對外界環境的影響更加敏感。誘變劑很容易透過細胞膜,直接作用于遺傳物質(DNA),從而引發較強強度的誘變[16]。原生質體誘變技術已經應用于很多菌種的誘變選育中,成為國內外進行菌種改造的一種有效途徑。張玲等[17]利用原生質體誘變技術獲得1株β-葡萄糖苷酶酶活顯著提高的突變菌株。此外,由于紫外線與亞硝基胍作用于DNA時,其作用位點不一樣,有更多的誘變“熱點”,可以避免采用單一誘變劑多次誘變出現的“飽和”[18]。為了進一步提高該菌株的轉化率,本研究用原生質體的誘變選育技術,采用NTG紫外復合誘變,得到1株轉化率高達30.5%的菌株,較出發菌株16.7%的轉化率提高了13.8%。實驗結果表明,原生質體NTG和UV復合誘變是對該菌株行之有效的選育方法,通過該菌進行GRg1的生物轉化,制備GF1具有工業化應用的前景。
[1] Yahara S,Tanaka O,Komori T.Saponins of the leaves of Panax ginseng[J].Chemical and Pharmaceutical Bulletin,1976,24:2204-2208.
[2] 張有為,竇德強,陳英杰,等.人參皂苷對人體骨肉瘤細胞U2OS增殖的影響[J].中草藥,2001,32(3):232-236.
[3] Lee EH,Cho SY,Kim SJ,et al.Ginsenoside F1Protects Human HaCaT Keratinocytes from Ultraviolet-B-Induced Apoptosis by Maintaining Constant Levels of Bcl-2[J].Journal of Investigative Dermatology,2003,121(3):607-613.
[4] Wang J,Huang ZG,Cao H,et al.Screening of anti-platelet aggregation agents from Panax notoginseng using human platelet extraction and HPLC-DAD-ESI-MS/MS[J].Journal of Separation Science,2008,31(6-7):1173-1180.
[5] 吳秀麗,張怡軒,趙文倩,等.真菌EST-Ⅰ及EST-Ⅱ對人參皂苷Rg1定向轉化為人參皂苷F1的研究[J].沈陽藥科大學學報,2008,25(1):73-76.
[6] Sung-Ryong Ko,Kang-Ju Choi,Yukio Suzuki.Enzymatic preparation of ginsenosides Rg2,Rh1,and F1[J].Chemical and Pharmaceutical Bulletin,2003,51(4):404-408.
[7] Chi H,Kim DH,Ji GE.Transformation of Ginsenosides Rb2and Rc from Panax ginseng by Food Microorganisms[J].Biological&pharmaceutical bulletin,2005,28(11):2102-2105.
[8] L.Q.Cheng,M.K.Kim,D.C.Yang,et al.Conversion of major ginsenoside Rb1to 20(S)ginsenoside Rg3by Microbacterium sp.GS514[J].Phytochemistry,2008,69(1):218-224.
[9] Dong AL,Cui YJ,Guo HZ,et al.Microbiological Transformation of Ginsenoside Rg1[J].Journal of Chinese Pharmaceutical Sciences,2001,10(3):115-118.
[10] Wei Ying,Zhao Wenqian,Zhang Yixuan.Purification and characterization of a novel and unique ginsenoside Rgrhydrolyzing β-D-Glucosidase from Penicillium sclerotiorum[J].Acta Biochimica et Biophysica Sinica,2011,43(3):226-231.
[11] 張琪,武玉久,張磊磊,等.兩株具有將人參皂苷Rg1轉化為人參皂苷F1活性的真菌鑒定[J].中國抗生素雜志,2010,35(5):395-398.
[12] 張志光,李東屏,郭建春,等.絲狀真菌原生質體技術研究—培養條件對原生質體的影響(VII)[J].湖南師范大學自然科學學報,1998,30(1):60-65.
[13] 趙晨,易宗春,榮龍,等.斜臥青霉原生質體制備和再生的研究[J].微生物學雜志,2009,29(1):18-21.
[14] 宋愛環,李紅葉,劉小紅.指狀青霉(Penicillium digitatum)原生質體制備和再生條件[J].農業生物技術學報,2004,12(2):197-201.
[15] 李小容,曾如意,楊民和,等.蕁麻青霉(Penicillium urticae)原生質體的制備與再生[J].福建師范大學學報(自然科學版),2009,25(4):76-83.
[16] 李秀珍,楊平平,王燕.黑曲霉原生質體誘變育種技術研究進展[J].中國釀造,2007,(12):1-4.
[17] 張玲,張芬琦,姚衛蓉.β-葡萄糖苷酶產生菌原生質體的誘變研究[J]食品研究與開發,2006,(10):62-64.
[18] 肖懷秋,李玉珍,蘭立新.復合誘變原生質體選育高產中性蛋白酶菌株[J].中國釀造,2008,(15):52-54.

