雞耳蝸EFNA2基因RNAi慢病毒載體的構建及其靶基因離體沉默效率*
余佳 向明亮 吳皓 沈晨凌
研究表明,鳥耳蝸毛細胞損傷后能夠完全再生、重獲神經再支配并完成神經再支配的重塑[1,2],隨著雞耳蝸毛細胞及其神經支配形態的恢復,其聽功能亦得以明顯恢復[3]。進一步的研究發現,ephrinA2在雞卡那霉素中毒后耳蝸毛細胞神經連接的再生及重塑過程中可能起重要作用[4,5]。慢病毒載體是一種復制缺陷型逆轉錄病毒載體,與化學合成的小干擾RNA(small interfering RNA,siRNA) 以及基于瞬時表達載體構建的短發卡RNA(short hairpin RNA,shRNA) 相比,它可以轉染后兩者難以轉染的細胞系如原代細胞、懸浮細胞和處于非分裂狀態的細胞,提高siRNA的轉染效率;此外,病毒攜帶的基因片段尚能夠整合至靶細胞基因組,提供長期穩定的siRNA表達,沉默靶基因[6]。為研究ephrinA2在雞卡那霉素中毒后耳蝸毛細胞神經連接的再生及重塑過程中的作用及作用機制,本研究擬構建編碼ephrinA2蛋白的EFNA2基因的RNA干擾(RNA interference,RNAi)慢病毒載體,并在離體培養的原代雞聽神經細胞中驗證其靶基因沉默效率,為后續在體實驗研究奠定基礎。
1 材料與方法
1.1實驗材料 健康純種、出生10~16 d羅曼雞10只,雌雄不拘(由上海歸興種雞廠提供)。病毒載體系統pFU-GW-iRNA(上海吉凱基因有限公司),293T細胞株(中科院上海細胞所),Lipofectamine 2000轉染試劑(Invirtrogen),限制性內切酶和T4 DNA連接酶(NEB),Taq酶(TaKaRa),質粒DNA提取試劑盒(Qiagen),SYBR Real-time PCR試劑盒(TaKaRa)。DMEM/F12、胎牛血清、胰酶、D-hanks液、B-27神經生長因子(Gibco),多聚賴氨酸(上海碧云天生物技術有限公司),鼠抗GFP抗體、鼠抗GAPDH抗體、羊抗鼠IgG抗體(Santa Cruz公司)。
1.2實驗方法
1.2.1EFNA2 RNAi慢病毒表達載體的構建 針對目的基因EFNA2(GeneBank:NM_204983 大小603 bp )的基因序列,按照RNA干擾序列的設計原則,設計、合成4個siRNA的寡核苷酸序列(KD-1、2、3、4,表1),并進行慢病毒載體的構建(雙鏈DNA具體序列見表2)。然后運用T4連接酶與經過限制性內切酶Hpa I、Xho I雙酶切后的pFU-GW-iRNA載體連接。用氯化鈣法制備新鮮的大腸桿菌感受態細胞,轉化大腸桿菌菌株,最后挑取陽性克隆進行PCR鑒定并進行測序分析。PCR鑒定陽性克隆的引物信息如下:Up (+) 5′- GCC CCG GTT AAT TTG CAT AT -3′; Down (-) 5′- GAG GCC AGA TCT TGG GTG -3′。
表1 siRNA序列信息

表2 siRNA病毒載體構建框架
1.2.2EFNA2過表達載體的構建 為后續外源篩靶的需要,同時構建EFNA2 過表達載體,具體方法如下:從含有目的基因EFNA2的質粒克隆模板中,利用PCR方法擴增目的基因,將PCR產物連接入Age I酶切后線性化pGC-FU 載體慢病毒載體中,純化酶切產物后進行定向連接、轉化,挑取菌落進行PCR鑒定并提取重組質粒及測序鑒定,將構建好的融合蛋白表達載體進行超純去內毒素抽提。
1.2.3EFNA2-RNAi干擾有效靶點的篩選 轉染前一天將293T細胞按5×104個/ml 接種于24 孔板中,待其生長達80%~90%融合時,按照下述實驗方案進行293T細胞轉染:實驗分成2大組,每孔分別使用0.25 μg和0.5 μg的干擾質粒,每大組分為6小組:EFNA2的過表達質粒(均為0.5 μg)與含有針對EFNA2的不同干擾靶點序列的RNAi病毒載體質粒混合,記為KD1~4組(干擾組1~4);與RNAi空載質粒混合記為MOCK組(轉染試劑對照組);與RNAi陰性對照病毒載體質粒混合記為NC組(陰性對照組)。同時設定不轉染任何質粒的293T細胞組記為CON組(空白對照組)。把質粒 DNA 與Lipofectamine 2000 (2 μl)的混合液加入293T 細胞中,37 ℃ 5% CO2培養箱中培養6~8 h,換成新鮮的含10%血清的完全培養液。轉染后24 h熒光顯微鏡下觀察預估轉染率,轉染率高于70%時,轉染后 36~48 h收集細胞,抽提總蛋白進行Western blot 檢測,進而判斷不同靶點的干擾效果,否則重新轉染。
1.2.4慢病毒顆粒的包裝和滴度測定 對含有效干擾靶點的shRNA進行慢病毒顆粒的包裝,將重組慢病毒pFU-GW-GFP載體及其兩種輔助包裝原件載體質粒pHelper1.0及pHelper2.0按Lipofectamine 2000 使用說明進行共轉染293T 細胞,轉染后8 h 更換為完全培養基,培養48 h 后,收集富含慢病毒顆粒的細胞上清液,將濃縮后得到的高滴度的慢病毒濃縮液,在293T 細胞中測定并標定病毒滴度,分裝后保存在病毒管中,-80 ℃長期保存。病毒濃縮液采用10倍逐孔稀釋滴度(10~10-6μl,8個梯度)測定法轉染293T細胞,繼續培養48 h后通過慢病毒載體上的GFP熒光來測定和計算病毒滴度。
1.2.5原代雞聽神經細胞的制備 將已麻醉的動物置于超凈臺上,解剖顯微鏡下解剖分離采取聽神經組織,置入預冷的D-HANKS液中,將聽神經組織置入0.25%胰酶和0.1%DNA酶中37 ℃下水浴消化30 min,酶解后加入含有血清的DMEM/F12培養液終止消化并離心(5 min,300 g),棄上清并加入2 ml終溶液(無血清的DMEM/F12培養液+2%B27神經生長因子+雙抗)[7],使用已消毒過火的玻璃滴管反復輕柔吹打組織進一步游離細胞,置于冰上靜置數分鐘后吸取上清液即獲得聽神經細胞懸液,反復上述操作,直至組織吹打成絮狀[8]。將收集的細胞懸液按1×106/孔細胞接種于已使用多聚賴氨酸包被的12孔板中,置于37 ℃ 5% CO2全自動恒溫孵箱中靜置培養,根據pH值及細胞生長情況更換培養液,待細胞融合度達到30%時轉染病毒。
1.2.6EFNA2 RNAi慢病毒感染原代雞聽神經細胞 實驗分為5組:CON(空白對照組)為正常目的細胞且未感染任何病毒的細胞組,NC(陰性對照組)為正常目的細胞但加陰性對照病毒感染的細胞組,KD1~3(干擾組1~3)為正常目的細胞加有RNAi靶點病毒感染的細胞組,1~3表示待篩選靶點病毒的序號。按實驗設計的分組情況加入感染復數(multiplicity of infection,MOI)為1的RNAi慢病毒顆粒進行感染實驗。感染72 h后采用熒光顯微鏡觀察慢病毒RNAi質粒上報告基因GFP的表達(綠色熒光),感染效率需達80%以上,否則重新感染。
1.2.7Quantative Real-time PCR法檢測EFNA2基因mRNA的表達 轉染后5 d收集感染效率達80%以上的細胞,使用Trizol按說明抽提總RNA,然后根據TAKARA反轉錄試劑盒的操作說明將RNA逆轉錄成cDNA。取 2 μl作為模板進行PCR反應,EFNA2上游引物:5'- CCC TGA ACG TGG TGG ACA GA- 3';下游引物:5'- GCA CGA GTT GTT GCT GGT GAA- 3'。β-actin 作為內參對目的基因EFNA2進行標準化,β-actin 上游引物:5'- AAA TAA AGC CAT GCC AAT CTC GTC- 3';下游引物:5'- ATT GTC CAC CGC AAA TGC TTC- 3'。PCR反應條件:預變性950C、15 s之后每一步變性950C、5 s,退火延伸600C、34 s;共進行40個循環,每次在延伸階段讀取吸光度值。Real-time PCR數值分析采用2-ΔΔCt分析法。
1.2.8統計學方法 采用SAS 9.13軟件統計包對數據進行統計學分析,具體方法為參數統計ANOVA檢驗法。
2 結果
2.1陽性克隆的PCR鑒定 含有正確插入RNA干擾慢病毒載體(virus-induced short-hairpin RNA,vshRNA)片段的重組克隆的PCR產物343 bp,未連接vshRNA片段的空載體PCR片段大小為299 bp,可見4種質粒均有4個克隆含有正確插入的片段(圖1),PCR鑒定為陽性的克隆,證明shRNA已經定向連入pFU-GW-iRNA表達載體,選取連接成功的克隆測序,測序結果表明合成的EFNA2 shRNA寡核苷酸鏈序列插入正確,shRNA慢病毒表達載體構建成功。
圖1 siRNA慢病毒表達質粒的PCR鑒定
2.2EFNA2基因的過表達載體pGC-FU-EFNA2-GFP的鑒定 對長出的克隆先進行PCR鑒定,菌落PCR顯示從重組質粒中可擴增出大小約807 bp的目的條帶(圖2),可見8個克隆中有4個為陽性克隆(EFNA2-2,4,6,8),用啟動子引物進行測序,測序結果證實已將EFNA2基因編碼框正確插入pGC-FU載體的多克隆位點(MCS),pGC-FU-EFNA2-GFP重組質粒構建成功。
圖2 EFNA2基因過表達融合蛋白載體pGC-FU-ELF-1-GFP PCR陽性克隆鑒定
2.3Western blot外源篩選靶點 使用凝膠圖像處理系統對實驗結果進行灰度分析(圖3),可以看出KD1、KD2、KD4靶點對目的基因的表達有敲減作用,因而是有效靶點。
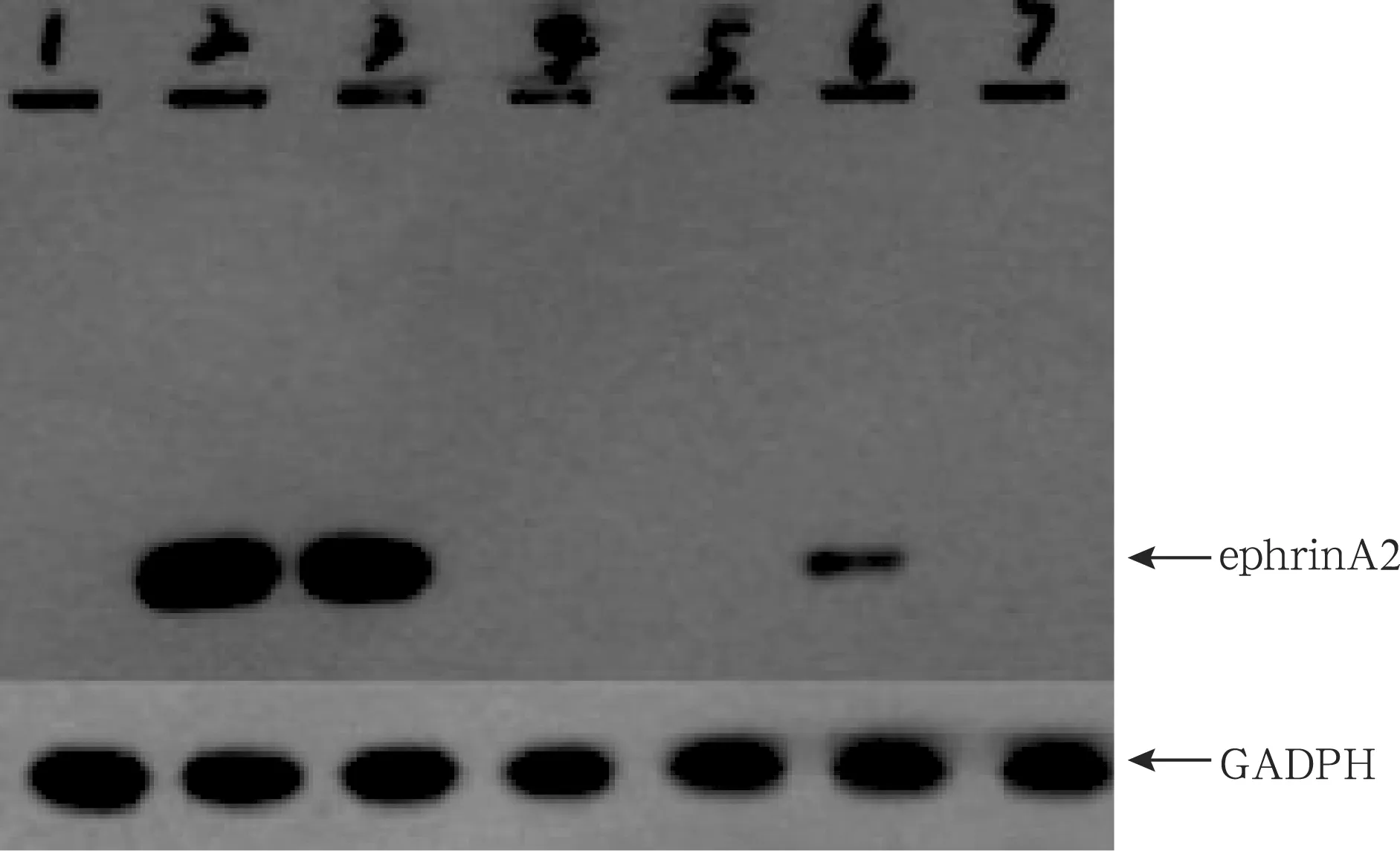
圖3 Western blot檢測293T細胞中ephrinA2蛋白的表達
2.4慢病毒載體的包裝及滴度測定 篩選出的3個有效重組載體(KD1、KD2、KD4)與慢病毒包裝質粒共轉染293T細胞,48 h后收集病毒粗提液進行濃縮,分別命名為LV-GFP-EFNA2-shRNA-l、LV-GFP-EFNA2-shRNA-2、LV-GFP=EFNA2-shRNA-3,利用孔稀釋法分別測定3個靶點的病毒滴度,結果均為2E+9 TU/ml,病毒成功包裝,可用于后續研究。
2.5目的細胞EFNA2 RNAi 效果檢測 3個不同干擾靶點的病毒分別感染正常目的細胞,轉染72小時后,在熒光顯微鏡下可觀察到慢病毒RNAi質粒上GFP(綠色熒光)的表達(表3,圖4)。轉染5 d后收集目的細胞提取總RNA逆轉錄,qRT-PCR檢測目的細胞中EFNA2 mRNA水平表達的變化情況,結果顯示三個干擾靶點均有干擾效果,其干擾效率分別為:LV-GFP-EFNA2-shRNA-1:76.11%, LV-GFP-EFNA2-shRNA-2:61.87%, LV-GFP-EFNA2-shRNA-3:68.44%。
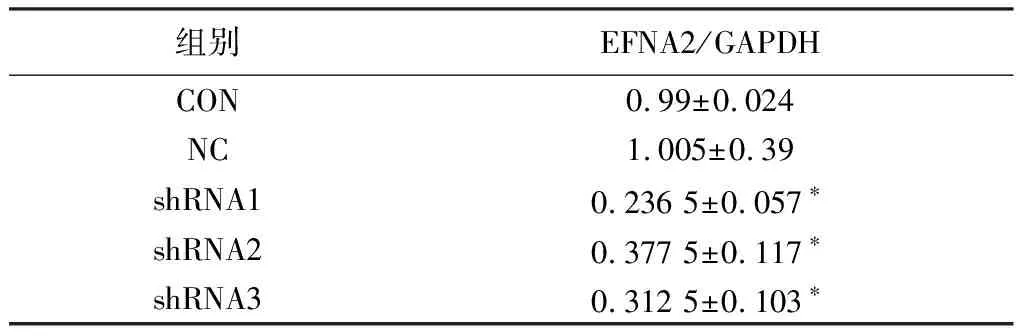
表3 目的細胞轉染5 d后EFNA2 mRNA表達水平( (2-ΔΔCt)
注:*與CON組和NC組比較,P< 0.05;CON:未感染慢病毒細胞組;NC:感染陰性對照病毒細胞組;shRNA1:感染LV-GFP-EFNA2-shRNA-1細胞組;shRNA2:感染LV-GFP-EFNA2-shRNA-2細胞組;shRNA3:感染LV-GFP-EFNA2-shRNA-3細胞組
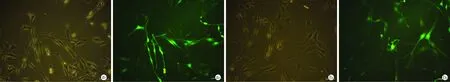

圖4 目的細胞EFNA2沉默效果檢測
3 討論
Ephrin作為已知的軸突導向分子之一,與其受體Eph相互作用可影響鳥類耳蝸以及聽覺神經系統的發育,在神經末梢準確地投射、定位、支配新生毛細胞的過程中發揮重要作用[9~11]。文獻報道,ephrinA2 及其受體EphA3等在胚胎雞的耳蝸神經節、位聽神經末梢組織中均有表達,并且其蛋白表達部位及量的差異,影響胚胎雞位聽神經靶標的選擇及其神經末梢的投射[11]。此前的研究[5]進一步顯示, ephrinA2在雞耳蝸毛細胞及其神經支配的損傷修復中可能有著重要作用, Lee亦有相似報道[4]。因此深入研究ephrinA2在鳥類耳蝸毛細胞及其神經支配的再生及重塑中的作用及作用機制將有助于闡明相關形態現象發生的分子基礎。
為進一步滿足在體動物實驗研究的需要,本研究的主要目的為構建包裝針對雞EFNA2基因的RNAi慢病毒載體,并在體外驗證其沉默靶基因的效率。根據GeneBank中編碼雞ephrinA2蛋白的EFNA2基因信息,本研究設計合成了4對干擾靶序列,分別與pFU-GW-iRNA載體連接,將連接產物轉化到能容許多外源DNA的載體分子通過的大腸桿菌感受態細胞,經PCR篩選陽性克隆、測序鑒定,測序結果與設計的序列一致,成功構建4對siRNA-EFNA2慢病毒載體。因實驗外源篩靶需要,同時構建目的基因過表達載體pGC-FU-EFNA2-GFP,陽性克隆測序序列與標準序列完全一致,說明目的基因已插入到真核表達載體中。siRNA-EFNA2病毒載體與目的基因的表達克隆質粒共轉染293T細胞,從Western Blot結果可以看出,在55 KD附近有陽性條帶,4個靶點中,KD1、KD2、KD4對目的基因的表達有較為顯著的敲減作用。將含有有效干擾靶點的重組載體經包裝后病毒滴度達到2.0×109TU/ml,分別命名為LV-GFP-EFNA2-shRNA-l、LV-GFP-EFNA2-shRNA-2、LV-GFP=EFNA2-shRNA-3。3個慢病毒載體分別感染原代雞聽神經細胞后,EFNA2基因表達均顯著降低。實驗結果表明,本研究構建的雞EFNA2基因的RNAi慢病毒載體在離體培養的原代雞聽神經細胞中能持續、高效、特異地抑制靶基因EFNA2的表達。本研究為下一步在體研究ephrinA2在雞卡那霉素中毒后耳蝸毛細胞神經連接的再生及重塑過程中的作用及作用機制奠定了研究基礎。
4 參考文獻
1 Ryals BM, Rubel EW. Hair cell regeneration after acoustic trauma in adult Coturnix quail [J]. Science, 1998, 240: 1 774.
2 Cruz RM, Lambert PR, Rubel EW. Light microscopic evidence of hair cell regeneration after gentamycin toxicity in chick cochlea [J]. Arch Otolaryngol Head Neck Surg, 1987, 113: 1 058.
3 Xiang ML, Mu MY, Pao X. Reinnervation of regenerated hair cells in the basilar papilla after kanamycine ototoxicity [J]. Acta Otolaryngol (Stockh), 2000, 120: 912.
4 Lee KH, Warchol ME. EphrinA2 may play a role in axon guidance during hair cell regeneration [J].Laryngoscope, 2005, 115: 1 021.
5 向明亮,吳皓,李蘊,等.雞卡那霉素中毒后EphrinA2蛋白表達與耳蝸毛細胞神經連接再生及重塑的關系[J].聽力學及言語疾病雜志,2009, 17:570.
6 Couto LB, High KA. Viral vector-mediated RNA interference [J]. Curr Opin Pharmacol, 2010, 10:534.
7 Kuenzel T, M?nig B, Wagner H, et al. Neuronal differentiation of the early embryonic auditory hindbrain of the chicken in primary culture [J]. Eur J Neurosci, 2007, 25: 974.
8 Zareen N, Greene LA. Protocol for culturing sympathetic neurons from rat superior cervical ganglia(SCG) [J]. Journal of Visualized Experiments, 2009,30:23.
9 Bianchi LM, Dinsio K, Davoli K, et al. Lac z Histochemistry and immunohistochemistry reveal ephrin-B ligand expression in the inner ear [J]. J Histochem Cytochem, 2002,50:1 641.
10 Cramer KS,Karam SD, Bothwell M, et al. Expression of EphB receptors and EphrinB ligands in the developing chick auditory brainstem [J]. J Comp Neurol, 2002, 452: 51.
11 Siddiqui SA, Cramer KS. Differential expression of Eph receptors and ephrins in the cochlear ganglion and eighth cranial nerve of the chick embryo [J]. J Comp Neurol, 2005, 482: 309.

