蘭索拉唑片的生物等效性研究*
張悅,張愛麗,李穆瓊,王寶龍,秦向陽,李曉曄,孫曉莉,文愛東
(1.第四軍醫大學藥學系化學教研室,西安 710032;2.第四軍醫大學西京醫院藥劑科,西安 710032)
蘭索拉唑(lansoprazole),化學名為2-{[3-甲基-4-(2,2,2-三氟乙氧基)-2-吡啶基]甲基}亞磺酰基-1H-苯并咪唑,是新型的抑制胃酸分泌的藥物,它作用于胃壁細胞的H+-K+-ATP酶[1],使壁細胞的H+不能轉運到胃,以致胃液中胃酸量顯著減少,臨床上用于十二指腸潰瘍、胃潰瘍、反流性食管炎及佐-艾(Zollinger-Ellison)綜合征(胃泌素瘤)的治療,療效顯著,對幽門螺桿菌(Helicobacter pylori,Hp)有抑制作用[2]。蘭索拉唑與奧美拉唑結構類似,其藥理活性也相似。但蘭索拉唑因在吡啶環4位側鏈導入氟并有三氟乙氧基取代基,使其生物利用度較奧美拉唑提高>30%,親脂性也強于奧美拉唑,因此本品在酸性條件下可迅速地透過壁細胞膜轉變為次磺酸和次磺酰衍生物而發揮藥效,對Hp的抑菌活性提高為奧美拉唑的4倍[3-5]。筆者對武漢中聯集團四藥藥業有限公司仿制藥蘭索拉唑建立高效液相色譜法 (high performance liquid chromatography,HPLC)檢測,并研究其生物等效性。
1 材料與方法
1.1 儀器 Dionex summit 680高效液相色譜儀,Dionex P680 HPLC PUMP,Thermostatted Column Compartment, PDA-100 photodiode Array Detector,Chromeleon工作站;H-1微型混合器(上海康禾光電儀器有限公司);超聲儀 KUDOS SK8200 LH,離心機Anke TGL-16 C,真空泵(鄭州杜甫儀器廠詩圣SHB-3循環水多用真空泵),S2-93自動雙重水蒸餾器(上海亞榮生化儀器廠)。
1.2 藥品與試劑 蘭索拉唑對照品(中國藥品生物制品檢定所,批號:100709-200501);受試制劑:蘭索拉唑片,武漢中聯集團四藥藥業有限公司,規格:每片30 mg,批號:20090301;參比制劑:蘭索拉唑片(可意林),揚子江藥業集團四川海蓉藥業有限公司,規格:每片15 mg。批號:09090601;內標:奧美拉唑(中國藥品生物制品檢定所,批號:100367-200702)。乙腈、甲醇均為色譜純(Calepure Promptar Company Ltd.),磷酸、氫氧化鈉、碳酸鈉、乙酸乙酯、三乙胺均為分析純(天津市富寧精細化工有限公司);實驗雙蒸水為實驗室自制;空白血漿及人體服藥后血漿均由第四軍大學西京醫院藥劑科提供。
1.3 色譜條件 色譜柱:Aglient C18(250 mm×5 mm,5μm);柱溫:40 ℃;檢測波長:285 nm;流速:1.0 mL·min-1;流動相:乙腈-1‰三乙胺水溶液(磷酸調pH至7.0)=30∶70。進樣量:20μL。
1.3.1 對照品溶液的配制 精密稱取蘭索拉唑對照品10 mg,置于10mL棕色量瓶,并用混合液(0.1 moL·L-1碳酸鈉溶液∶甲醇=50∶50)溶解定量至刻度線,得濃度為1 mg·mL-1的貯備液。再用混合液稀釋成濃度分別為0.10,0.01 mg·mL-1蘭索拉唑溶液。
1.3.2 內標液的配制 精密稱取奧美拉唑標準品7 mg于10 mL棕色量瓶,混合液稀釋至刻度線,振搖得濃度為0.7 mg·mL-1的奧美拉唑溶液。再用甲醇稀釋至濃度為0.07 mg·mL-1的內標液。
1.4 受試者選擇 20例健康男性志愿者,年齡18~40歲,體質量57.0~66.5 kg,經過體檢為健康者。血尿常規、肝腎功能及心電圖均正常;無同類藥物過敏史;受試者試驗前2周不服用其他任何藥物;試驗期間禁忌煙、酒、茶等;受試者自愿受試且簽訂知情同意書,并經過第四軍醫大學西京醫院醫學倫理委員會批準。
1.5 給藥與血樣采集 試驗采用標準二階段交叉設計自身對照試驗方法。受試者禁食12 h后,清晨空腹給藥,用溫開水吞服,服藥后4 h進統一食譜的標準餐。第一階段A組服用受試制劑,R組服用參比制劑。受試者口服藥物前抽取空白血樣4 mL,在服藥后0.75,1.0,1.5,2.0,2.5,3.0,3.5,4.0,5.0,6.0,8.0,10.0和12.0 h分別采集靜脈血4 mL,血漿置無菌試管中,于-20℃ 保存。第二階段A組服用參比制劑,R組服用受試制劑。其余方法與第一階段相同。全部過程在臨床醫師的監督指導下進行。
1.6 血樣處理方法 精確吸取1 mL血漿樣品置10 mL離心管中,加入0.07 mg·mL-1內標20μL及0.01 moL·L-1氫氧化鈉、0.1 moL·L-1碳酸鈉溶液各100μL,渦旋3 min,靜置10 min。移取乙酸乙酯4 mL加入試管內,渦旋混勻 3 min,離心 10 min(3 500 r·min-1)。將上清液全部移取至置潔凈試管中,氮氣37℃吹干。加入30%乙腈溶液300μL溶解殘渣,渦旋混勻1 min,離心3 min(3 500 r·min-1)后取上清液20μL進樣分析。
1.7 介質效應試驗 遞質效應主要用于考察血漿內源性和其他代謝物對樣品測定的干擾,以保證待測的物質是預期的分析物。本試驗通過考察空白生物樣品色譜圖、空白生物樣品外加對照物質色譜圖以及用藥后的生物樣品色譜圖來驗證本色譜法的可靠性和準確性。
1.7.1 標品制備 于10 mL離心管中分別加入適量的蘭索拉唑貯備液,使之成為濃度為 100,500,1 000 ng·mL-1的溶液,再加適量30%乙腈溶液,使總體積為300μL,混勻,離心,取上清液進樣分析。
1.7.2 樣品制備 取空白血漿1 mL置于10 mL離心管中,分別加入蘭索拉唑貯備液使之濃度為100,500,1 000 ng·mL-1,其余步驟按“1.6”項下處理,進樣分析。取患者服藥2 h之后的血漿按“1.6”項下處理,進樣分析。
1.8 數據處理 兩種制劑主要藥動學參數血藥峰濃度(Cmax)經對數轉換后,采用雙單側檢驗方法統計,達峰時間(tmax)采用Wilcoxon非參數秩和檢驗。
2 結果
2.1 血漿標準曲線及最低檢測限 于空白血漿1 mL中分別加入適量蘭索拉唑貯備液,使其濃度分別為50,100,200,400,800,1 600,2 400 ng·mL-1的蘭索拉唑溶液,加入內標液20μL,其余步驟按“1.6”項下處理方法進行色譜分析。由圖1可見,在本實驗條件下,色譜峰峰型好。血漿中的雜質不干擾測定,方法具有較強的專屬性。其中蘭索拉唑的保留時間為15.8 min,內標的保留時間為7.6 min。以藥物與內標峰面積之比(Y)為縱坐標,以所對應各點濃度(X)為橫坐標繪制標準曲線。得回歸方程:Y=0.000 755X-0.011 320,r=0.999 2。該結果表明蘭索拉唑在50~2 400 ng·mL-1范圍內呈良好的線性關系。本測定方法的最低定量下限為50 ng·mL-1。
2.2 精密度實驗 取空白血漿1.0 mL,分別加入適量蘭索拉唑貯備液,使成為濃度 100,500,1 000 ng·mL-1的蘭索拉唑溶液得血漿樣品各數份,按前述血漿樣品處理方法,于1 d內測定,得日內精密度RSD分別為3.7%,0.4%,0.6% 。于不同日反復測定,得日間精密度RSD分別為4.4%,2.9%,1.2% 。
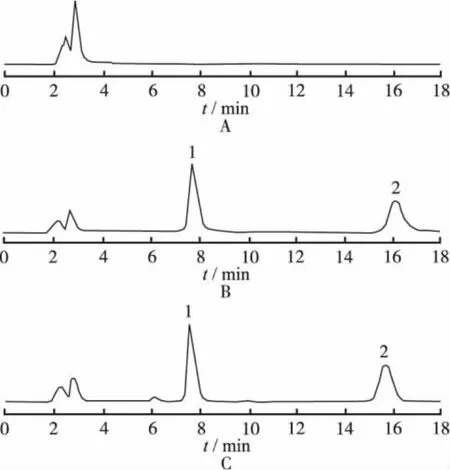
圖1 3種血漿的HPLC色譜圖A.空白血漿;B.空白血漿加對照品及內標;C.服用蘭索拉唑片2 h后血漿;1.奧美拉唑;2.蘭索拉唑Fig.1 HPLC chromatograms of 3 kinds of plasmas sam p lesA.blank plasma;B.blank plasma spiked with reference substance and internal standard;C.plasma sample at 2 h after administration of lansoprazole;1.omeprazole;2.lansoprazole
2.3 穩定性實驗 蘭索拉唑血漿樣品分別在室溫放置6,8,12,24 h 及2,3 d,反復凍融后操作,保持穩定,含量保留百分數平均值為93.47%。本實驗在血漿測定過程中,于每日平行測定低、中、高3種濃度的質控樣品,其測得值在真實值的±10%范圍內。
2.4 介質效應 由圖1可知,本實驗建立的色譜分析法能有效保證樣品與內源性物質和代謝物的完全分離,適用于蘭索拉唑的藥動學研究和臨床用藥監測。
2.5 藥動學參數 對數據的處理結果表明,20例健康志愿者服用受試制劑后血藥濃度-時間曲線下面積(concentration-time area under the curves,AUC)的 90%可信限落在參比制劑80.0% ~125.0%范圍內,Cmax的90%可信限落在參比制劑70.0%~143.0%范圍內,tmax經Wilcoxon符號秩和檢驗差異無統計學意義。受試制劑與參比制劑各主要藥動學參數間均差異無統計學意義(P>0.05),受試制劑對參比制劑的生物利用度為(95.6±32.8)%,在人體內具有生物等效性。志愿者服用兩種制劑后的平均血藥濃度-時間曲線圖見圖2,主要參數見表1。
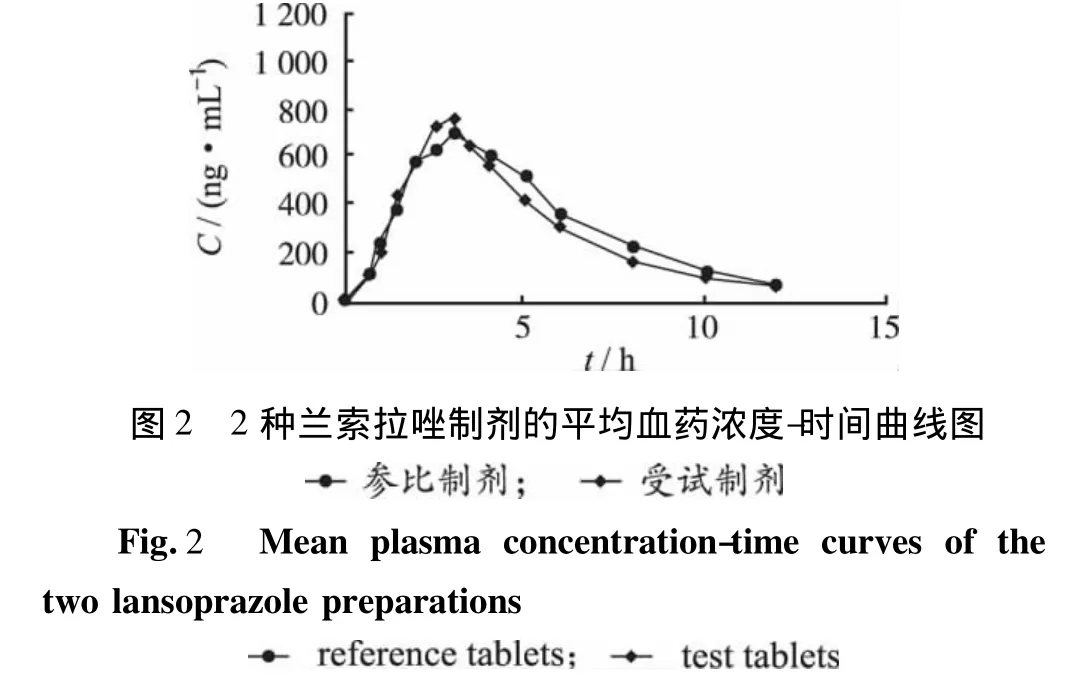
表1 健康受試者口服蘭索拉唑后的藥動學參數Tab.1 The pharmacokinetic parameters of the healthy volunteers after oral adm inistration w ith lansoprazole tablets±s
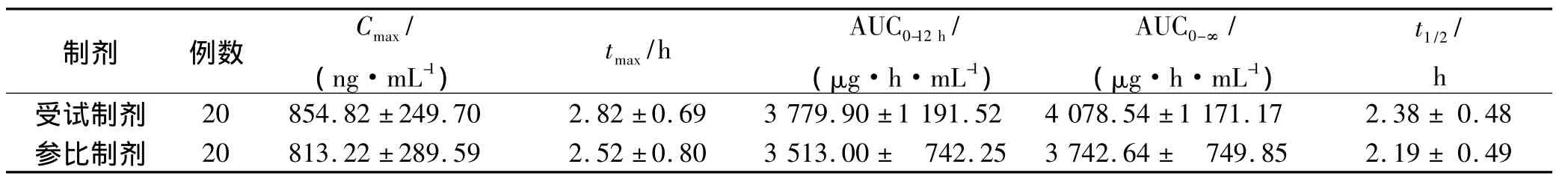
表1 健康受試者口服蘭索拉唑后的藥動學參數Tab.1 The pharmacokinetic parameters of the healthy volunteers after oral adm inistration w ith lansoprazole tablets±s
制劑 例數C max/(ng·mL-1)t max/h AUC0-12 h/(μg·h·mL-1)AUC0-∞/(μg·h·mL-1)t1/2/h受試制劑 20 854.82±249.70 2.82±0.69 3 779.90±1 191.52 4 078.54±1 171.17 2.38±0.48參比制劑 20 813.22±289.59 2.52±0.80 3 513.00± 742.25 3 742.64± 749.85 2.19±0.49
3 討論
3.1 色譜條件 目前,國內外文獻報道的有關本藥血漿濃度的測定方法較多,有電噴霧串聯質譜法[6],不常用;也曾嘗試過用熒光檢測器、蒸發光散射法,但效果不好,經摸索選定了紫外檢測法。流動相嘗試過甲醇∶水,甲醇∶乙腈,甲醇∶碳酸鹽緩沖液,經比較表明甲醇∶乙腈(30∶70)分離效果較好,在加入1‰三乙胺溶液之后,峰型明顯改善。嘗試酸性條件下pH=2.0分離效果并不好,而在pH=7.00±0.02、柱溫為40℃時效果最好。內標曾選擇對羥基苯甲酸乙酯、泮托拉唑等[7],后證實用奧美拉唑作為內標,能呈現較好的分離效果,出峰時間合適。
3.2 樣品處理方法 蘭索拉唑見光易分解,需避光保存樣品溶液,且保存在-4℃冰箱中。提取樣品時,筆者參考過不同的溶劑提取方法,有乙醚-二氯甲烷[8]、二氯甲烷-乙酸乙酯[9],操作過程較繁瑣,提取率較低,雜質較多。實驗結果證明乙酸乙酯分離提取的效果最佳。乙酸乙酯單次提取與多次提取實驗差異無統計學意義。
[1] MIROSHNICHENKO I I,YURCHENKO N I.HPLC analysis for omeprazole and lansoprazole in blood plasma[J].Pharm Chem J,2002,36(7):48-50.
[2] 李茜,鄧俊剛,喬建,等.蘭索拉唑片相對生物利用度與生物等效性研究[J].醫藥導報,2009,28(2):165-167.
[3] BARRADELL L B,FAULDS D,MCTAVISH D,et al.Lansoprazole,a review of its pharmacodynamic and pharmacokinetic properties and its therapeutic efficacy in acid-related disorders[J].Drugs,1992,44(2):225-227.
[4] ROBIN E P,RODRIGUES A D,JOYCE A,et al.Identification of the human P450enzymes involved in lansoprazole metabolism[J].JPharm Expe Ther ,1996,277(7):805-810.
[5] LINDBER G P,BRANDSTROM A,WALLMARK B,et al.Omeprazole:the first proton pump inhibitor[J].Med Res Rev,1990,10(1):1-3.
[6] CELSO H O,RAFAEL E B,EDUARDO A,et al.Lansoprazole quantification in human plasma by liquid chromatography-electrospray tandem mass spectrometry[J].JChromatogra B,2003,78(3):453-455.
[7] 李毅敏,陳麗字,馬麗鵑,等.蘭索拉唑血藥濃度的高效液相色譜(HPLC)測定[J].藥物分析雜志,1996,16(4):252-253.
[8] 胡靈,官常榮,崔曉宇,等.反相高效液相色譜法測定人血漿中的蘭索拉唑濃度[J].藥物分析雜志,2007,27(3):325-326.
[9] 曾曉暉,石磊,羅新根,等.反相高效液相色譜法測定人血漿中蘭索拉唑的濃度[J].中國藥師,2006,9(9):823-824.

