膠滴腫瘤藥敏檢測(cè)技術(shù)在胃癌術(shù)后化療中的應(yīng)用*
李照晉 譚志軍 姜 偉 韓 旭 張建良
胃癌是我國(guó)發(fā)病率和病死率均很高的惡性腫瘤之一,早期診斷困難,復(fù)發(fā)和轉(zhuǎn)移率高。化療在不可切除及術(shù)后復(fù)發(fā)轉(zhuǎn)移的晚期胃癌治療中占據(jù)重要地位。如何在化療開始前篩選出針對(duì)個(gè)體的抗癌藥,預(yù)測(cè)個(gè)體腫瘤對(duì)藥物的敏感性,指導(dǎo)臨床選擇最適化療方案以提高療效,已成為胃癌個(gè)體化化療的關(guān)鍵問(wèn)題。膠滴腫瘤藥敏檢測(cè)(collagen gel droplet culture drug-sensitivity test,CD-DST)技術(shù)是一種先進(jìn)的體外藥敏檢測(cè)方法,在臨床治療和腫瘤相關(guān)基礎(chǔ)研究應(yīng)用中已有成功的報(bào)道[1]。我院自2006年3月—2008年3月利用CD-DST技術(shù)選擇化療方案治療中晚期胃癌術(shù)后化療患者53例,取得較滿意效果。
1 資料與方法
1.1 一般資料 本組共53例,將其中對(duì)FOLFOX4方案(奧沙利鉑、5-氟尿嘧啶和亞葉酸鈣)至少1種藥物體外有效者31例作為實(shí)驗(yàn)組,男21例,女10例,平均年齡(63.77±9.41)歲,病理類型:腺癌17例,黏液腺癌9例,其他5例。將同期術(shù)后未經(jīng)CD-DST檢測(cè)而以FOLFOX4方案輔助化療的35例患者作為標(biāo)準(zhǔn)對(duì)照組,男26例,女9例,平均年齡(64.86±9.66)歲,病理類型:腺癌20例,黏液腺癌9例,其他6例。2組年齡(t=0.460)、性別(χ2=0.343)及病理類型(Z=0.115)差異無(wú)統(tǒng)計(jì)學(xué)意義(均P>0.05)。所有患者均經(jīng)病理診斷證實(shí),卡氏功能狀態(tài)(KPS)評(píng)分≥60分,術(shù)后預(yù)計(jì)生存時(shí)間≥12個(gè)月。所有患者術(shù)前均未行放、化療,均為術(shù)后輔助化療且無(wú)化療禁忌證。
1.2 主要試劑與儀器 DMEM培養(yǎng)基、胰蛋白酶及胎牛血清(天津?yàn)笊镏破房萍加邢薰荆皇笪材z原蛋白Ⅰ型(杭州生友生物技術(shù)有限公司);阿霉素、依托泊苷、奧沙利鉑(ADM、VP-16、L-OHP,江蘇恒瑞制藥有限公司);順鉑、5-氟尿嘧啶、絲裂霉素(DDP、5-FU、MMC,山東齊魯制藥有限公司);48孔板(美國(guó)Corning公司);倒置顯微鏡(日本Olympus公司);Image-proplus 6.0圖像分析系統(tǒng)(美國(guó)Media Cybernetics公司)。
1.3 CD-DST實(shí)驗(yàn) 無(wú)菌條件下切取新鮮腫瘤標(biāo)本,剪碎、消化后經(jīng)篩網(wǎng)過(guò)濾,離心后加入培養(yǎng)基獲得單細(xì)胞懸液。冰浴條件下制備膠原蛋白-細(xì)胞混合溶液,接種于48孔細(xì)胞培養(yǎng)板。培養(yǎng)24 h后加入抗癌藥物,藥物測(cè)試濃度參考文獻(xiàn)[2]:阿霉素0.02 mg/L、依托泊苷0.10 mg/L、順鉑1.00 mg/L、5-氟尿嘧啶0.02 mg/L、絲裂霉素0.03 mg/L、奧沙利鉑1.00 mg/L。同時(shí)設(shè)不加藥陰性對(duì)照孔,繼續(xù)培養(yǎng)24 h。中性紅染色甲醛固定后,利用倒置顯微鏡拍照,利用圖像分析軟件計(jì)算腫瘤細(xì)胞數(shù)量。加藥處理組細(xì)胞數(shù)量與陰性對(duì)照組細(xì)胞數(shù)量的百分比值≤50%則認(rèn)為藥物在體外有效,即腫瘤對(duì)該藥物敏感。
1.4 治療方法 2組患者均給予FOLFOX4方案治療,方法:奧沙利鉑85 mg/m2,靜脈滴注2 h,第1天;亞葉酸鈣200 mg/m2,靜脈滴注2 h,第1、2天;氟尿嘧啶400 mg/m2,靜脈注射,第1、2天,600 mg/m2持續(xù)靜脈滴注22 h,第1、2天。每2周重復(fù)。所有患者至少接受6周化療。每次化療前檢查血常規(guī)、肝腎功能和心電圖,化療期間每周復(fù)查血常規(guī)2次,化療結(jié)束后定期復(fù)查腹部B超和(或)CT。療效評(píng)定標(biāo)準(zhǔn):采用回顧性分析法,評(píng)價(jià)1、3年無(wú)病生存率和1、3年總生存率。疾病無(wú)病生存時(shí)間為自化療開始至腫瘤病灶出現(xiàn)復(fù)發(fā)轉(zhuǎn)移或疾病進(jìn)展的時(shí)間間隔。總生存時(shí)間為自治療開始至死亡或末次隨訪的時(shí)間間隔。不良反應(yīng)按WHO抗癌藥物急性與亞急性毒性表現(xiàn)和分度標(biāo)準(zhǔn)[3]觀察和判斷。
1.5 統(tǒng)計(jì)學(xué)方法 采用SPSS 16.0統(tǒng)計(jì)軟件分析,符合正態(tài)分布的計(jì)量資料以±s表示,行t檢驗(yàn),計(jì)數(shù)資料以例(%)表示,采用χ2或秩和檢驗(yàn),P<0.05為差異有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果
2.1 體外藥敏檢測(cè)結(jié)果 53例患者中有8例對(duì)6種藥物均不敏感,26例(49.1%)只對(duì)1種藥物敏感,13例(24.5%)對(duì)2種藥物敏感,4例(7.5%)對(duì)3種藥物敏感,2例(3.8%)對(duì)4種藥物敏感。具體為對(duì)阿霉素敏感者10例(18.9%)、依托泊苷9例(17.0%)、順鉑12例(22.6%)、5-氟尿嘧啶16例(30.2%)、絲裂霉素7例(13.2%)、奧沙利鉑18例(34.0%)。
2.2 2組的生存率比較 實(shí)驗(yàn)組的1年和3年無(wú)病生存率和總生存率均高于對(duì)照組,但只有3年總生存率差異有統(tǒng)計(jì)學(xué)意義(P<0.05),見表1。
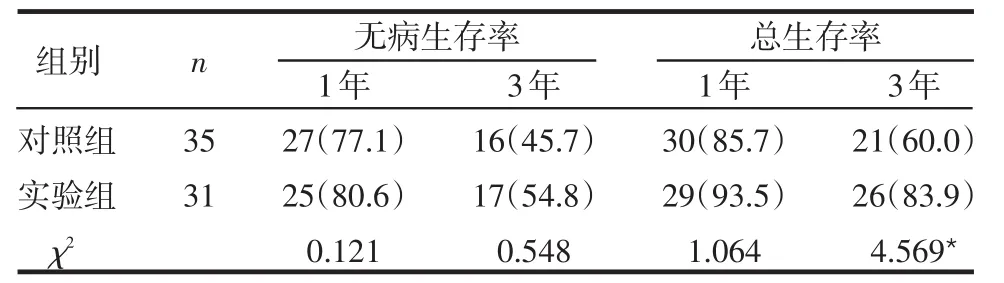
表1 2組的生存率比較 例(%)
2.3 2組的不良反應(yīng)比較 2組的不良反應(yīng)類型構(gòu)成差異均無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05),見表2。
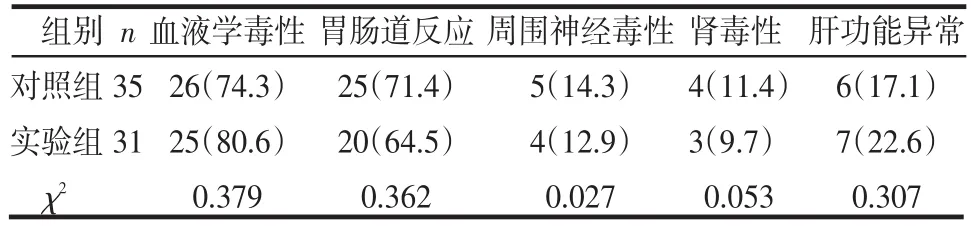
表2 2組的不良反應(yīng)比較 例(%)
3 討論
隨著個(gè)體化治療成為腫瘤治療的主導(dǎo)思想,人們相繼建立了如軟瓊脂集落形成實(shí)驗(yàn)、四唑藍(lán)比色法等一系列體外藥敏試驗(yàn)檢測(cè)技術(shù),但各自均有一定的局限性。CD-DST相對(duì)于其他藥敏試驗(yàn),具有細(xì)胞用量少、標(biāo)本培養(yǎng)成功率高、體外檢測(cè)結(jié)果與臨床療效間存在較好的相關(guān)性等優(yōu)勢(shì),對(duì)傳代胃癌細(xì)胞株進(jìn)行化療藥物敏感性檢測(cè)取得了較理想的結(jié)果[4]。本研究中結(jié)果顯示多數(shù)患者只對(duì)單一藥物敏感,奧沙利鉑和5-氟尿嘧啶的單藥敏感率在所測(cè)藥物中最高,檢測(cè)結(jié)果與實(shí)際臨床單藥治療有效率基本相符[5]。實(shí)驗(yàn)組1、3年生存率均高于對(duì)照組,也高于常規(guī)治療的文獻(xiàn)報(bào)道[6]。其中3年生存率2組差異有統(tǒng)計(jì)學(xué)意義,實(shí)驗(yàn)組患者的遠(yuǎn)期生存率要高于對(duì)照組,表明隨著隨訪時(shí)間的延長(zhǎng),2組間療效的差異更加明顯,提示以CD-DST結(jié)果為依據(jù)選擇的化療方案能明顯延長(zhǎng)患者生存時(shí)間,改善患者預(yù)后。2組均無(wú)因不良反應(yīng)而終止治療者,無(wú)治療相關(guān)性死亡,其中不良反應(yīng)發(fā)生率差異無(wú)統(tǒng)計(jì)學(xué)意義,與相關(guān)文獻(xiàn)報(bào)道一致[7],表明CD-DST檢測(cè)結(jié)果與所選化療方案的不良反應(yīng)發(fā)生率之間無(wú)相關(guān)性。
CD-DST是目前最先進(jìn)的體外藥敏檢測(cè)技術(shù),該技術(shù)利用膠原凝膠在37℃時(shí)形成三維立體結(jié)構(gòu)的特點(diǎn),在體外模仿了體內(nèi)腫瘤細(xì)胞生長(zhǎng)的微環(huán)境,使腫瘤細(xì)胞能夠在與體內(nèi)環(huán)境相似的條件下生長(zhǎng),生長(zhǎng)的腫瘤細(xì)胞具有與體內(nèi)相似的細(xì)胞形態(tài)特點(diǎn),能夠排除成纖維細(xì)胞對(duì)實(shí)驗(yàn)的干擾,在體外對(duì)抗癌藥物的特異性殺傷作用做出客觀評(píng)價(jià)[8]。在本研究中,經(jīng)該技術(shù)指導(dǎo)的胃癌化療取得了較為理想的效果,因此該技術(shù)可作為臨床用藥的參考依據(jù),在胃癌個(gè)體化治療中具有一定的指導(dǎo)意義。
[1]Liu J,Chen L.Current status and progress in gastric cancer with liver metastasis[J].Chin Med J(Engl),2011,124(3):445-456.
[2]Komoto C,Nakamura T,Ohmoto N,et al.Three-dimensional,but not two-dimensional,culture results in tumor growth enhancement after exposure to anticancer drugs[J].Kobe J Med Sci,2007,53(6):335-343.
[3]Huang Y,Hagiwara A,Wang W,et al.Local injection of M-CH combined with i.p.hyperthermic hypo-osmolar infusion is an effective therapy in advanced gastric cancer[J].Anticancer Drugs,2002,13(4):431-435.
[4]張建良,譚志軍,姜偉.膠滴藥敏試驗(yàn)評(píng)估不同分化胃癌細(xì)胞株對(duì)化療藥物敏感性的研究[J].天津醫(yī)藥,2011,39(3):233-235,290.
[5]Mori S,Kunieda K,Sugiyama Y,et al.Prediction of 5-fluorouracil and cisplatin synergism for advanced gastrointestinal cancers using a collagen gel droplet embedded culture[J].Surg Today,2003,33(8):577-583.
[6]Santini D,Graziano F,Catalano V,et al.Weekly oxaliplatin,5-fluorouracil and folinic acid(OXALF)as first-line chemotherapy for elderly patients with advanced gastric cancer:results of a phase II trial[J].BMC Cancer,2006,6:125-132.
[7]Kim YS,Hong J,Sym SJ,et al.Oxaliplatin,5-fluorouracil and leucovorin(FOLFOX-4)combination chemotherapy as a salvage treatment in advanced gastric cancer[J].Cancer Res Treat,2010,42(1):24-29.
[8]Higashiyama M,Oda K,Okami J,et al.Prediction of chemotherapeutic effect on postoperative recurrence by in vitro anticancer drug sensitivity testing in non-small cell lung cancer patients[J].Lung Cancer,2010,68(3):472-477.

