AFP-L3陽性肝細胞癌患者腫瘤分期和外周血淋巴細胞亞群的研究*
陳 斌, 廖慧芳, 黎東明, 周 奇, 匡 銘, 沈順利, 彭寶崗△
(中山大學附屬第一醫院 1肝膽外科, 2檢驗科, 廣東 廣州 510080)
AFP-L3陽性肝細胞癌患者腫瘤分期和外周血淋巴細胞亞群的研究*
陳 斌1, 廖慧芳2, 黎東明1, 周 奇1, 匡 銘1, 沈順利1, 彭寶崗1△
(中山大學附屬第一醫院1肝膽外科,2檢驗科, 廣東 廣州 510080)
目的: 分析小扁豆凝素結合型甲胎蛋白(AFP-L3)陽性的肝細胞癌患者腫瘤分期及外周血淋巴細胞的改變,探討AFP-L3水平與腫瘤分期及免疫狀態的關系。方法采集60例肝細胞癌患者外周血,檢測AFP及AFP-L3含量。根據外周血AFP-L3比例將60例原發性肝細胞癌患者分為2組:AFP-L3(+)組和AFP-L3(-)組。流式細胞術檢測外周血中各淋巴細胞亞群(NK、CD4+、CD8+、CD4/CD8、Treg)的比例。結果AFP-L3(+)組患者UICC分期Ⅲ+Ⅳ期為29例,AFP-L3(-)組為7例;AFP-L3(+)組患者BCLC分期C+D期為20例,AFP-L3(-)組為3例。AFP-L3(+)組患者發生血管侵犯為17例,遠高于AFP-L3(-)組(1例)。AFP-L3(+)組患者外周血中NK細胞比例及CD4/CD8比值下降,CD8+T和Treg細胞顯著比例上升。結論外周血AFP-L3陽性的肝癌患者容易發生血管侵犯,且分期較差,可能與淋巴細胞亞群發生變化、免疫系統受到抑制有關。
肝細胞癌; 小扁豆凝集素結合型甲胎蛋白; 腫瘤分期; 淋巴細胞亞群
肝細胞癌(hepatocellular carcinoma,HCC)的發病率在我國居惡性腫瘤發病率的第2位。外科手術切除、局部消融和肝移植是目前能夠使肝癌獲得根治的措施,但是多數患者診斷時已屆入中晚期,總體手術切除率不足30%[1]。因此早期診斷對于提高肝癌的總體療效具有重要意義。
甲胎蛋白(alpha-fetoprotein,AFP)是當前普遍用于肝癌早期診斷的腫瘤標記物。近年來,研究發現AFP存在多種異質體,其中小扁豆凝集素結合型AFP(Lensculinarisagglutinin-reactive AFP,AFP-L3)被認為是原發性肝癌的特異性標記物,有助于肝癌的早期診斷。同時有研究提示AFP-L3和肝癌的惡性程度及預后有關,AFP-L3升高者腫瘤具有更強的侵襲性,預后較差,但具體原因不明[2-8]。本研究擬分析AFP-L3陽性肝細胞癌患者的腫瘤分期和外周血中淋巴細胞亞群變化特點,研究外周血AFP-L3水平與腫瘤分期以及機體的免疫狀態間的關系,從免疫機制方面探討AFP-L3陽性肝癌患者腫瘤惡性程度更高的原因。
材 料 和 方 法
1臨床資料
選取2009年8月至2010年11月間于中山大學附屬第一醫院肝膽外科診治的肝細胞癌患者共60例。男48例,女12例,年齡18-75歲。排除合并妊娠、自身免疫性疾病、糖尿病、營養不良及使用免疫抑制劑患者。所有患者均經病理確診。
2臨床分期
采用國際防癌聯盟(UICC,第7版)肝癌TNM分期及巴塞羅那臨床分期(BCLC)對所有入選的肝細胞癌病例進行分期。
3病例分組
入選的肝細胞癌病例分為2組:(1) AFP-L3(+)組: AFP-L3≥10%;(2) AFP-L3(-)組:AFP-L3lt;10%。
4主要試劑
AFP-L3親和吸附離心管(產品編號YZB/國1343-2008)購自北京熱景生物技術有限公司。單克隆抗體FITC-CD3、APC-CD56、PE-CD16、PE-CD3、FITC -CD4、APC-CD8、FITC -CD4、APC-CD25、PE-Foxp3及Human FoxP3 Buffer Set和Stain Buffer (FBS)均購自BD。Ficoll-Paque PLUS(編號:17-1440-02)淋巴細胞分離液購自GE Healthcare。
5方法
5.1AFP及AFP-L3的測定 按AFP-L3親和吸附離心管操作說明書進行:患者取空腹靜脈血,離心后取400 μL血清,以試劑盒所配的清洗液600 μL稀釋后,加入親和吸附離心管中,室溫靜置10 min,加入1.2 mL的清洗液清洗,3 000 r /min離心20 s。更換離心管外管,再加入600 μL試劑盒所配的洗脫液,3 000 r/min離心20 s,獲得含有AFP-L3的洗脫液。將未稀釋的血清及含有AFP-L3的洗脫液一起送檢驗科,以化學發光法檢測AFP及AFP-L3的含量。AFP-L3含量×2.5即為血清中AFP-L3含量。AFP-L3比例=血清AFP-L3/總AFP。
5.2流式細胞術分析 用PBS按1∶1比例稀釋靜脈血,加到淋巴細胞分離液上層,淋巴細胞分離液和稀釋靜脈血比例為3∶4(按淋巴細胞分離液說明書),400×g離心30 min,獲得外周血單個核細胞(PBMC)。PBS洗滌2次,計數,行臺盼藍實驗證明細胞活性gt;95%。加入適當劑量的抗體染色后,以FACS 流式細胞儀檢測外周血淋巴細胞亞群:NK細胞(CD3+CD16+CD56+)、CD4+細胞(CD3+CD4+)、CD8+細胞(CD3+CD8+)和Treg細胞 (CD4+CD25+Foxp3+)。
6統計學處理
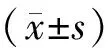
結 果
1AFP-L3陽性組的患者較AFP-L3陰性的患者腫瘤更容易發生血管侵犯
AFP-L3(+)組(n=35)和AFP-L3(-)組(n=25)腫瘤發生血管侵犯、膽管侵犯、淋巴結轉移、鄰近器官侵犯、遠處轉移、合并肝內轉移的例數和比例分別為17例(48.57%)vs1例(4.00%)、1例(2.86%)vs2例(8.00%)、0例(0%)vs2例(8.00%)、4例(11.43%)vs2例(8.00%)、2例(5.71%)vs0例(0.00%)、17例(48.57%)vs6例(24.00%)。各組間比較結果提示AFP-L3升高的患者更容易發生血管侵犯(Plt;0.01),見表1。而膽管侵犯、淋巴結轉移、鄰近器官侵犯、遠處轉移等特征組間均無明顯差異(Pgt;0.05)。雖然AFP-L3(+)組肝內轉移發生率高于AFP-L3(-)組,但亦無明顯差異(Pgt;0.05),見表1。
2AFP-L3陽性組患者腫瘤分期較差
按UICC發表的第7版肝癌TNM分期方法對所有病例進行分期。AFP-L3(+)組35例患者中Ⅰ+Ⅱ期6例(17.14%),Ⅲ+Ⅳ期29例(82.86%)。AFP-L3(-)組25例患者中Ⅰ+Ⅱ期18例(72.00%),Ⅲ+Ⅳ期7例(28.00%)。AFP-L3(+)組Ⅲ+Ⅳ期比例高于AFP-L3(-)組(Plt;0.01),見表2。

表1 AFP-L3陽性和陰性腫瘤臨床特征的比較

表2 AFP-L3陽性和陰性組腫瘤分期的比較(UICC)
按BCLC方法對所有病例進行分期。AFP-L3(+)組35例患者中A+B期15例(42.86%),C+D期20例(57.14%)。AFP-L3(-)組25例患者中A+B期22例(88.00%),C+D期3例(12.00%)。AFP-L3(+)組C+D期比例高于AFP-L3(-)組(Plt;0.01),見表3。

表3 AFP-L3陽性和陰性腫瘤按BCLC分期的比較
3AFP-L3陽性組患者外周血中NK細胞比例和CD4/CD8比值降低,CD8+細胞和Treg細胞比例上升
AFP-L3(+)組患者外周血中NK細胞占外周血淋巴細胞比例較AFP-L3(-)組顯著降低(Plt;0.05),見表4、圖1,分別為(10.56±8.35)%vs(15.59±9.78)%。AFP-L3(+)組和AFP-L3(-)組患者外周血中CD4+細胞、CD8+細胞占外周血淋巴細胞的比例分別為(32.84±9.46)%vs(37.61±9.38)%、(25.48±10.24)%vs(18.55±8.35)%,CD4/CD8比值分別為1.63±1.19vs2.44±1.29。AFP-L3(+)組CD4+細胞比例減少,但與AFP-L3(-)組相比無顯著差異(Pgt;0.05),CD8+細胞顯著比例升高(Plt;0.01),CD4/CD8比值顯著升高(Plt;0.01),見表4、圖2。此外,兩組外周血中Treg細胞占CD4+細胞比例分別為(9.27±2.95)%和(7.20±1.09)%,AFP-L3(+)組Treg細胞比例明顯升高(Plt;0.01),見表4、圖3。

表4 AFP-L3陽性和陰性患者外周血淋巴細胞亞群的比較

Figure 3.Treg cells in peripheral blood of patients in AFP-L3(+) group and AFP-L3(-) group.±s.**Plt;0.01 vs AFP-L3(-).
討 論
AFP很早就作為肝癌的篩查和診斷的指標。近年來,研究者發現多種AFP異質體,其中AFP-L3是原發性肝癌的特異性指標,能夠早期診斷肝癌,甚至可以早于影像學檢查[2,3],且和肝癌的惡性程度及預后有聯系。AFP-L3水平升高者多伴有腫瘤分化偏低、更容易發生門靜脈侵犯的特征,但與腫瘤的大小和AFP水平無關。AFP-L3陽性的腫瘤更具侵襲性,且AFP-L3水平與靜脈侵犯呈正相關[4-6]。此外,AFP-L3還是行TACE和消融治療的預后指標,AFP-L3陽性患者TACE治療后2年生存率明顯低于AFP-L3陰性患者( 21.2%vs78.6%)[7],而AFP-L3陽性患者消融治療后5年生存率由62.9%下降至50.0%[8]。我們通過對臨床資料分析發現,AFP-L3陽性患者腫瘤無論按照UICC還是BCLC分期,分期均較AFP-L3陰性的患者更差,更容易產生血管侵犯和肝內轉移,說明AFP-L3陽性的腫瘤更具侵襲性,與之前其它報道結果一致。
免疫耐受和免疫抑制是機體不能產生有效抗腫瘤免疫反應、腫瘤無限制增殖并發生轉移的重要原因,影響著腫瘤的發展和生物學特性,也影響著腫瘤的治療效果[9]。肝癌可以誘發機體免疫抑制狀態,如外周血中CD3+和CD4+細胞數目下降,CD4/CD8比值下降[10];而外周血以及腫瘤組織的Treg增加也嚴重地影響了機體抗腫瘤免疫效應[11]。腫瘤誘發的機體免疫耐受狀態和微環境紊亂使得機體產生的抗腫瘤免疫效應不能有效地控制肝癌的進展。
本研究提示AFP-L3陽性肝細胞癌患者的外周血淋巴細胞亞群紊亂和肝癌侵襲性有一定關系。AFP-L3陽性肝細胞癌患者外周血NK細胞比例下降,CD8+淋巴細胞比例上升,CD4/CD8比值下降,Treg比例上升。NK細胞是和T細胞、B細胞不同的免疫細胞,為非特異性殺傷細胞,在腫瘤免疫中起重要作用。進展期肝癌的可溶性MHCⅠ抗原可以影響NK細胞的功能[12],致使外周血和局部的NK細胞比例和功能都有所下降[13]。動物實驗顯示激活NK細胞可以延緩腫瘤的發展[14]。我們發現AFP-L3陽性的患者外周血中NK細胞占外周血淋巴細胞比例明顯降低,腫瘤惡性程度更高。CD4+和CD8+淋巴細胞在細胞介導的抗腫瘤免疫反應中發揮重要作用[15,16]。而調節性T淋巴細胞(Treg)是一種有負性調節作用的CD4+淋巴細胞亞群,可以抑制機體的抗腫瘤免疫,清除或抑制Treg后具有抑制腫瘤生長的作用[17]。本研究中AFP-L3陽性患者外周血中NK細胞比例以及CD4/CD8比值下降提示各淋巴細胞亞群的比例失衡,患者抗腫瘤免疫反應受到抑制。腫瘤有可能通過上調Treg細胞、下調NK細胞抑制了機體的抗腫瘤免疫反應。雖然CD8+T細胞比例有所上升,但Treg細胞的上調有可能對其殺傷能力產生了抑制,從而使其抗腫瘤作用減弱。
[1]Bruix J,Sherman M.Management of hepatocellular carcinoma[J].Hepatology,2005,42(5): 1208-1236.
[2]Taketa K,Endo Y,Sekiya C,et al.A collaborative study for the evaluation of lectin-reactive α-fetoproteins in early detection of hepatocellular carcinoma[J].Cancer Res,1993,53(22):5419-5423.
[3]Oka H,Saito A,Ito K,et al.Multicenter prospective analysis of newly diagnosed hepatocellular carcinoma with respect to the percentage of AFP-L3[J].J Gastroenterol Hepatol,2001,16(12):1378-1383.
[4]Okuda H,Nakanishi T,Takatsu K,et al.Clinicopathologic features of patients with hepatocellular carcinoma seropositive for α-fetoprotein-L3 and seronegative for des- γ-carboxy prothrombin in comparison with those seropositive for des-γ-carboxy prothrombin alone[J].J Gastroenterol Hepatol,2002,17(7):772-778.
[5]Hagiwara S,Kudo M,Kawasaki T,et al.Prognostic factors for portal venous invasion in patients with hepatocellular carcinoma[J].J Gastroenterol,2006,41(12):1214-1219.
[6]Carr BI,Kanke F,Wise M,et al.Clinical evaluation of lens culinaris agglutinin-reactive alpha-fetoprotein and des-gamma-carboxy prothrombin in histologically proven hepatocellular carcinoma in the United States[J].Dig Dis Sci,2007,52(3):776-782.
[7]Song BC,Suh DJ,Yang SH,et al.Lens culinaris agglutinin-reactive alpha-fetoprotein as a prognostic marker in patients with hepatocellular carcinoma undergoing transcatheter arterial chemoembolization[J].J Clin Gastroenterol,2002,35(5):398-402.
[8]Toyoda H,Kumada T,Kaneoka YJ,et al.Prognostic value of pretreatment levels of tumor markers for hepatocellular carcinoma on survival after curative treatment of patients with HCC[J].J Hepatol,2008,49(2):223-232.
[9]汪禮坤, 匡 銘, 彭寶崗, 等.Tregs調節小鼠肝癌局部引流淋巴結內免疫效應細胞的功能[J].中國病理生理雜志,2010,26(5):922-927.
[10]Attallah AM,Tabll AA,El-Sadany M,et al.Dysregulation of blood lymphocyte subsets and natural killer cells in schistosomal liver cirrhosis and hepatocellular carcinoma[J].Clin Exp Med,2003,3(3):181-185.
[11]Ormandy LA,Hillemann T,Wedemeyer H,et al.Increased populations of regulatory T cells in peripheral blood of patients with hepatocellular carcinoma[J].Cancer Res,2005,65(6):2457-2464.
[12]Jinushi M,Takehara T,Tatsumi T,et al.Impairment of natural killer cell and dendritic cell functions by the soluble form of MHC class I-related chain A in advanced human hepatocellular carcinomas[J].J Hepatol,2005,43(6):1013-1020.
[13]Cai L,Zhang Z,Zhou L,et al.Functional impairment in circulating and intrahepatic NK cells and relative mechanism in hepatocellular carcinoma patients[J].Clin Immunol,2008,129(3):428-437.
[14]Elinav E,Abd-Elnabi A,Pappo O,et al.Suppression of hepatocellular carcinoma growth in mice via leptin,is associated with inhibition of tumor cell growth and natural killer cell activation[J].J Hepatol,2006,44(3):529-536.
[15]Mumber GD,Monach PA,Wanderling S,et al.CD4+T cells eliminate MHC class II-negative cancer cellsinvivoby indirect effects of IFN-γ[J].Proc Natl Acad Sci USA,1999,96(15): 8633-8638.
[16]Bricard G,Bouzourene H,Martinet O,et al.Naturally acquired MAGE-A10- and SSX-2-specific CD8+T cell responses in patients with hepatocellular carcinoma[J].J Immunol,2005,174(3): 1709-1716.
[17]Shen XH,Li N,Li H,et al.Increased prevalence of regulatory T cells in the tumor microenvironment and its correlation with TNM stage of hepatocellular carcinoma[J].J Cancer Res Clin Oncol,2010,136(11):1745-1754.
TumorstagesandperipheralbloodlymphocytesubsetsinpatientswithAFP-L3-positivehepatocellularcarcinoma
CHEN Bin1,LIAO Hui-fang2,LI Dong-ming1,ZHOU Qi1,KUANG Ming1,SHEN Shun-li1,PENG Bao-gang1
(1DepartmentofHepatobiliarySurgery,2ClinicalLaboratory,TheFirstAffiliateHospitalofSunYat-senUniversity,Guangzhou510080,China.E-mail:pengbaogang@medmail.com.cn)
AIM: To analyze the variations of tumor stages and peripheral blood lymphocyte subsets inLensculinarisagglutinin-reactive alpha-fetoprotein (AFP-L3) -positive hepatocellular carcinoma (HCC) and to explore the relationship between tumor stage,immune state and AFP-L3.METHODSPeripheral blood of sixty HCC patients was collected.The concentrations of AFP and AFP-L3 were detected.The patients were divided into 2 groups according to the expression of AFP-L3: AFP-L3 (+) group and AFP-L3 (-) group.The variations of T-lymphocyte subsets,natural killer T-cells (NK,CD3+CD16+CD56+),CD4+T-cells (CD3+CD4+),CD8+T-cells (CD3+CD8+),CD4/CD8 ratio and regulatory T-cells (Treg,CD4+CD25+Foxp3+),were analyzed by flow cytometry.RESULTSAccording to the International Union against Cancer (UICC) staging system,29 patients in AFP-L3 (+) group were in stage III and IV,while only 7 patients in AFP-L3 (-) group were in stage III and IV.According to the Barcelona Clinic Liver Cancer (BCLC) staging system,20 patients in AFP-L3 (+) group were in stage C and D,while only 3 patients in AFP-L3(-) group were in stage C and D.Seventeen patients in AFP-L3 (+) group suffered vascular invasion,significantly more than those in AFP-L3 (-) group.The percentage of NK cells and CD4/CD8 ratio decreased in AFP-L3 (+) group,while the percentages of CD8+and Treg cells significantly increased.CONCLUSIONThe AFP-L3 (+) patients have liability to vascular invasion and worse tumor stages,which may relate to variations of lymphocyte subsets and suppression of the immune system.
Hepatocellular carcinoma;Lensculinarisagglutinin-reactive alpha-fetoprotein; Tumor staging; Lymphocyte subsets
1000-4718(2011)05-0843-05
R735.7
A
10.3969/j.issn.1000-4718.2011.05.003
2011-03-09
2011-04-12
國家自然科學基金資助項目(No.81071892);廣東省科技計劃資助項目(No.2008B080703031;No.2010B031500026)
△通訊作者 Tel:020-87755766-8214;E-mail:pengbaogang@medmail.com.cn

