促紅細胞生成素上調海馬pCREB表達和改善腦缺血小鼠認知功能*
陳遠壽, 潘貴書, 秦 偉, 羅孝美, 禹 靜, 張 弛
(1遵義醫學院生理教研室,貴州 遵義 563003;2中國科學院神經科學研究所神經科學國家重點實驗室,上海 200031)
促紅細胞生成素上調海馬pCREB表達和改善腦缺血小鼠認知功能*
陳遠壽1△, 潘貴書1, 秦 偉1, 羅孝美1, 禹 靜2, 張 弛2
(1遵義醫學院生理教研室,貴州 遵義 563003;2中國科學院神經科學研究所神經科學國家重點實驗室,上海 200031)
目的探討促紅細胞生成素(EPO)對小鼠腦缺血所致的認知功能障礙和海馬神經元損傷的保護作用及機制。方法C57BL/6綠色熒光蛋白轉基因小鼠隨機分為假手術(sham)組、腦缺血/再灌注(I/R)組和EPO治療組;采用雙側頸總動脈阻斷(2-VO)方法復制小鼠全腦缺血模型,跳臺實驗測試小鼠學習記憶能力,Nissl染色檢測海馬神經元存活情況,Western blotting檢測磷酸化cAMP反應元件結合蛋白(pCREB)表達水平,激光共聚焦顯微鏡和Neurolucida軟件分析檢測海馬CA1區神經元形態及樹突棘的變化。結果腦缺血導致小鼠學習記憶能力下降,海馬CA1區神經元遲發性死亡和樹突棘丟失;EPO治療能顯著提高腦缺血小鼠的學習記憶能力,減少腦缺血所致的海馬CA1區神經元死亡和樹突棘的丟失,顯著上調海馬CA1區神經元pCREB蛋白的表達。結論EPO可能通過上調pCREB的表達來保護神經元損傷、防止神經元樹突棘的丟失,進而改善腦缺血小鼠的認知功能。
腦缺血; 紅細胞生成素; cAMP反應元件結合蛋白質; 樹突棘; 學習; 記憶
腦缺血可導致患者進行性或持久性的認知功能障礙,嚴重影響患者生活質量,目前尚無有效的干預手段。近年來發現,核轉錄因子cAMP反應元件結合蛋白(cAMP response element-binding protein,CREB)轉錄活性的改變與突觸的可塑性及學習記憶功能有密切關系[1,2]。同時大量研究顯示,促紅細胞生成素(erythropoietin, EPO)具有神經營養和神經保護作用,可改善嚙齒類動物和人的認知功能[3,4]。但EPO對腦缺血后磷酸化CREB (phosphorylated CREB,pCREB)表達以及樹突棘變化的影響少有報道。為此,本實驗利用綠色熒光蛋白(green fluorescent protein,GFP)轉基因小鼠,觀察EPO治療后腦缺血小鼠學習記憶能力、海馬神經元損傷、pCREB表達以及樹突棘的變化,深入探討EPO的神經保護作用和改善腦缺血小鼠認知功能障礙的機制。
材 料 和 方 法
1材料
雄性C57BL/6 GFP轉基因小鼠,質量25-30 g,2-3月齡,由中國科學院神經科學研究所轉基因實驗動物室提供。EPO購自Sigma;兔抗pCREB、GAPDH多克隆抗體購自Santa Cruz。DT-200小鼠跳臺儀(成都泰盟公司);顯微鏡(Nikon);LSM510 META激光掃描共聚焦顯微鏡(Zeiss);CM1850冰凍切片機(Leica)。
2方法
2.1動物分組及給藥 36只小鼠隨機分為:假手術(sham)組、腦缺血/再灌注模型(ischemia/reperfusion,I/R)組、EPO治療(EPO)組。每組12只。EPO治療組小鼠于缺血前30 min和缺血/再灌注后每天腹腔內注射1次EPO(3 000 U/kg),sham組和I/R組在相同時點注射等容量生理鹽水。
2.2腦缺血/再灌注模型的制作 參照文獻[5],小鼠用10%水合氯醛(300 mg/kg,ip)麻醉后,無菌操作下行頸部正中切口,分離、夾閉兩側頸總動脈20 min,松開小動脈夾行再灌注7 d。在手術造模和再灌注期間均應維持小鼠體溫在(37±0.5)℃。Sham組小鼠進行同樣的手術處理,但不進行兩側頸總動脈夾閉。
2.3行為學實驗-跳臺實驗(step-down test) 測試 參照文獻[6]行跳臺實驗檢測小鼠學習記憶能力。實驗第1 d先將小鼠放入箱內熟悉環境5 min,然后將小鼠放置于反應箱內的銅柵上,立即通36 V交流電,記錄小鼠跳上安全臺的反應時間(reaction time,RT)和5 min內從臺上跳下受到的電擊次數(錯誤次數,number of errors,NR),以此作為學習成績。24 h后進行重測驗,將小鼠放在平臺上,記錄其第1次跳下平臺的潛伏期(step-down latency,SDL)和5 min內受到電擊的錯誤次數,此為記憶成績。
2.4腦組織灌流及組織切片 小鼠跳臺實驗后,各組動物取8只,用10%水合氯醛(300 mg/kg,ip)麻醉,用0.9%生理鹽水和4%多聚甲醛透心灌注固定,迅速取腦,避光下后固定過夜,分別用15%和30%蔗糖脫水直至腦組織沉下。行海馬連續冠狀冰凍切片(20 μm)。
2.5Nissl染色 海馬切片浸入1∶1乙醇和氯仿溶液中30 min,梯度乙醇(100%, 95%,80%, 70%, 60%, 50%)分化,蒸餾水沖洗后用甲酚紫染液浸染30 min,蒸餾水洗,用梯度乙醇(50%, 60%, 70%, 80%, 95 %, 100%)脫水,二甲苯透明(2×5 min),DPX封片,顯微鏡明場下觀察海馬神經元形態學變化。各組選取切片8張,在顯微鏡下對海馬CA1區存活神經元計數分析。
2.6海馬CA1神經元圖像采集及樹突棘的形態定量分析 取各組海馬切片,應用LSM510 META激光掃描共聚焦顯微鏡逐層掃描拍攝轉染有GFP的海馬CA1錐體細胞,掃描拍攝圖像經過Neurolucida軟件繪制并重塑神經元結構,用NeuroExplorer軟件統計出二級樹突的樹突棘密度。
2.7Western blotting檢測pCREB的表達 小鼠跳臺實驗后,各組動物取4只,10%水合氯醛腹腔注射麻醉后迅速斷頭取腦,冰上分離出海馬CA1區組織,立即置-70 ℃冰箱保存。取出標本冰上裂解、勻漿,4 ℃離心后取上清,以考馬斯亮藍法測定樣品蛋白含量。將等量蛋白樣品經12%SDS-PAGE分離后,電轉移至硝酸纖維素膜上,5%脫脂奶粉封閉4 ℃過夜,洗滌后加pCREBⅠ抗(1∶1 000)室溫搖晃2 h,洗滌后,加入Ⅱ抗辣根酶標記山羊抗兔IgG (1∶4 000)室溫搖晃1 h。洗滌后暗室內ECL反應,曝光、顯影、定影。應用數字凝膠成像系統拍照,將目的蛋白條帶的灰度值與內參照GAPDH的灰度值做比較,計算相對灰度值。
3統計學處理
結 果
1EPO提高腦缺血小鼠學習記憶能力
行為學結果顯示,第1次測試時,受電擊后I/R組小鼠的反應時間較sham組明顯延長(Plt;0.01),錯誤次數也明顯增多(Plt;0.01);EPO組小鼠的反應時間較I/R組明顯縮短(Plt;0.01),錯誤次數也明顯減少(Plt;0.05);24 h后第2次測試發現,I/R組的SDL與sham組比較明顯縮短(Plt;0.01),EPO組的SDL較I/R組明顯延長(Plt;0.01),錯誤次數也顯著減少(Plt;0.05),見表1。

表1 各組小鼠學習記憶能力比較
2EPO保護腦缺血所致的海馬神經元損傷
Nissl染色和定量分析顯示,與sham組比較,I/R組CA1區神經元存活數量顯著減少(Plt;0.01);EPO組CA1區神經元存活數量明顯多于與I/R組 (Plt;0.01),但仍低于sham組(Plt;0.01),見圖1。
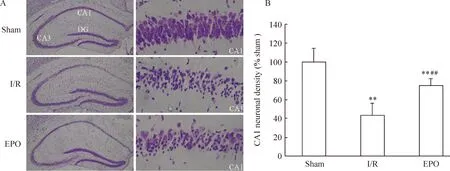
Figure 1. Effect of EPO on CA1 neuronal injury after ischemia.A:histological evaluation with Nissl staining (left panels×40,right panels×400); B:quantitative evaluation. ±s. n=8. **Plt;0.01 vs sham group ; ## Plt;0.01 vs I/R group.
3EPO減少腦缺血所致的小鼠海馬CA1區神經元樹突棘的丟失
與sham組比較,I/R組CA1區神經元樹突棘明顯脫落、數量顯著減少(Plt;0.01);EPO治療后,CA1區神經元樹突棘數量明顯多于I/R組(Plt;0.01),見圖2。
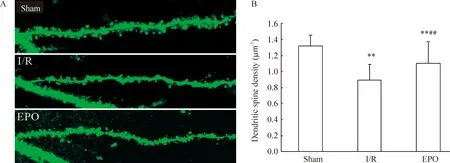
Figure 2. Effect of EPO on dendritic spine density in hippocampal CA1 neuron after ischemia.A:histological evaluation under laser scanning confocal microscope (×1 000);B:quantitative evaluation±s. n=8. ** Plt;0.01 vs sham group ; ##Plt;0.01 vs I/R group.
4EPO上調腦缺血小鼠海馬CA1區神經元pCREB蛋白的表達
與sham組比較,I/R組海馬CA1區pCREB蛋白表達有所降低,但無顯著差異(Pgt;0.05);EPO治療后,pCREB蛋白表達顯著高于sham組與I/R組(Plt;0.05),見圖3。
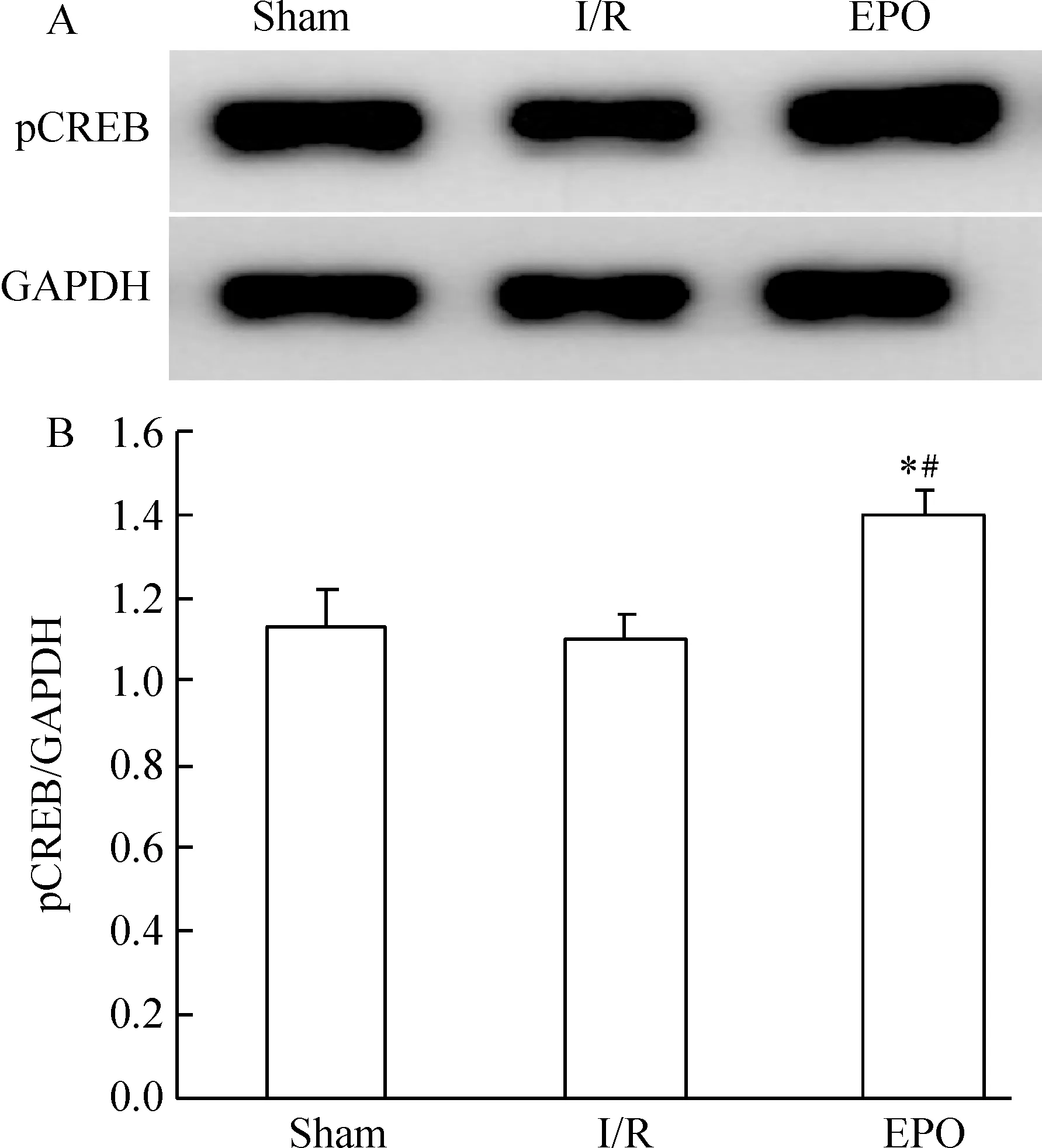
Figure 3. Effect of EPO on pCREB protein expression in the hippocampal CA1 region after ischemia.A:Western blotting analysis;B:quantitative evaluation. ±s. n=4. *Plt;0.05 vs sham group;#Plt;0.05 vs I/R group.
討 論
大量臨床和實驗研究均表明,腦缺血再灌注可導致大腦缺血缺氧易感區海馬發生遲發性神經元死亡,導致患者或動物的認知功能障礙[6,7]。本研究也顯示,小鼠腦缺血再灌注7 d后,海馬CA1區發生明顯的神經元死亡,且伴學習記憶能力明顯減退,表明本實驗的腦缺血再灌注模型是成功的。同時,本研究發現腦缺血再灌注7 d后海馬CA1區錐體神經元樹突棘數量明顯減少,引起了突觸可塑性改變,而突觸可塑性是學習記憶的神經生物學基礎,在學習記憶過程中,突觸可塑性變化常與樹突棘的形成、脫落、擴張和萎縮等形態變化相伴發生[8]。缺血后樹突棘的丟失可能是小鼠學習記憶能力減退的原因之一。
EPO作為一種熱穩定糖蛋白激素,具有神經保護作用[9]和神經營養作用[10],可促進神經細胞增殖和分化,使神經元突起增多,突觸功能增強[11-13]。我們實驗結果發現,EPO對小鼠腦缺血所致的海馬CA1區神經元損傷有明顯保護作用,可阻止腦缺血引起的CA1區神經元樹突棘的丟失。樹突棘是神經元間形成突觸的主要部位,EPO削弱了腦缺血所致的樹突棘丟失,從而增加了海馬CA1區神經元突觸的數量,使腦缺血小鼠的學習記憶能力提高。提示EPO可能會成為一種防治血管性認知功能障礙有希望的藥物。
為進一步研究EPO上述作用的可能機制,我們研究了學習記憶的關鍵分子CREB。在早期研究CREB在學習記憶中的作用發現,利用熱沖擊條件誘導一個CREB的抑制蛋白表達后,可阻斷果蠅長時程記憶的形成。通過轉基因動物實驗也證明,CREB缺失的突變型小鼠空間學習記憶功能明顯受損[14]。而pCREB是CREB的活化形式,調節位于其下游的大量基因如即刻早期基因、腦源性神經營養因子(brain-derived neurotrophic factor,BDNF)等基因的轉錄,參與了神經元生長、分化、存活,以及學習記憶等重要作用[1,2,15,16]。本研究結果中I/R組pCREB表達并未下調,與文獻報道一致[17,18]。也有報道在腦缺血早期,pCREB表達可快速上調(5 min內),然后逐步回落[17],現在認為這可能是機體對缺血腦損傷的一種內源性保護效應[17,18]。同時,我們觀察到EPO治療后,腦缺血小鼠海馬CA1區pCREB的表達明顯上調,小鼠認知功能得到明顯改善。這些結果提示,刺激腦缺血小鼠海馬CREB的轉錄活性可能是EPO發揮神經保護及其促進學習記憶作用的機制之一。
綜上所述,本研究結果證實,EPO可明顯削弱腦缺血/再灌注所致的小鼠海馬CA1錐體神經元損傷和樹突棘的減少,改善腦缺血引起的小鼠認知功能缺陷,提高腦缺血小鼠學習記憶能力,其機制可能與上調海馬CA1錐體神經元pCREB的表達以及改變海馬突觸可塑性有關。這為探討EPO的神經保護作用和提高學習記憶能力的分子機制補充了新內容,為臨床上防治缺血腦損傷與認知功能缺陷提供了實驗依據和新的思路。
[1] Sekeres MJ,Neve RL,Frankland PW,et al. Dorsal hippocampal CREB is both necessary and sufficient for spatial memory[J]. Learn Mem,2010,17(6):280-283.
[2] Xu J,Rong S,Xie B,et al. Memory impairment in cognitively impaired aged rats associated with decreased hippocampal CREB phosphorylation: reversal by procyanidins extracted from the lotus seedpod[J]. J Gerontol A Biol Sci Med Sci,2010,65(9):933-940.
[3] Kumral A,Uysal N,Tugyan K,et al. Erythropoietin improves long-term spatial memory deficits and brain injury following neonatal hypoxia-ischemia in rats[J]. Behav Brain Res,2004,153(1):77-86.
[4] Adamcio B, Sargin D, Stradomska A, et al. Erythropoietin enhances hippocampal long-term potentiation and memory[J]. BMC Biol,2008,6:37.
[5] Kim DH,Kim S,Jung WY,et al.The neuroprotective effects of the seeds of Cassia obtusifolia on transient cerebral global ischemia in mice[J]. Blood Chem Toxicol,2009,47(7):1473-1479.
[6] Zhang L,Fu F,Zhang X,et al. Escin attenuates cognitive deficits and hippocampal injury after transient global cerebral ischemia in mice via regulating certain inflammatory genes[J]. Neurochem Int,2010,57(2):119-127.
[7] 劉 旭,程玉芳,張漢霆,等. 咯利普蘭對局灶性腦缺血-再灌注損傷大鼠學習記憶及海馬PDE4活性的影響[J]. 中國病理生理雜志,2008,24(6):1096-1100.
[8] González-Burgos I,Letechipía-Vallejo G,López-Loeza E,et al.Long-term study of dendritic spines from hippocampal CA1 pyramidal cells, after neuroprotective melatonin treatment following global cerebral ischemia in rats[J]. Neurosci Lett,2007,423(2):162-166.
[9] Wakida K,Shimazawa M,Hozumi I,et al. Neuroprotective effect of erythropoietin,and role of metallothionein-1 and-2,in permanent focal cerebral ischemia[J].Neuroscience,2007,148 (4):105-114.
[10]Li Y,Lu ZY,Keogh CL,et al. Erythropoietin-induced neurovascular protection,angiogenesis,and cerebral blood flow restoration after focal ischemia in mice [J].J Cereb Blood Flow Metab,2007,27(5):1043-1054.
[11]Gonzalez FF,McQuillen P,Mu DZ,et al. Erythropoietin enhances long-term neuroprotection and neurogenesis in neonatal stroke[J].Dev Neurosci,2007,29(4-5):321-330.
[12]Ransome MI,Turnley AM. Erythropoietin promotes axonal growth in a model of neuronal polarization[J]. Mol Cell Neurosci,2008,38(4):537-547.
[13]Berkingali N,Warnecke A, Gomes P,et al. Neurite outgrowth on cultured spiral ganglion neurons induced by erythropoietin[J]. Hear Res,2008,243(1-2):121-126.
[14]Bourtchuladze R,Frenguelli B,Blendy J,et al. Deficient long-term memory in mice with a targeted mutation of the cAMP-responsive element-binding protein[J].Cell,1994,79(1):59-68.
[15]Viviani B,Bartesaghi S,Corsini E,et al.Erythropoietin protects primary hippocampal neurons increasing the expression of brain-derived neurotrophic factor[J].J Neurochem,2005,93(2):412-421.
[16]蔡曉紅,張存雪,周永海,等.慢性間歇低氧對幼鼠認知及相關腦區CREB的影響[J].中國病理生理雜志,2010,26(5):895-900.
[17]Mabuchi T, Kitagawa K, Kuwabara K, et al. Phosphorylation of cAMP response element-binding protein in hippocampal neurons as a protective response after exposure to glutamateinvitroand ischemiainvivo[J]. J Neurosci,2001,21(23):9204 -9213.
[18]Kitagawa K. CREB and cAMP response element-mediated gene expression in the ischemic brain[J]. FEBS J,2007,274(13):3210-3217.
Erythropoietinattenuatescerebralischemia-inducedcognitivedysfunctionthroughstimulationofhippocampalCREBphosphorylationinC57BL/6mice
CHEN Yuan-shou1, PAN Gui-shu1, QIN Wei1, LUO Xiao-mei1, YU Jing2, ZHANG Chi2
(1DepartmentofPhysiology,ZunyiMedicalCollege,Zunyi563003,China;2InstituteofNeuroscience,StateKeyLaboratoryofNeuroscience,ChineseAcademyofSciences,Shanghai200031,China.E-mail:jcbshengli@163.com)
AIM: To investigate the neuroprotective effect of erythropoietin (EPO) on cognitive dysfunction and neuronal injury in hippocampal CA1 region induced by cerebral ischemia in mice.METHODSMale C57BL/6 green fluorescent protein-transgenic mice were randomly divided into 3 groups: sham operation group (sham), ischemia/reperfusion group (I/R) and EPO-treated group. Transient cerebral global ischemia was induced by bilateral common carotid artery occlusion (2-VO). The step-down test was used to measure the capacity of learning and memory of the animals in each group. Nissl staining was applied to examine the neuronal number in hippocampal CA1 region. The expression of phosphorylated cAMP response element-binding protein (pCREB) was determined by Western blotting. Alterations of dendritic morphology in hippocampal CA1 region were evaluated using laser scanning confocal microscopy and Neurolucida software.RESULTSTransient cerebral ischemia caused deficits of spatial learning and memory, and delayed neuronal death and loss of dendritic spines in hippocampal CA1 region were also obvious. The EPO treatment significantly improved the cognitive function in cerebral ischemic mice, and the protein expression of pCREB was obviously increased. At the same time, neuronal death and loss of dendritic spines were reduced in hippocampal CA1 region.CONCLUSIONErythropoietin increases the protein expression of pCREB, and reduces neuronal death and loss of dendritic spines. These processes may be responsible for erythropoietin-mediated neuroprotective effects and the improvement of cognitive function in cerebral ischemic mice.
Brain ischemia; Erythropoietin; cAMP response element-binding protein; Dendritic spine; Learning; Memory
1000-4718(2011)04-0722-05
R743.31
A
10.3969/j.issn.1000-4718.2011.04.019
2010-10-10
2011-01-20
中國科學院神經科學國家重點實驗室開放課題資助項目(No.SKLN2008A04)
△通訊作者Tel:0852-8609442;E-mail:jcbshengli@163.com

