尾懸吊模擬失重對雌性大鼠生殖功能的影響
賈木天, 宋昕宸, 張怡明, 王立祥
(1山東大學醫學院藥理學研究所,山東 濟南 250012;2山東省實驗中學,山東 濟南 250001)
尾懸吊模擬失重對雌性大鼠生殖功能的影響
賈木天1,2, 宋昕宸1,2, 張怡明1,2, 王立祥1△
(1山東大學醫學院藥理學研究所,山東 濟南 250012;2山東省實驗中學,山東 濟南 250001)
目的探討模擬失重對雌性大鼠生殖功能的影響及其發生機制,為太空探索者的健康保護提供可借鑒的科學線索。方法利用尾部懸吊法建立模擬失重狀態大鼠模型;選取Wistar雌性大鼠72只,隨機均分為6組,3個實驗組分別為:模擬失重7 d組、模擬失重14 d組和模擬失重21 d組;3個對照組是與模擬失重組相對應的自由活動組。應用酶聯免疫吸附法(ELISA)檢測血清中雌二醇(E2)、卵泡刺激素(FSH)和黃體生成素(LH)水平;HE染色觀察卵巢組織結構,特異性脂褐素染色觀察卵巢組織衰老狀況;逆轉錄定量PCR(qRT-PCR)技術檢測細胞衰老相關分子端粒酶逆轉錄酶(TERT)、p53、p16、p21和P27的mRNA表達水平;免疫組織化學方法檢測P53、P16、P21和P27的蛋白表達;隨機取健康雄性大鼠分別與各組雌性大鼠合籠,比較生育仔鼠數量和存活率。結果與各對照組相比, 模擬失重7 d組、14 d組和21 d組大鼠血清中E2下降,FSH和LH上升(Plt;0.05);大鼠卵巢組織卵泡數量明顯減少,卵巢組織發生細胞衰老現象,細胞衰老相關分子TERT mRNA表達被抑制(Plt;0.05),衰老相關的細胞周期調控分子p53、p16、p21和p27在mRNA和蛋白水平表達均升高(Plt;0.05)。各模擬失重組雌性大鼠生育的仔鼠數量較相應的對照組明顯減少(Plt;0.05),仔鼠存活率顯著下降(Plt;0.01)。結論尾懸吊模擬失重導致雌性大鼠生殖功能下降,該現象與模擬失重誘導卵巢組織細胞衰老和下丘腦-垂體-卵巢軸內分泌功能紊亂相關。
尾懸吊; 失重; 卵巢; 生殖
我國在掌握了載人航天飛行技術后,將逐步進入到空間站時代,如何保障航天員在太空環境中長期生活是亟待解決的科學問題。宇航員進入太空將面臨失重環境威脅,失重對機體多器官產生不良影響,可累及心血管、神經、內分泌、骨骼肌肉等系統。近期有研究發現模擬失重對性成熟期雄性大鼠生殖功能有較明顯的損害,這種損傷可能與失重引起睪丸生精細胞凋亡有關[1]。卵巢屬女性生殖和內分泌器官,是人類繁衍和女性健康的基礎,失重環境對卵巢功能影響的研究罕見報道。尾部懸吊大鼠模型是由Wronski等[2]于1987年首次建立研究模擬失重的動物模型,至今這一實驗方法仍為研究模擬失重環境的的經典動物模型[1,3-5]。本研究利用鼠尾懸吊法模擬失重狀態,研究模擬失重對雌性大鼠生殖功能的影響,旨在為太空探索者的健康保護提供可借鑒的科學線索。
材 料 和 方 法
1動物及主要試劑
Wistar大鼠購自山東大學實驗動物中心;Trizol購自Invitrogen;RT試劑盒購自Fermentas;逆轉錄定量PCR試劑盒購自大連寶生物公司;TERT、p53、p16、p21和p27的引物由北京華大基因合成,抗體購自Santa Cruz;DAB染色試劑盒、伊紅和蘇木素購自北京中杉公司;免疫組化試劑盒購自Invitrogen;石蠟切片衰老相關脂褐素染色試劑盒購自上海杰美生物有限公司。
2動物模型的建立和分組
選擇清潔級成年Wistar雌性大鼠,體重250-300 g,采用尾部懸吊法建立模擬失重大鼠模型[2],大鼠單籠飼養,實驗組大鼠置于懸吊籠,大鼠尾部懸于籠頂,前肢踏于籠底,使大鼠頭低位,軀干與籠底水平面呈30°,后肢自由懸空不負重, 前肢著地可自然活動并正常覓食飲水。正常對照組不懸吊并自由活動。選取Wistar雌性大鼠72只,先適應性喂養1周后,隨機均分為6組,3個實驗組分別為:模擬失重7 d組、14 d組和21 d組;3個對照組:是與模擬失重組相對應的自由活動組,即自由活動7 d組、14 d組和21 d組。
3ELISA法檢測大鼠血清中雌二醇(estradiol,E2)、卵泡刺激素(folliclestimulatinghormone,FSH)和黃體生成素(luteinizinghormone,LH)水平
取大鼠血置于促凝管中,待血清析出后離心收集。按照E2、FSH和LH的ELISA檢測試劑盒說明書進行檢測,在450 nm波長依序測量吸光度(A值)。
4逆轉錄定量PCR(qRT-PCR)檢測細胞衰老相關分子端粒酶逆轉錄酶(telomerasereversetranscriptase,TERT)、p53、p16、p21和p27mRNA表達
4.1引物的設計與合成 TERT游引物5’-CGAAAGAGTGTCTGGAGCAA-3’,下游引物5’-GGATGAAGCGGATTCTGGA-3’;p53上游引物5’- CAGCTTTGAGGTTGGTGTTTGT -3’,下游引物5’- ATGCTCTTCTTTTTTGCGGAAA-3’;p16上游引物5’-CATCTCCGAGAGGAAGGCGAACT-3’,下游引物5’-CGCAGTTCGAATCTGCACCATAG-3’;p21上游引物5’-ATGTCCGATCCTGGTGATGT-3’,下游引物5’-GGGCTTTCTCTTGCAGAAGA- 3’; p27上游引物5’-GAGGGCAGATACGAGTGGCAG-3’,下游引物5’-CTGGACACTGCTCCGCTAACC-3’;β-actin上游引物5’-CACCCGCGAGTACAACCTTC-3’, 下游引物5’- CCCATACCCACCATCACACC -3’。
4.2RNA提取與逆轉錄反應 取100 mg大鼠卵巢放入研磨器中,加入1 mL Trizol,提取卵巢組織RNA。將4 μL總RNA、1μL 隨機六聚體引物在離心管中混合,補DEPC水至10 μL,65 ℃保溫5 min,置于冰上;每管中再加入4 μL 5×RT緩沖液,2 μL DTT,2 μL 10 mmol/L dNTP,1 μL RNA酶抑制劑和1 μL逆轉錄酶,小心混勻,按25 ℃ 5 min、42 ℃ 60 min、72 ℃ 10 min的程序處理樣品,獲得cDNA。
4.3實時定量PCR 將cDNA按照1∶5的比例進行稀釋;建立PCR體系后,在實時定量PCR儀上按程序95 ℃ 30 s,[95 ℃ 10 s、60 ℃ 31 s(40個循環)] 進行PCR。
5組織切片HE染色觀察卵巢結構
常規脫蠟水化,Harris蘇木素染色 4-8 min;自來水洗返藍15-30 min;0.5%伊紅染色30s-60s;依次梯度乙醇脫水,二甲苯透明;中性樹膠封片;觀察結果并照相記錄。
6特異性脂褐素原染色觀察卵巢組織衰老狀況
用組織衰老特異性脂褐素染色試劑盒進行卵巢組織染色,封片觀察拍照。
7免疫組化檢測細胞衰老相關分子P53、P16、P21和P27蛋白表達
常規脫蠟水化;3%H2O2消除內源性過氧化物酶;10%血清封閉;滴加適當比例稀釋的Ⅰ抗或Ⅰ抗工作液,4 ℃過夜;PBS沖洗,5 min×3次;滴加適當比例稀釋的生物素標記Ⅱ抗,37 ℃孵育10-30 min; PBS沖洗,5 min×3次;滴加適當比例稀釋的辣根酶標記鏈霉卵白素(PBS稀釋),37 ℃孵育10-30 min;PBS沖洗,5 min×3次;DAB顯色劑顯色;自來水充分沖洗,蘇木素復染,封片觀察結果照相。
8雌性大鼠產仔數量及仔鼠存活率觀察
隨機取健康雄性大鼠分別與模擬失重組雌性大鼠和相應對照組雌性大鼠合籠,比較產仔鼠數量和存活率。
9統計學處理
結 果
1模擬失重組雌性大鼠血清E2、FSH和LH濃度升高
各組大鼠血清中性激素水平見表1,結果顯示與各地面對照組相比,各模擬失重組雌鼠E2水平顯著下降,均有顯著差異(Plt;0.05),各模擬失重組雌鼠FSH和大鼠LH水平均有所上升,與對照組相比均有顯著差異(Plt;0.05)。
2模擬失重組雌性大鼠卵巢組織中卵泡數量減少,卵巢組織出現衰老現象
與地面對照組相比,各模擬失重組大鼠卵巢組織中卵泡數量減少,見圖1。與各對照組相比,各模擬失重組雌性大鼠卵巢組織衰老脂褐素染色出現棕色陽性信號,表明卵巢組織發生衰老現象,見圖2。

表1 模擬失重對雌性大鼠血清中性激素水平的影響
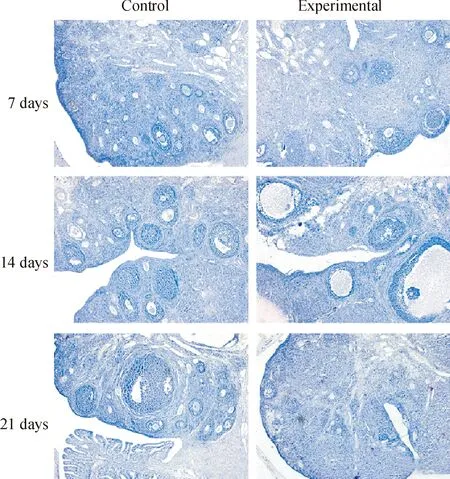
Figure 1. The results of HE staining showed that the number of ovarian follicle in the experimental groups reduced compared with the control groups(×100).
3模擬失重組雌性大鼠卵巢細胞衰老相關分子TERT、p53、p16、p21和p27mRNA表達變化
與各正常對照組相比,TERT在各模擬失重組大鼠卵巢組織表達受到抑制,顯著差異(Plt;0.05);在細胞周期中起關鍵調控作用的p53、p16、p21、和p27的表達則呈現升高趨勢,與各對照組相比均存在顯著差異(Plt;0.05),見表2。

表2 細胞衰老相關分子TERT、p53、p16、p21和p27 mRNA的表達變化
4模擬失重組雌性大鼠卵巢細胞衰老相關分子P53、P16、P21和P27蛋白的表達變化
與各對照組相比,各模擬失重組P53、P16、P21和P27表達陽性的細胞顯著增多,見圖3-6。對各切片分別進行計算機掃描和數據分析,結果表明,與各對照組相比,各模擬失重組棕色陽性信號明顯增強,(Plt;0.01),見表3。
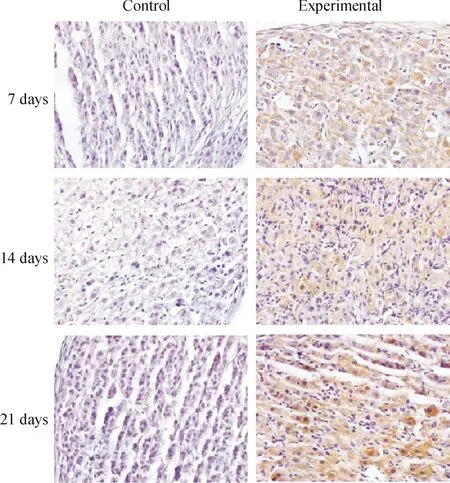
Figure 3. Immunohistochemical staining(×600).The result showed that P53 protein expression of ovarian increased in simulated weightlessness rats compared with the controls.
5模擬失重組雌性大鼠生育功能減低
分別將各對照組和模擬失重組雌性大鼠與雄性Wistar大鼠同籠,計數雌鼠生育仔鼠的數目及仔鼠存活率。結果顯示,與各對照組相比,各模擬失重組雌性大鼠生育仔鼠的數目明顯減少(Plt;0.05),各模擬失重組雌性大鼠生育的仔鼠存活率明顯下降,(Plt;0.01),見表4。
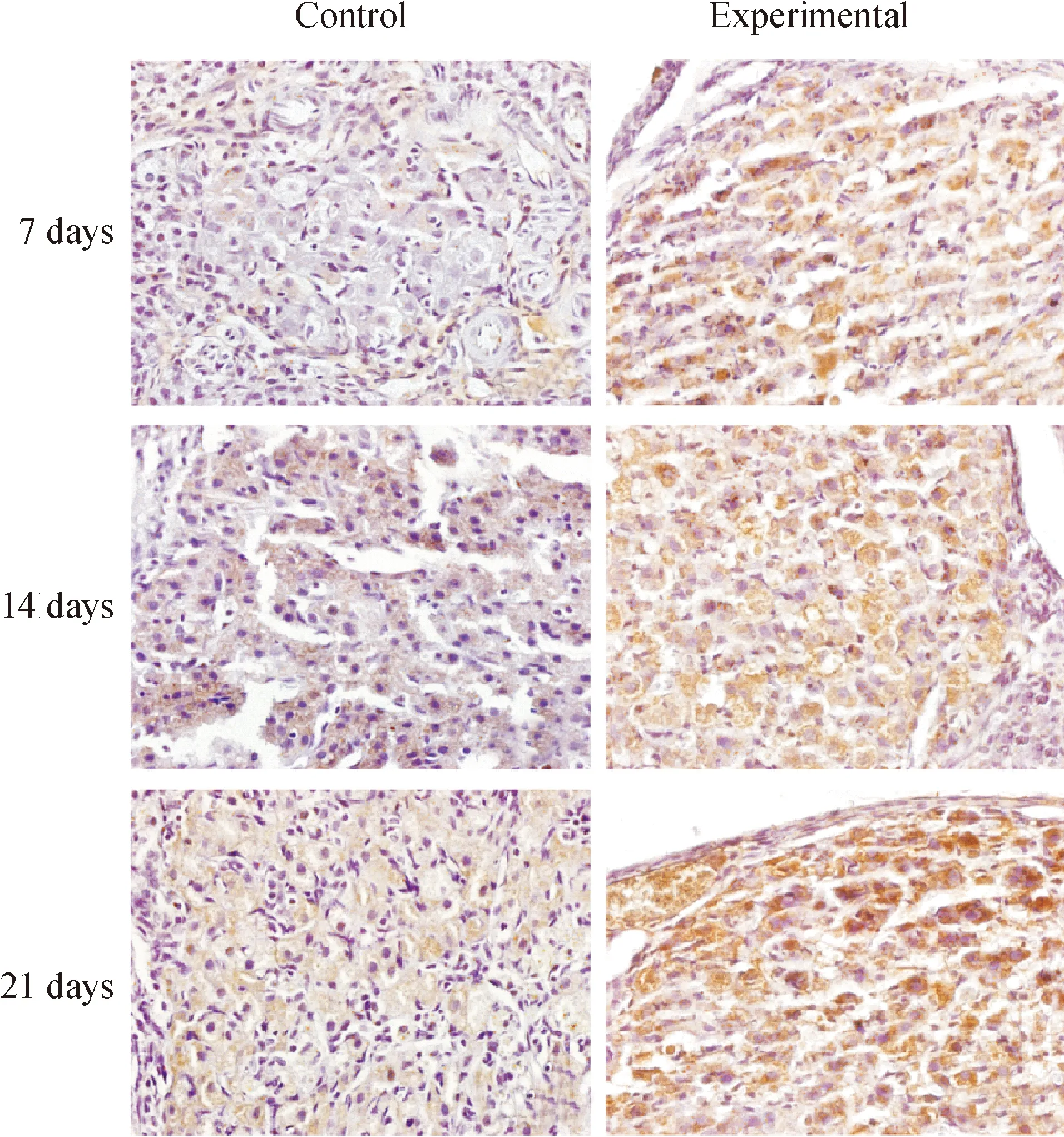
Figure 4. Immunohistochemical staining(×600). The result showed that P16 protein expression of ovarian increased in simulated weightlessness rats compared with the controls.

Figure 5. Immunohistochemical staining(×600). The result showed that P21 protein expression of ovarian increased in simulated weightlessness rats compared with the controls.
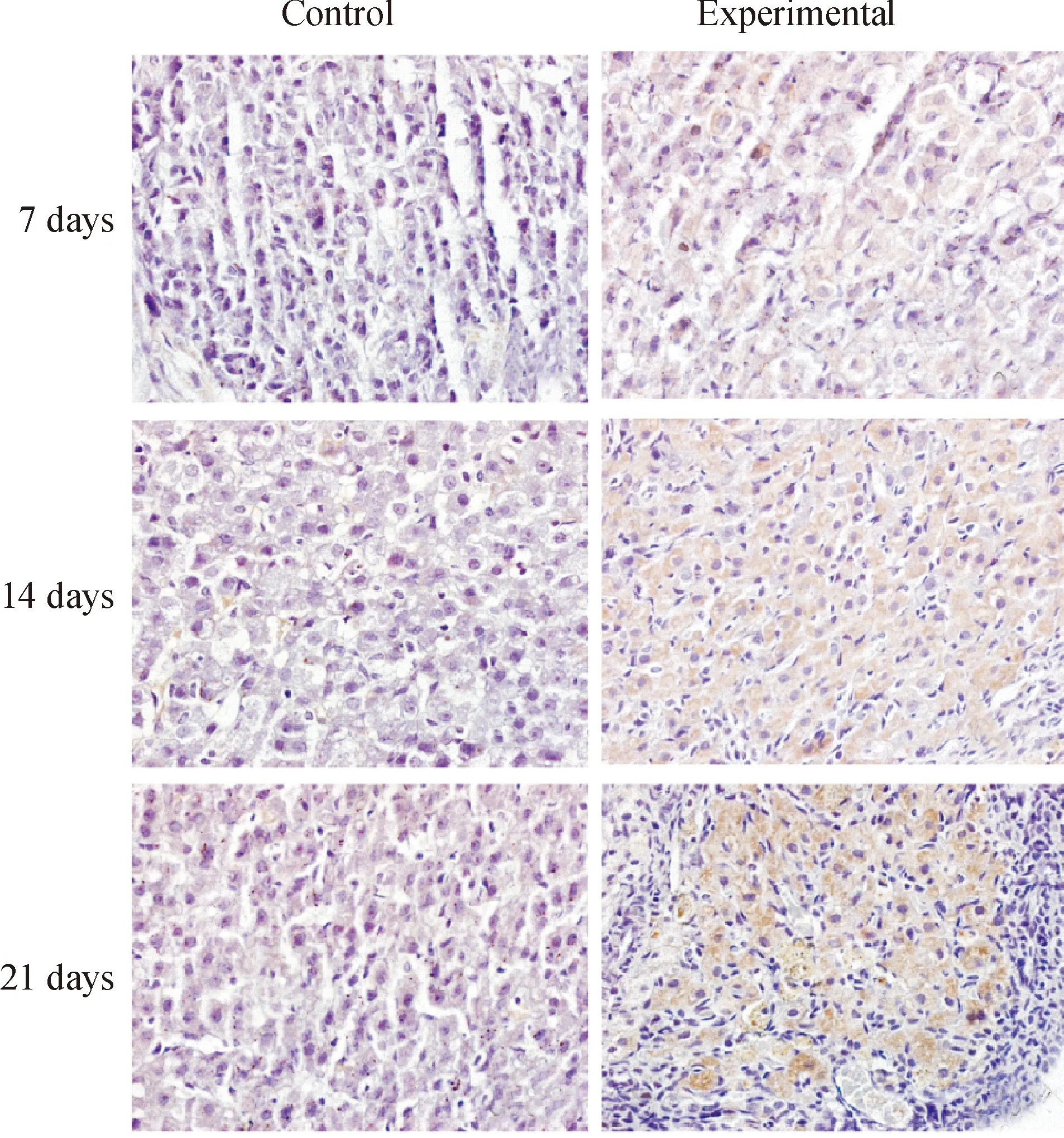
Figure 6. Immunohistochemical staining(×600). The result showed that P27 protein expression of ovarian increased in simulated weightlessness rats compared with the controls.

表3 細胞衰老相關分子P53、P27、P21和P16蛋白表達變化
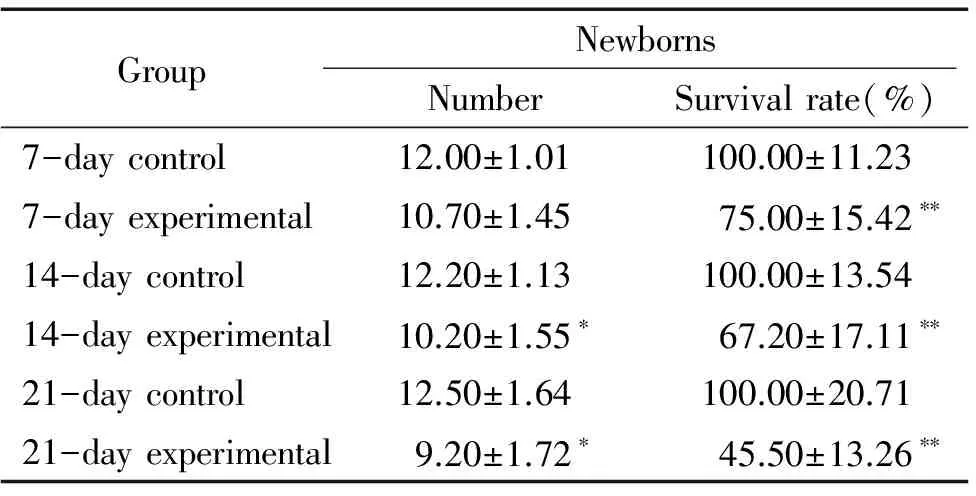
表4 模擬失重對雌性大鼠生育仔鼠數和仔鼠存活率的影響
討 論
地面模擬失重狀態對生命活動規律影響的研究將為太空失重環境的生命保障體系建立提供可借鑒的參考線索。對于人類而言,40歲以前的育齡女性出現卵巢功能減退的現象,稱為卵巢早衰(premature ovarian failure,POF),其后果是生育障礙和內分泌功能紊亂,失重狀態能否導致卵巢早衰及其發生機制未見研究。
本研究運用鼠尾懸吊法模擬失重狀態,研究模擬失重對雌性大鼠卵巢功能的影響及其發生機制。卵巢功能受下丘腦-垂體-卵巢軸內分泌系統調控,我們采用ELISA方法對各組大鼠血清中E2、FSH和LH水平進行了檢測,結果顯示模擬失重組大鼠較各地面對照組E2水平明顯下降,FSH和LH水平上升;血清E2下降是生育力減低的重要原因[6]。卵巢分泌的E2下降通過下丘腦-垂體-性腺軸的負反饋機制導致垂體分泌FSH和LH增加,因此,FSH和LH明顯升高也是卵巢功能衰退的表現[7]。我們的研究表明鼠尾懸吊模擬失重可引起下丘腦-垂體-卵巢軸內分泌功能紊亂,卵巢生殖功能衰退。
組織切片HE染色發現模擬失重大鼠卵巢中卵泡數量減少;模擬失重大鼠卵巢組織衰老特異性脂褐素染色陽性率顯著高于各對照組,表明模擬失重可導致雌性大鼠卵巢細胞衰老。細胞衰老(cell senescence)是指細胞不可逆地脫離細胞周期并喪失增殖能力后進入的一種相對穩定的衰老狀態,但在一段時間內仍存在代謝活性[8]。在這一過程中,端粒縮短、衰老相關的信號分子P53、P16及下游的P21等在其中發揮作用[9]。TERT是端粒酶發揮作用的限速成分,通過TERT的誘導端粒酶被激活,是細胞逃逸衰老的重要環節。細胞周期相關分子P53、P21和P16是啟動細胞逃逸衰老程序的重要效應分子。最近研究還發現P27也參與了細胞的衰老進程。為明確鼠尾懸吊模擬失重導致卵巢細胞衰老的分子機制,我們運用逆轉錄定量PCR(qRT-PCR)和免疫組化技術對上述衰老相關重要分子的表達進行了檢測。結果顯示,與各正常地面組相比,各尾懸吊模擬失重組TERT的表達受到抑制,而P53、P16、P21和P27的表達則顯著上升。這表明鼠尾懸吊模擬失重可導致大鼠卵巢細胞端粒活性下降,細胞周期受阻,細胞發生衰老,進而使生殖功能受損。
卵巢功能受損的重要生物學效應是生育能力下降。為此,我們將各組雌性大鼠與正常雄性大鼠同籠,通過與各對照組大鼠比較,我們發現模擬失重組大鼠生育的仔鼠數量明顯減少,更為重要的是仔鼠的死亡率顯著上升。由此可見,尾懸吊模擬失重使雌性大鼠的生育能力下降。我們發現鼠尾懸吊模擬失重可通過抑制端粒活性、阻遏細胞周期,誘導雌性大鼠卵巢細胞衰老,同時下丘腦-垂體-卵巢軸內分泌功能紊亂,進而使雌性大鼠的生殖功能受損,該初步研究結果對進一步研究失重與生殖的關系提供了參考性線索。
[1] 周黨俠, 邱曙東, 王志勇,等. 尾懸吊狀態對性成熟期雄性大鼠生殖功能的影響[J]. 中華男科學雜志, 2006, 12(4): 326-329.
[2] Wronski TJ, Morey-Holton ER. Skeletal response to simulated weightlessness: a comparison of suspension techniques[J]. Aviat Space Environ Med, 1987,58(1):63-68.
[3] Sharma CS, Sarkar S, Periyakaruppan A, et al. Simulated microgravity activates apoptosis and NF-κB in mice testis[J]. Mol Cell Biochem, 2008,313(1-2):71-78.
[4] 王俊鋒,劉長庭,李向紅,等. 血管內皮生長因子在尾懸吊模擬失重大鼠肺組織中表達的研究[J]. 中國病理生理雜志,2002, 18(11):1392-1395.
[5] Wang KX, Shi Y, Denhardt DT. Osteopontin regulates hindlimb-unloading-induced lymphoid organ atrophy and weight loss by modulating corticosteroid production[J]. Proc Natl Acad Sci USA, 2007, 104(37):14777-14782.
[6] 馬靈芝,李 爽,夏 天. 卵巢儲備力降低的監測[J]. 現代中西醫結合雜志,2010, 19(11):1425-1427.
[7] 彭國慶,鐘才高,張 瓊,等.甲醛對雌性大鼠卵巢儲備功能的影響[J]. 癌變·畸變·突變,2010, 22(1):32-34.
[8] Hayflick L. The limitedinvitrolifetime of human diploid cell strains[J]. Exp Cell Res, 1965, 37(3):614-636.
[9] Majumder PK, Grisanzio C, O’Connell F, et al. A prostatic intraepithelial neoplasia-dependent p27Kip1checkpoint induces senescence and inhibits cell proliferation and cancer progression[J]. Cancer Cell, 2008, 14(2):146-155.
Effectsofweightlessnesssimulatedbytail-ventrofixationonreproductivefunctionsinfemalerats
JIA Mu-tian1, 2, SONG Xin-chen1,2, ZHANG Yi-ming1,2, WANG Li-xiang1
(1DepartmentofPharmacology,ShandongUniversitySchoolofMedicine,Jinan250012,China;2ShandongExperimentalHighSchool,Jinan250001,China.E-mail:wanglx@sdu.edu.cn)
AIM: To investigate the effects of weightlessness simulated by tail-ventrofixation on reproductive functions in female rats and the underlying mechanism, and to provide some clues to health protection for the space explorers.METHODSTo mimic the weightless state, the rat model of tail-ventrofixation was set up. Seventy-two female Wistar rats were randomly divided into 6 groups: 7-day,14-day and 21-day tail-ventrofixation groups and the corresponding 3 control groups without tail-ventrofixation. The levels of estradiol (E2), follicle stimulating hormone (FSH) and luteinizing hormone (LH) in the serum were detected by ELISA. The morphological characters of the ovary were examined under microscope with HE staining. The character of senescence was checked by senescence-specific lipofuscin staininginsitu. The RNA of the ovary was extracted to detect the mRNA expression levels of telomerase reverse transeriptase(TERT),p53, p27,p21 and P16 by qRT-PCR. The protein levels except TERT were also detected by immunohistochemistry. The male Wistar rats cohabited with the female ones to test the quantity and the survival rate of their offspring.RESULTSCompared with the corresponding control groups, the serum level of E2decreased in tail-ventrofixation groups (Plt;0.05). However, the levels of FSH and LH increased (Plt;0.05). At the same time, the number of ovarian follicle in tail-ventrofixation groups reduced compared with the corresponding control groups, and the ovary cells showed the characteristics of senescence. The expression of TERT was inhibited in tail-ventrofixation groups compared with the corresponding control groups not only in the level of mRNA but also of the proteins (Plt;0.05). Meanwhile, the expression of p53, p27 and p16 increased (Plt;0.05). Both the number and the survival rate of offspring rats decreased in tail-ventrofixation groups as compared with the corresponding control groups (Plt;0.01).CONCLUSIONThe state of simulated weightlessness results in decreased reproductive functions in female rats. Simulated weightlessness induces cell senescence and endocrine dysfunction of hypothalamus-pituitary-ovarian axis.
Tail-ventrofixation; Weightlessness; Ovary; Reproduction
1000-4718(2011)04-0769-06
R774.1
A
10.3969/j.issn.1000-4718.2011.04.028
2011-01-21
2011-03-10
△通訊作者 Tel:0531-88382036;E-mail:wanglx@sdu.edu.cn

