芹菜素對肺癌細胞的抗增殖作用和抗腫瘤藥物的增敏作用
任環宇,唐修文
(浙江大學醫學院生物化學與遺傳學系,浙江杭州310058)
芹菜素是一種低毒、非誘變性的黃酮類物質[1],存在于許多水果和蔬菜(大白菜、青椒、大蒜、芹菜和番石榴等)中[2]。研究報道,芹菜素具有預防腫瘤的作用。在體外細胞和體內腫瘤模型中,其可以促進金屬螯合,清除自由基以及激活Ⅱ相解毒酶[3];在鼠皮膚和結腸癌模型中證明,其具有保護組織對致癌物質的侵襲[4-5]。芹菜素是鳥氨酸脫羧酶的強抑制劑,而該酶在腫瘤誘發中起關鍵作用,局部應用芹菜素可以抑制二甲基苯并蒽誘導的皮膚癌[6]。芹菜素還可降低紫外線誘導的癌癥發生率[4]。在吸煙人群中,芹菜素等黃酮類化合物的攝入與肺癌的發生呈負相關[7]。據報道,芹菜素可抑制人宮頸癌hela細胞[8]、前列腺癌CA-HPV-10[9]細胞等腫瘤細胞的增殖,在體內或體外抑制多種腫瘤細胞的擴散和侵襲[10-14],誘導乳腺癌、前列腺癌、結腸癌、胰腺癌和白血病細胞等多種腫瘤細胞的細胞周期停滯和凋亡[9,15-18]。芹菜素可抑制人類前列腺癌PC-3細胞、人類卵巢癌OVCAR-3細胞以及乳腺癌ZR-75-30細胞在動物模型中腫瘤的血管生成[10,14,19]。尤其是,芹菜素可以顯著地抑制前列腺癌CA-HPV-10細胞的生長,而對人類正常前列腺上皮細胞抑制作用很弱,表現出特異性抗腫瘤作用。類似的選擇性抑制效應也被發現于人類鱗狀細胞癌A431細胞和人類正常表皮角質化細胞中[9];并 且,芹 菜 素 可 增 強 TRAIL(tumor necrosis factor-related apoptosis-inducing ligand)誘導多種腫瘤細胞的凋亡,如人類急性淋巴細胞白血病Jurkat細胞、人類前列腺癌DU145細胞和人類結腸癌DLD-1細胞,而對正常的人類外周血單核細胞無增強作用[2]。芹菜素也可以增強順鉑(cisplatin)對黑素瘤B16-BL6細胞在小鼠體內生長的抑制作用[12]。因此,芹菜素不但自身具備抗腫瘤活性,并且與抗癌藥物聯用也表現出較好的抗腫瘤效果。
肺癌作為癌癥最多發的形式,是世界范圍內引起癌癥死亡最主要的病因之一[20]。肺癌的高致死率,一方面是由于缺乏有效的早期檢測手段,另一方面是腫瘤對許多治療處理產生了抗性[10]。芹菜素已被發現可以抑制非小細胞肺癌A549細胞的增殖以及在裸鼠中抑制其腫瘤生長和血管生成;并且,芹菜素可以通過半胱天冬酶和線粒體依賴通路(caspase-and mitochondria-dependent pathways)來誘導非小細胞肺癌 A549 和 H460 的細胞凋亡[10,21-22]。本研究首次證明芹菜素可以增強肺癌細胞對抗癌藥物的敏感性。這將對在非小細胞肺癌中提高抗腫瘤藥物的治療效果以及藥物的聯合治療起到一定的指導意義。
1 材料和方法
1.1 材料
1.1.1 主要試劑 DMEM購自GIBCO,胰蛋白酶購自上海生工,新生牛血清購自杭州四季青生物工程材料有限公司,抗生素antibioticantimycotic購自GIBCO。四甲基偶氮唑鹽[3-(4,5-dimethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetrazolium,inner salt;MTS]和吩嗪硫酸甲酯(phenazine methosulfate,PMS)購自 Promega,二甲基亞砜(DMSO)、芹菜素 (apigenin)、博來霉素(bleomycin)和奧沙利鉑(oxaliplatin)購自Sigma。芹菜素用DMSO配制成50 mmol/L,博來霉素用DMSO配制成20 mmol/L,奧沙利鉑用5%葡萄糖配制成12.5 mmol/L,均于-20℃避光貯存。
1.1.2 細胞培養 人肺癌細胞株A549、H460、LTEP-a2和 NCI-H292均購自上海生命科學研究院,細胞在含15%新生牛血清和1%抗生素的DMEM培養基,37℃、5%CO2培養箱中培養。實驗時,取對數生長期細胞,按所需細胞數量種板,細胞貼壁后加藥處理。
1.2 方法
1.2.1 臺盼藍染色細胞計數 取對數生長期肺癌細胞,分別按1×104個/孔種24孔平底細胞培養板,過夜貼壁后,棄去培養基,每孔加入含選定濃度(A549細胞用10 μmol/L和 20 μmol/L 2個濃度,其它細胞分別用30 μmol/L和50 μmol/L 2個濃度)芹菜素的 DMEM(含1%抗生素)培養基500 μl,根據孵育時間分3組:24 h、48 h和72 h組,每組3個復孔;到規定的孵育時間后,棄去培養基,每孔用150 μl胰酶消化,并用等體積的培養基終止,吹成均勻細胞懸液;然后,取部分懸液臺盼藍染色,在顯微鏡下用血球計數板計算活細胞數。
1.2.2 MTS法檢測抗癌藥物的抗細胞增殖作用 取對數生長期的肺癌細胞,按1×104個/孔種96孔平底細胞培養板,貼壁后棄去培養基,試驗組每孔加入不同濃度(A549細胞中10 μmol/L,H460 細胞中50 μmol/L,LTEP-a2 細胞中30 μmol/L,H292 細胞中20 μmol/L)芹菜素的DMEM(含1%抗生素)培養基 200 μl,并設不加藥空白和加DMSO的對照組,過夜處理后,棄去培養基,用1×PBS洗1遍。然后,用含1%抗生素的DMEM培養基稀釋配制不同濃度的博來霉素和奧沙利鉑,設不加藥空白對照組和DMSO對照組,每個濃度設3個復孔,每孔200 μl藥液處理,37℃、5%CO2培養箱中孵育48 h終止,加入MTS/PMS混合液(DPBS∶MTS∶PMS=10∶10∶1)40 μl/孔,再于 37℃、5%CO2培養箱中繼續孵育0.5~1 h后,用全波長酶標儀在490 nm波長下檢測OD值。
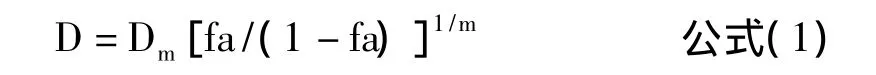
其中,D代表濃度,Dm代表半數抑制濃度,fa代表抑制率;
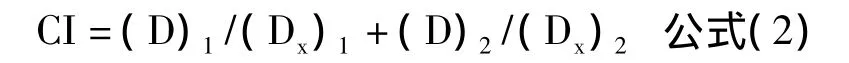
其中,(D)1和(D)2分別代表兩種藥物聯用時各自的濃度,x代表其聯用產生的抑制率。(Dx)1和(Dx)2則表示達到聯用相同抑制效果所需的其中任何一種藥物的濃度,需要分別由公式(1)進行計算得出。CI=1代表積和作用,CI<1代表協同作用,CI>1代表拮抗作用。
2 結果
2.1 芹菜素抑制腫瘤細胞的增殖作用 4種肺癌細胞分別選用2個濃度的芹菜素孵育24 h、48 h和72 h,然后用血小板計數器分別計算芹菜素處理后的細胞數目。結果表明,芹菜素能抑制4種肺癌細胞的增殖(圖1),并且這種增殖抑制作用呈一定的劑量效應。在24 h、48 h和72 h 3個時間點,10 μmol/L的芹菜素使A549細胞的增殖分別被抑制到對照組的77%、45%和82%;而30 μmol/L的芹菜素,使H460細胞的增殖分別被抑制到對照組的81%、85%和37%,使LTEP-a2細胞的增殖分別被抑制到對照組的48%、65%和66%,使H292細胞的增殖分別被抑制到對照組的44%、49%和63%。
2.2 芹菜素增強肺癌細胞對抗腫瘤藥物的敏感性 為避免芹菜素自身毒性過大,干擾增敏實驗,本研究在 A549、H460、LTEP-a2和 H292細胞聯合用藥的芹菜素濃度分別選定為10 μmol/L、50 μmol/L、30 μmol/L 和 20 μmol/L(圖2A、B)。經公式(1)和公式(2)分別計算出奧沙利鉑和博來霉素在上述4種肺癌細胞聯用前后的IC50值(圖2),以及芹菜素分別與奧沙利鉑和博來霉素聯用時每個濃度點的CI值(表1和表2)。圖2C-F示芹菜素能增加抗癌藥物奧沙利鉑和博來霉素的毒性,芹菜素過夜預處理使得每實驗組抗癌藥物的IC50值都顯著下降。在A549細胞中,博來霉素的IC50值由94.91 μmol/L 降至 12.46 μmol/L,奧沙利鉑的IC50值由115.87 μmol/L 降至 60.59 μmol/L;在H460細胞中,博來霉素的 IC50值由250.36 μmol/L 降至 14.71 μmol/L,奧沙利鉑的 IC50值由1 177.91 μmol/L 降 至 27.55 μmol/L;在LTEP-a2細胞中,博來霉素的IC50值由1 075.30 μmol/L 降至140.09 μmol/L,奧沙利鉑的 IC50值由22.54 μmol/L 降至 5.11 μmol/L;在 H292 細胞中,博來霉素的IC50值由144.95 μmol/L降至57.43 μmol/L,奧 沙 利鉑的 IC50值 由 95.60 μmol/L降至55.86 μmol/L。再者,每個實驗組中的芹菜素與抗癌藥物在每個濃度處的聯合作用指數(CI值)絕大多數都小于1(表1、表2)。這提示芹菜素能很好地增強肺癌細胞對抗癌藥物的敏感性,與抗癌藥物有協同作用。
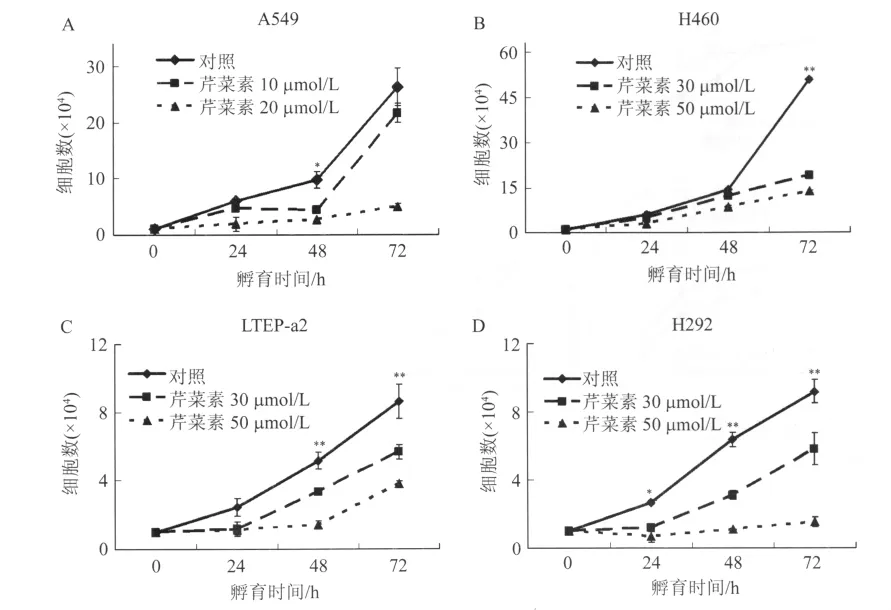
圖1 芹菜素抑制肺癌細胞的增殖Fig.1 The proliferation of lung cancer cells suppressed by apigenin
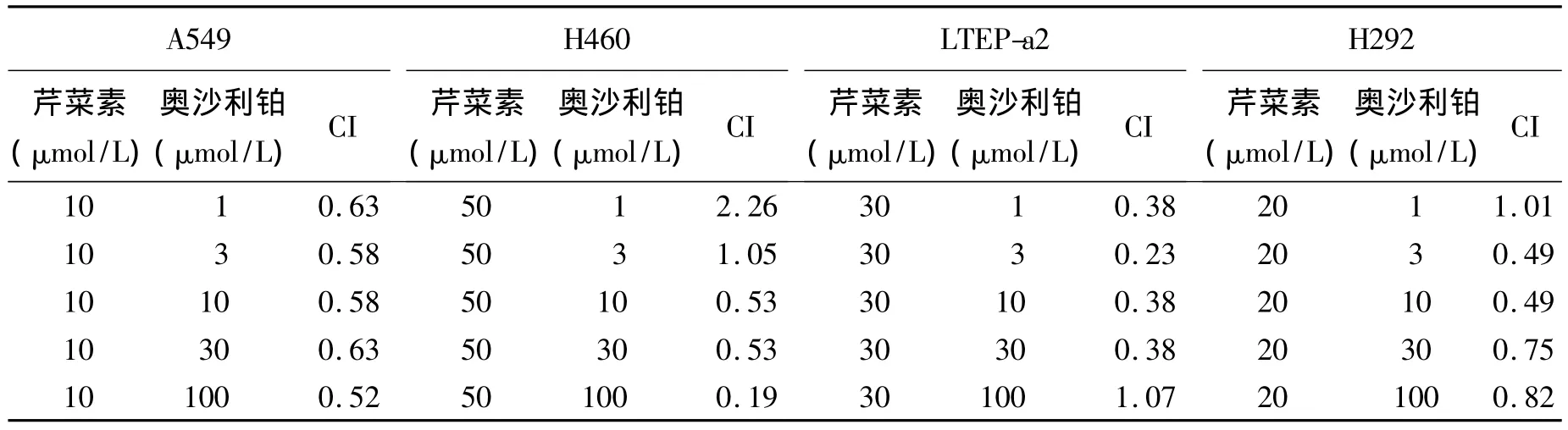
表1 芹菜素在肺癌細胞中與奧沙利鉑聯用的CI值Table 1 Analysis of combined treatment of apigenin with oxaliplatin in lung cancer cells combination index
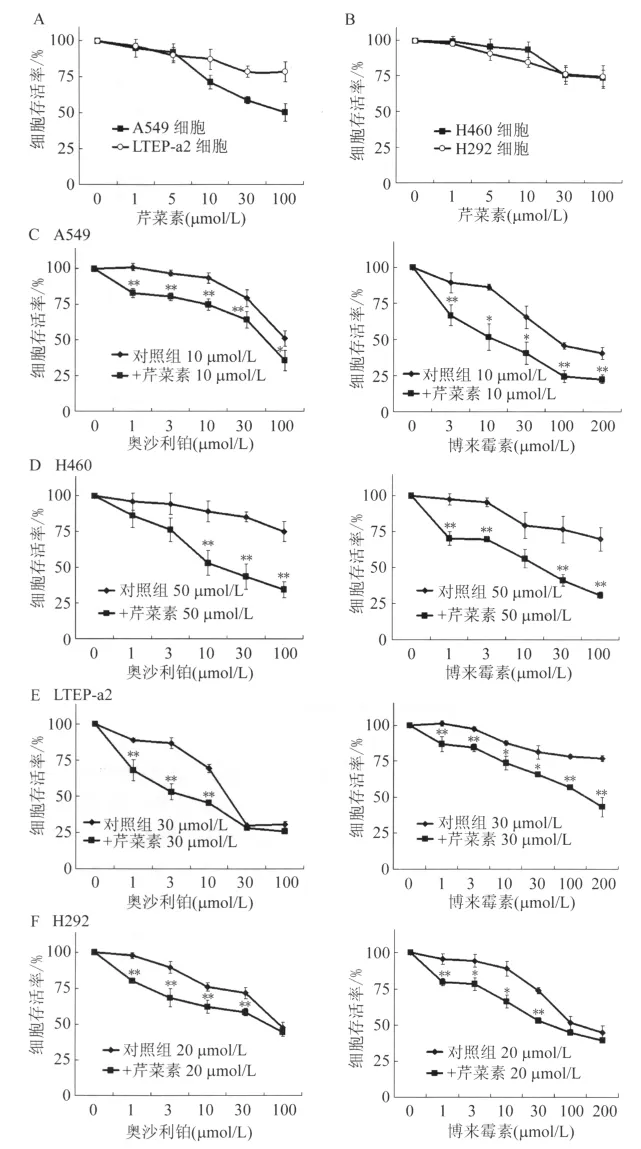
圖2 芹菜素對4種肺癌細胞的毒性以及增強肺癌細胞對抗癌藥物的敏感性Fig.2 The increased susceptibility oflung cancercellsby apigenin to antitumor drugs
3 討論
Abate等人發現芹菜素在鼠胚胎成纖維細胞(MEF)中可以抑制氯化血紅素(hemin)誘導的 HO-1蛋白水平和mRNA 表達[25],而 Kim 等指出,在肺癌細胞中,Nrf2-HO-1信號通路與癌細胞對順鉑產生耐藥性密切相關,利用HO-1小干擾RNA或ZnPPIX抑制HO-1的表達,可增強A549細胞對順鉑的敏感性[26]。除HO-1外,其它由Nrf2信號通路調控的下游基因,如Ⅱ相解毒酶、抗氧化酶及藥物流出泵等的表達也與腫瘤耐藥性相關[27]。另外,Nrf2 信號通路也被證明可以調控細胞內谷胱甘肽的水平[28],而細胞內谷胱甘肽平衡及谷胱甘肽依賴的酶在腫瘤細胞對抗癌藥物的耐藥性方面起關鍵作用[29]。最近,辛愛等通過在人肺癌H460細胞中轉染Nrf2-shRNA建立的Nrf2降表達的穩定細胞株,與對照組相比,谷胱甘肽水平顯著減低,奧沙利鉑的細胞毒性顯著增加[30]。而之前,Kachadourian等報道,在A549細胞和人類前列腺癌PC-3細胞中,芹菜素可以顯著降低谷胱甘肽水平[31],因此,我們推測芹菜素很有可能通過調節谷胱甘肽水平來增敏肺癌細胞,而且此過程可能與 Nrf2信號通路有關。
總之,本研究證實了芹菜素在肺癌細胞中具有廣泛的抗增殖作用,尤其是可以增敏肺癌細胞,提高抗癌藥物的效果。這提示芹菜素將在今后的肺癌臨床治療中具有廣闊的前景,其在體內應用的安全性及毒副反應有待進一步的研究。
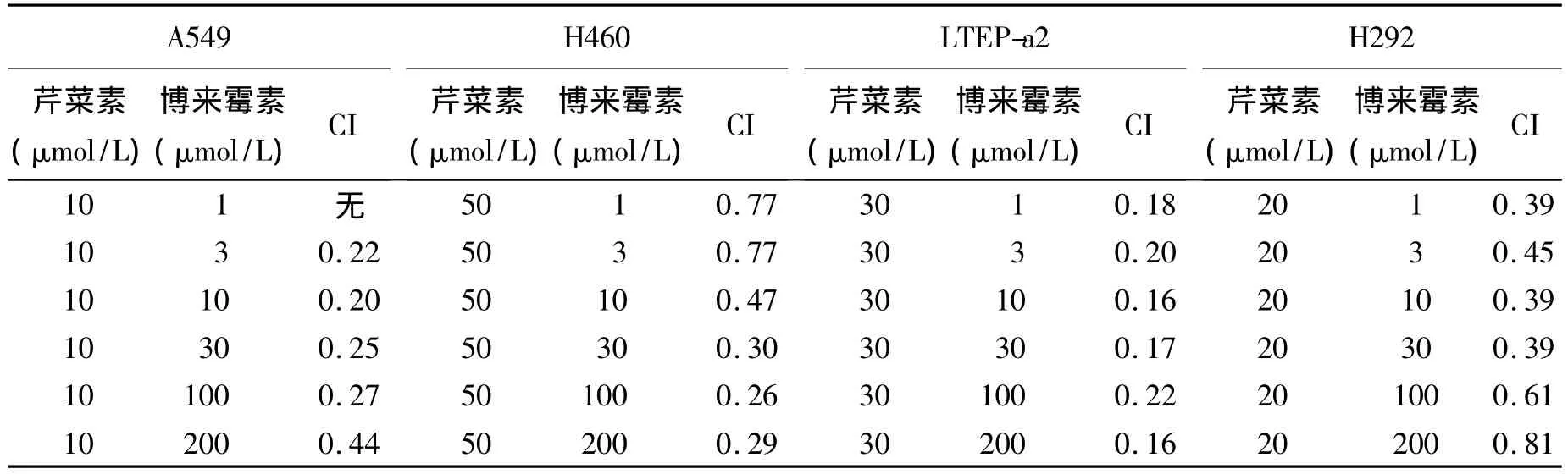
表2 芹菜素在肺癌細胞中與博來霉素聯用的CI值Table 2 Analysis of combined treatment of apigenin with bleomycin in lung cancer cells:combination index
[1]CZECZOT H,TUDEK B,KUSZTELAK J,et al.Isolation and studies of the mutagenic activity in the Ames testofflavonoidsnaturallyoccurringin medical herbs[J].Mutat Res,1990,240(3):209-216.
[2]HORINAKA M,YOSHIDA T,SHIRAISHI T,et al.The dietary flavonoid apigenin sensitizes malignant tumor cells to tumor necrosis factorrelated apoptosis-inducing ligand [J].Mol Cancer Ther,2006,5(4):945-951.
[3]MIDDLETON E JR, KANDASWAMIC,THEOHARIDES T C.The effects ofplant flavonoids on mammalian cells:implications for inflammation,heartdisease,and cancer [J].Pharmacol Rev,2000,52(4):673-751.
[4]BIRT D F,MITCHELL D,GOLD B,et al.Inhibition of ultraviolet light induced skin carcinogenesis in SKH-1 mice by apigenin,a plant flavonoid [J].Anticancer Res,1997,17(1A):85-91.
[5]VAN DROSS R,XUE Y,KNUDSON A,et al.The chemopreventive bioflavonoid apigenin modulates signal transduction pathways in keratinocyte and colon carcinoma cell lines[J].J Nutr,2003,133(11 Suppl 1):3800S-3804S.
[6]WEI H,TYE L,BRESNICK E,et al.Inhibitory effect of apigenin,a plant flavonoid,on epidermal ornithine decarboxylase and skin tumor promotion in mice[J].Cancer Res,1990,50(3):499-502.
[7]CUI Y,MORGENSTERN H,GREENLAND S,et al.Dietary flavonoid intake and lung cancer-a population-based case-control study [J].Cancer,2008,112(10):2241-2248.
[8]ZHENG P W,CHIANG L C,LIN C C.Apigenin induced apoptosis through p53-dependent pathway in human cervical carcinoma cells [J].Life Sci,2005,76(12):1367-1379.
[9]GUPTA S,AFAQ F,MUKHTAR H.Selective growth-inhibitory,cell-cycle deregulatory and apoptotic response of apigenin in normal versus human prostate carcinoma cells [J].Biochem Biophys Res Commun,2001,287(4):914-920.
[10]LIU L Z,FANG J,ZHOU Q,et al.Apigenin inhibits expression of vascular endothelial growth factor and angiogenesis in human lung cancer cells:implication ofchemoprevention oflung cancer[J].Mol Pharmacol,2005,68(3):635-643.
[11]CZYZ J,MADEJA Z,IRMER U,et al.Flavonoid apigenin inhibitsmotility and invasivenessof carcinoma cells in vitro[J].Int J Cancer,2005,114(1):12-18.
[12]CALTAGIRONE S,ROSSI C,POGGI A,et al.Flavonoids apigenin and quercetin inhibit melanoma growth and metastatic potential[J].Int J Cancer,2000,87(4):595-600.
[13]LINDENMEYER F,LI H,MENASHI S,et al.Apigenin acts on the tumor cell invasion process and regulates protease production [J].NutrCancer,2001,39(1):139-147.
[14]XIE Ming-jun,JIANG Xiong(謝明均,姜 雄).The impact of apigenin on cell invasion in vitro and vasculargenesis of human breast cancer[J].Sichuan Medical Journal(四川醫學),2005,26(2):195-196.(in Chinese)
[15]WANG C, KURZER M S.Phytoestrogen concentration determines effects on DNA synthesis in human breast cancer cells[J].Nutr Cancer,1997,28(3):236-247.
[16]WANG W,HEIDEMAN L,CHUNG C S,et al.Cell-cycle arrest at G2/M and growth inhibition by apigenin in human colon carcinoma cell lines[J].Mol Carcinog,2000,28(2):102-110.
[17]UJIKI M B,DING X Z,SALABAT M R,et al.Apigenin inhibits pancreatic cancer cell proliferation through G2/M cell cycle arrest[J].Mol Cancer,2006,5:76.
[18]MONASTERIO A,URDACI M C,PINCHUK I V,et al.Flavonoids induce apoptosis in human leukemia U937 cells through caspase-and caspasecalpain-dependent pathways [J].Nutr Cancer,2004,50(1):90-100.
[19]FANG J,ZHOU Q,LIU L Z,et al.Apigenin inhibits tumor angiogenesisthrough decreasing HIF-1alpha and VEGF expression [J].Carcinogenesis,2007,28(4):858-864.
[20]SINGH A,MISRA V,THIMMULAPPA R K,et al.Dysfunctional KEAP1-NRF2 interaction in nonsmall-cell lung cancer[J].PLoS Med,2006,3(10):1865-1876.
[21]LU H F,CHIE Y J,YANG M S,et al.Apigenin induces caspase-dependent apoptosis in human lung cancer A549 cells through Bax-and Bcl-2-triggered mitochondrial pathway[J].Int J Oncol,2010,36(6):1477-1484.
[22]LU H F,CHIE Y J,YANG M S,et al.Apigenin induces apoptosis in human lung cancer H460 cells through caspase-and mitochondria-dependent pathways[J].Hum Exp Toxicol,2011,30(8):1053-1061.
[23]CHOU T C,MOTZER R J,TONG Y,et al.Computerized quantitation of synergism and antagonism oftaxol,topotecan,and cisplatin againsthuman teratocarcinoma cellgrowth:a rational approach to clinical protocol design[J].J Natl Cancer Inst,1994,86(20):1517-1524.
[24]CHANG T T,GULATI S,CHOU T C,et al.Comparative cytotoxicity of various drug combinations for human leukemic cells and normal hematopoietic precursors[J].Cancer Res,1987,47(1):119-122.
[25]ABATE A,YANG G,WONG R J,et al.Apigenin decreases hemin-mediated heme oxygenase-1 induction[J].Free Radic Biol Med,2005,39(6):711-718.
[26]KIM H R,KIM S,KIM E J,et al.Suppression of Nrf2-driven heme oxygenase-1 enhances the chemosensitivity of lung cancer A549 cells toward cisplatin[J].Lung Cancer,2008,60(1):47-56.
[27]XIN Ai,TANG Xiu-wen(辛 愛,唐修文).The role of Nrf2-ARE signal pathway in tumorigenesis and drug resistance[J].Chinese Journal of Cell Biology(細胞生物學雜志),2009,31(3):319-324.(in Chinese)
[28]LI W G,KONG A N.Molecular mechanisms of Nrf2-mediated antioxidant response [J].Molecular Carcinogenesis,2009,48(2):91-104.
[29]MCLELLAN L I,WOLF C R.Glutathione and glutathione-dependent enzymesin cancerdrug resistance[J].Drug Resist Updat,1999,2(3):153-164.
[30]XIN Ai,REN Huan-yu,TANG Xiu-wen(辛 愛,任環宇,唐修文).Down-regulation of Nrf2 enhances the cytotoxicity of oxaliplatin to H460 cells[J].Journal of Zhejiang University:Medical Sciences(浙江大學學報:醫學版),2010,39(1):11-16.(in Chinese)
[31]KACHADOURIANR, DAY B J.Flavonoidinduced glutathione depletion: potential implications for cancer treatment[J].Free Radic Biol Med,2006,41(1):65-76.

