北京地區80家企業實施新版GMP現狀調查(上)
□文 孔莉 張鳳梅 宋然然
2011年3月1日,《藥品生產質量管理規范》(2010年修訂)即新版GMP已開始實施,新版GMP在給制藥行業帶來發展機遇的同時,也帶來了挑戰。推進新版GMP的難點有哪些?藥品生產企業GMP執行現狀如何?藥品監督管理部門應該如何引導企業貫徹新版GMP的要求?2011年2月~2011年8月,北京市藥品監督管理局藥品認證管理中心在相關部門協同配合下,就此對北京市80家藥品生產企業的GMP實施現狀進行了調查。
部分企業距新版GMP要求仍有差距
此次調查中的80家企業,有無菌制劑企業28家(含生物制品生產企業7家),普通制劑企業42家,中藥飲片企業10家。調查的主要方式為:對17家藥品生產企業新版GMP認證檢查、13家藥品生產企業98年版GMP延續檢查的情況進行分析;現場走訪了36家藥品生產企業并與14家企業座談調研;對藥品生產企業日常監管情況的匯總分析;召開聯席會,收集來自監管部門和業內專家的相關意見。
筆者在調查中了解到,截至目前,北京市持有《藥品生產許可證》的藥品生產企業共計247家。取得北京市頒發GMP證書(包括按劑型或品種)的261個、取得國家局證書86個。根據2009年度北京市醫藥行業分析報告,北京藥品生產企業(統計總數123家)主營業務收入億元以上企業共有35家(占28%)。北京醫藥工業總產值、主營業務收入和利潤總額分別列全國第9位、第8位和第5位。化學制劑子行業的三個指標均位列第4名。生物制藥的工業總產值、主營業務收入均列全國第9名,利潤總額位列第4名。北京市的醫藥行業指標中,利潤總額排位最好的位居第5,總產值位居第9,主營業務收入位居第8。2009年,化藥制藥和生物制藥增長強勁,而中成藥一直增長乏力,中藥飲片則出現了負增長(-6.6%)。
本次調研根據選擇有代表性企業、范圍涵蓋各類型企業的基本原則,確定了36家藥品生產企業,采取與藥監分局聯合、劃片、分系統的方式收集調研情況,并進行匯總。評估企業現狀與新版GMP要求的差距,分析企業執行新版GMP可能存在的難點問題;對參加新版GMP認證、延續效期檢查的情況進行回顧,分析目前企業普遍存在的問題。
此次調查中,先后對36家藥品生產企業新版GMP執行情況進行了走訪調查。調查顯示,在人員情況方面,18家企業(占50%)能夠做到關鍵崗位人員相對固定;28家企業(約占78%)的質量管理人員(含QA、QC)數量與其生產相適應(見附圖1);33家企業(約占92%)的質量負責人、生產負責人具有大學專科以上相關學歷。
在潔凈級別設置方面,32家(約占89%)無菌制劑生產企業關鍵工序的潔凈級別為C級(見附圖2),16家(約占44%)企業灌裝工序為C+B級以上(見附圖3)。
在物料和產品檢驗方面,23家(約占64%)企業盡可能保證對原輔料進行全檢,29家(約占81%)企業能夠對成品進行全檢(見附圖4),其中5家(約占14%)企業由于沒有標準品而不能完成全檢;大部分企業能夠對中間產品進行控制,但在控制項目的設定方面,缺少充分的科學評估。
在生產工藝及供應商的穩定性方面,有27家(占75%)藥品生產企業未改變藥品生產的工藝及參數;19家(約占53%)企業未變更過供應商(見附圖5)。
在生產過程中動態監測方面,有19家(約占53%)無菌制劑生產企業能夠做到前、中、后監測懸浮粒子;有7家(約占19%)企業能夠做到微生物檢測項目全過程監測(見附圖6)。
在確認和驗證方面,絕大部分企業對關鍵生產設備、生產工藝、清潔方法、檢驗方法開展了確認和驗證,但只有23家(約占64%)企業真正開展了變更控制、偏差管理、風險評估,3家(約占8%)企業能夠將年度質量回顧、驗證和確認的數據運用于藥品生產過程控制。
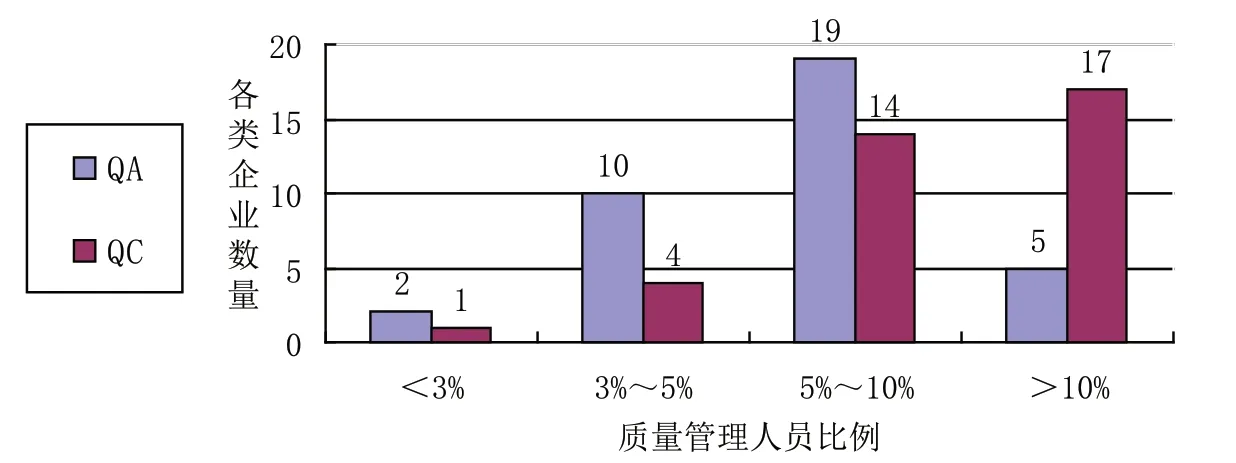
附圖1 藥品生產企業質量管理人員占比適應情況
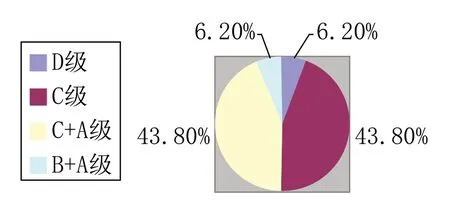
附圖2 無菌制劑企業關鍵工序潔凈級別情況
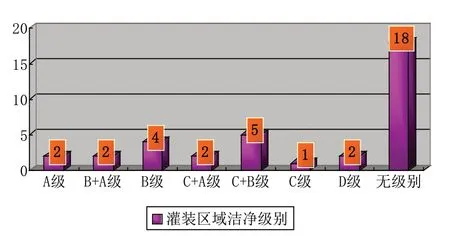
附圖3 藥品生產企業灌裝區潔凈級別分布圖
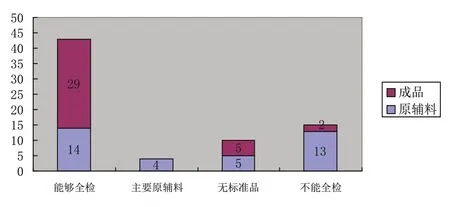
附圖4 藥品生產企業物料全檢情況

附圖5 藥品生產企業供應商變更情況統計
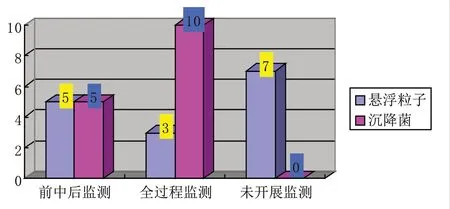
附圖6 藥品生產企業動態監測情況統計
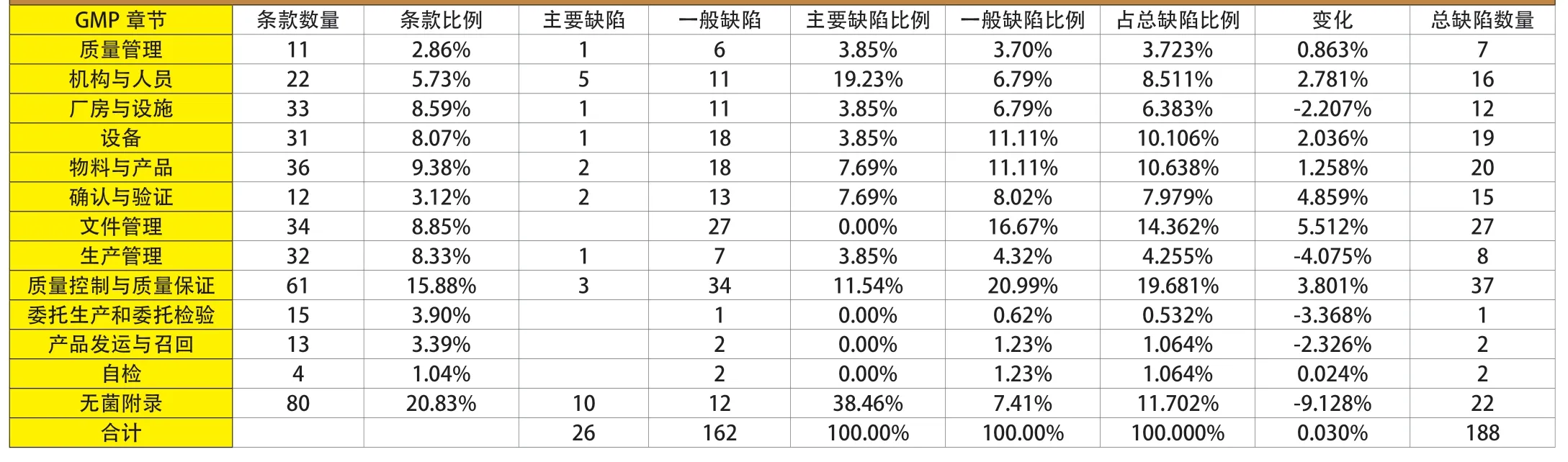
附表 新版GMP認證檢查各類缺陷分布情況
在產品穩定性考察方面,有27家(占75%)企業開展了生產品種的穩定性考察工作;18家(占50%)企業對生產過程中的中間產品、半成品、待包裝產品的有效期進行了考察;27家(占75%)企業對標準品、對照品及標準溶液、對照品溶液、菌種傳代的使用和銷毀進行了登記。
在自檢方面,18家(占50%)企業認真開展GMP自檢,并做了詳細、切合實際的自檢報告和自檢記錄。
缺陷項目集中于關鍵崗位和新要求
筆者對已按新版GMP實施認證檢查的17家藥品生產企業(北京市認證的5家和國家認證的12家),以及按1998年版GMP標準延續證書有效期的10家北京市藥品生產企業現場檢查中發現的缺陷進行了匯總。
通過匯總對比,筆者發現缺陷項目相對集中于關鍵崗位和新版GMP中的新要求。缺陷分布情況統計見附表。
“總缺陷占比”數據顯示,企業的缺陷主要集中于質量控制和質量保證、文件管理及無菌附錄。
“主要缺陷占比”數據顯示,企業的主要缺陷主要集中于無菌附錄、機構與人員及質量控制和質量保證。
“一般缺陷占比”數據顯示,企業的一般缺陷主要集中于質量控制和質量保證、文件管理設備及物料與產品。
通過對本次調研數據和現場檢查情況的匯總分析,筆者認為,企業實際執行情況與新版GMP要求的差距主要表現在7個方面:質量管理體系的有效性不足,人員培訓的有效性、針對性和持續性不足,廠房設施防止污染和交叉污染的措施不足,物料管理方面的規范性和可追溯性不足,確認和驗證的科學性與充分性不足,文件管理方面的規范性不足,無菌灌裝操作風險的控制措施不足。

▲藥監工作人員在藥品生產企業檢查

