β-連環蛋白和DNMT1在子宮內膜腺癌中表達的關系及意義
蘭翀,徐洪濤
(1.沈陽市婦嬰醫院婦科,沈陽 110011;2.中國醫科大學基礎醫學院病理學教研室,沈陽 110001)
β-連環蛋白(β-catenin)既是細胞黏附分子,又是Wnt信號傳導通路激活的的關鍵,它作為一種癌基因,與結直腸癌[1]、肺癌[2]、子宮內膜腺癌[3]等多種惡性腫瘤的發生、發展和侵襲轉移關系密切。DNA甲基化是導致抑癌基因失活和腫瘤發生發展的重要表觀遺傳學因素。DNA甲基轉移酶1(DNA methyltransferase 1,DNMT1)的異常表達與結腸癌等多種惡性腫瘤的發生發展有關[4]。但目前有關DNMT1在子宮內膜腺癌中表達和作用的研究還很少[5],DNMT1與 β-catenin在子宮內膜腺癌中表達的關系和意義尚不清楚。為此,本研究采用免疫組化方法檢測DNMT1與β-catenin在子宮內膜腺癌中的表達情況和相互關系,及其與子宮內膜腺癌臨床病理因素的關系。
1 材料與方法
1.1 材料
1.1.1 病例與標本:86例子宮內膜腺癌組織和正常子宮內膜組織標本隨機選自于中國醫科大學附屬第一醫院病理科2007-2010年存檔石蠟組織標本。患者平均年齡57.3歲(45~72歲),術前均未接受放化療。根據WHO(2004年)女性生殖系統腫瘤分類標準分為子宮內膜樣腺癌78例、漿液性腺癌4例、透明細胞癌4例,其中高分化52例、中分化20例、低分化14例。根據1988年國際婦產科協會(FIGO)子宮內膜腺癌分期標準,分為Ⅰa期10例,Ⅰb期44例,Ⅰc期28例,Ⅱ期2例,Ⅲ期2例。
1.1.2 試劑:鼠抗人DNMT1單克隆抗體(sc-70981)購自美國SANTA CRUZ生物技術公司,鼠抗人βcatenin單克隆抗體(610153)購自美國BD Transduction Laboratories,S-P超敏免疫組化試劑盒(KIT-9710)和DAB酶底物顯色試劑盒(DAB-0031)均購自福州邁新生物技術公司。
1.2 方法
將石蠟包埋組織標本制成4 μm切片,經二甲苯脫蠟、梯度乙醇脫苯、水化后,進行免疫組化染色,按試劑說明書操作,DNMT1和β-catenin一抗稀釋倍數均為1∶200,以PBS取代一抗作為陰性對照。結果判定:每例標本選取5個高倍視野,每個視野計數100個癌細胞,計數陽性癌細胞占癌細胞總數的百分比。若β-catenin的細胞膜表達率≥10%則判定該例標本為存在細胞膜表達;若細胞質表達率≥10%則判定為異常細胞質表達;若有超過10%細胞出現細胞核表達,則判定為β-catenin核表達。本研究中,DNMT1在正常子宮內膜組織中均為陰性表達,所以當DNMT1的陽性表達率≥10%時,則判定該例標本為DNMT1表達陽性。
1.3 統計學分析
采用χ2檢驗和似然比法分析β-catenin、DNMT1的表達與子宮內膜腺癌臨床病理因素的關系;采用Spearman等級相關分析DNMT1與β-catenin表達的關系。P<0.05為差異有統計學意義。
2 結果
2.1 β-catenin的異常表達與子宮內膜腺癌的分化不良有關
本研究中,β-catenin在正常子宮內膜腺體上皮中為細胞膜表達并伴有少量細胞質表達,未見細胞核表達,但在子宮內膜腺癌中細胞膜表達顯著減少或消失,而細胞質和細胞核表達明顯增加。在86例子宮內膜腺癌中,僅觀察到4例標本存在β-catenin細胞膜表達,而有54例標本(54/86,62.80%)出現β-catenin的細胞漿異常表達,其中有6例同時伴有細胞核表達(6/86,6.98%)。如表1所示,在中-低分化的子宮內膜腺癌中,β-catenin的異常漿表達率(26/34,76.47%)明顯高于高分化的子宮內膜腺癌組織(28/52,53.85%)(P=0.034)。β-catenin 的異常表達還與子宮內膜腺癌的組織學類型有關(P=0.003),但與FIGO分期(P=0.246)和患者的年齡(P=0.105)無明顯關系。
2.2 DNMT1的表達與子宮內膜腺癌的分化程度和FIGO分期相關
正常子宮內膜腺體中均未見DNMT1表達,而在子宮內膜腺癌中則出現了不同程度的DNMT1陽性表達(38/86,44.19%)。如表1所示,在中-低分化的子宮內膜腺癌中,DNMT1的陽性表達率(20/34,58.82%)明顯高于高分化的子宮內膜腺癌組織(18/52,34.62%)(P=0.027)。而 FIGO 分期高的病例,DNMT1的陽性表達率也明顯高于FIGO分期低的病例(P=0.027)。另外,DNMT1的表達還與子宮內膜腺癌的組織學類型有關(P=0.004),但與患者的年齡無明顯關系(P=0.531)。
2.3 β-catenin的異常表達與DNMT1的陽性表達相關
86例子宮內膜腺癌病例中,54例出現βcatenin異常表達,而在這54例中有36例同時發現DNMT1的陽性表達,經Spearman相關分析發現βcatenin的異常細胞質表達與DNMT1的陽性表達顯著相關(r=0.588,P<0.001)。而 6例出現 β-catenin核表達的子宮內膜腺癌中也有4例為DNMT1陽性表達,但由于例數較少,未發現顯著的相關性(r=0.124,P=0.255)。
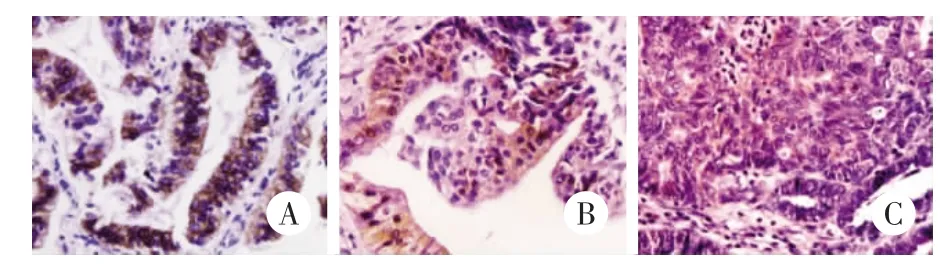
圖1 β-catenin和DNMT1在子宮內膜腺癌組織中的表達 免疫組化S-P法×400Fig.1 The expressions of β-caten in and DNM T1 inendom etrial adenocarcinom atissues Immunoh istochem istryS-P method×400
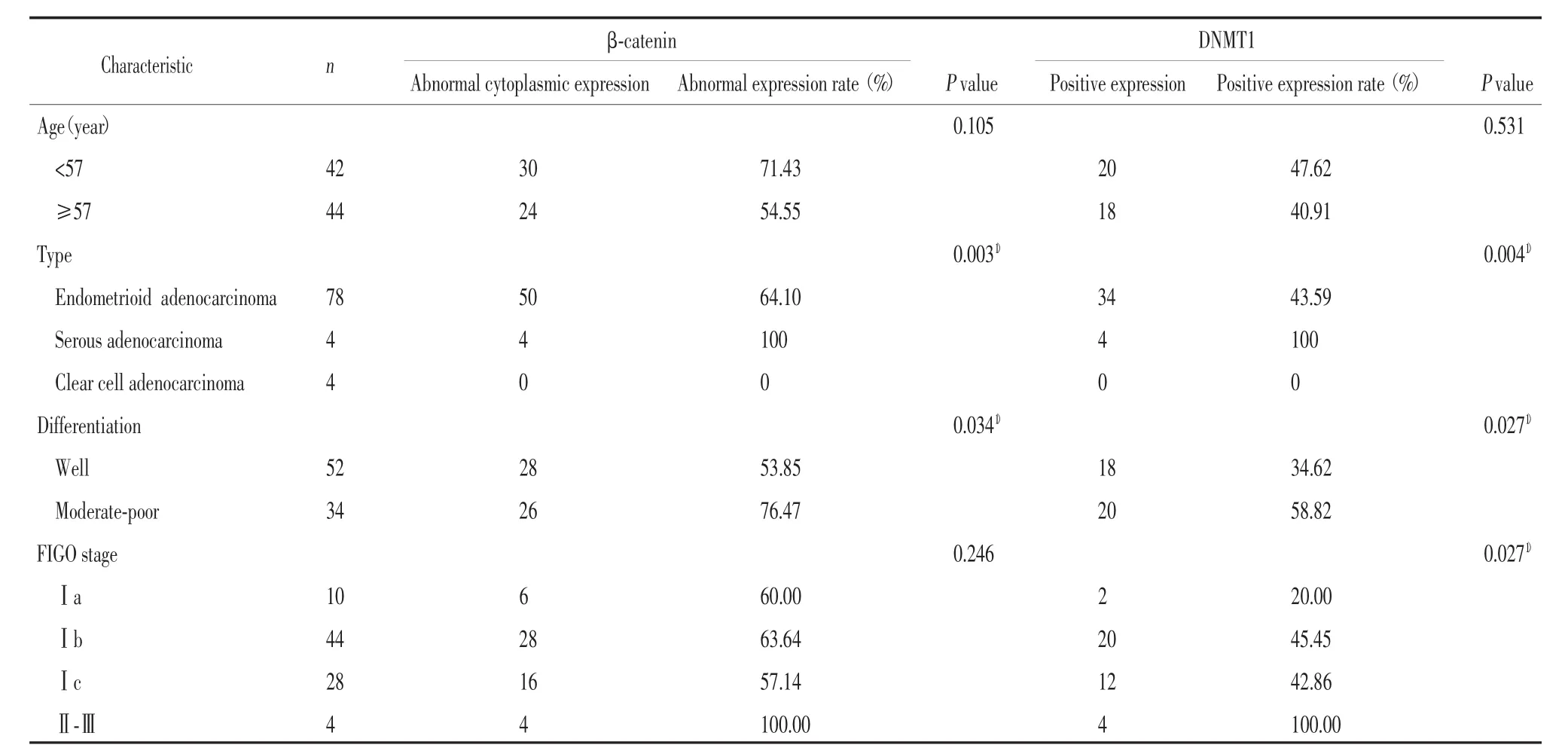
表1 β-catenin和DNMT1的表達與子宮內膜腺癌臨床病理因素的關系Tab.1 The relat ionships between β-catenin,DNMT1 expressi on and clini copat hologic characteri stics of endom etria lcancer
3 討論
子宮內膜腺癌是婦科最常見的惡性腫瘤之一,占女性生殖道惡性腫瘤的20%~30%[6]。Wnt信號傳導通路的激活可能在子宮內膜腺體的惡性轉化過程中發揮了重要作用[7]。β-catenin在細胞質、核內的異常蓄積是Wnt通路激活的關鍵。而β-catenin蓄積的主要原因可能是其基因CTNNB1第3外顯子的突變或APC-Axin-GSK3降解復合體的功能障礙[1,2]。有報道在子宮內膜腺癌中發現了β-catenin的細胞核蓄積和其基因CTNNB1的突變[3,8]。本研究中,β-catenin在子宮內膜腺癌中的異常細胞漿表達明顯高于正常子宮內膜組織,并在6例標本中出現了細胞核表達。同時,本研究發現β-catenin的異常表達與子宮內膜腺癌的低分化程度相關,與以往的研究相似[9],表明子宮內膜腺癌中存在β-catenin的異常蓄積和Wnt通路的激活,并參與了子宮內膜腺癌的發生和惡性進展中。
有研究發現,在腫瘤中APC、Dab2等Wnt信號通路的抑制基因有啟動子甲基化的現象[10]。而啟動子甲基化就可能導致APC等抑癌基因表達下調,從而引起β-catenin異常蓄積和Wnt通路激活。DNMT是調控DNA甲基化的關鍵分子,與惡性腫瘤中抑癌基因的甲基化、失活和腫瘤的發生發展、侵襲轉移有關[4]。那么,DNMT1的表達是否與β-catenin的蓄積和Wnt通路的激活有關呢?目前有關DNMT1在子宮內膜腺癌中表達的研究較少[5],尚未見DNMT1與β-catenin在子宮內膜腺癌中表達關系的報道。為此,本研究檢測了DNMT1在子宮內膜腺癌中的表達情況,并分析其與β-catenin蓄積的關系。結果發現,DNMT1在癌組織中的表達顯著高于正常子宮內膜組織,并與子宮內膜腺癌的低分化程度和高FIGO分期有關。更重要的是,本研究首次發現在子宮內膜腺癌中,DNMT1與β-catenin的細胞質表達顯著正相關,這表明二者之間存在著直接或間接的協同作用。腫瘤中DNMT1的表達增加有可能通過促進APC、Axin等抑癌基因的甲基化,從而促進βcatenin的失調控和蓄積,另外,β-catenin也可能通過多種靶基因產物直接或間接地促進DNMT1的表達。二者可能具有相互調控、相互協同,共同促進子宮內膜腺癌進展的作用,有待今后深入研究。
綜上所述,β-catenin的異常表達與子宮內膜腺癌的低分化程度相關;DNMT1的陽性表達與子宮內膜腺癌的低分化和高FIGO分期相關;DNMT1與βcatenin的細胞質表達顯著正相關。深入研究DNMT1和Wnt信號通路之間的表達調控機制將有可能為在子宮內膜腺癌的診斷和基因靶向治療提供新的線索和思路。
[1]Lugli A,Zlobec I,Minoo P,et al.Prognostic significance of the wnt signalling pathway molecules APC,beta-catenin and E-cadherin in colorectal cancer:a tissue microarray-based analysis [J].Histopathology,2007,50(4):453-464.
[2]Xu HT,Wang L,Lin D,et al.Abnormal beta-catenin and reduced axin expression are associated with poor differentiation and progression in non-small cell lung cancer [J].Am J Clin Pathol,2006,125(4):534-541.
[3]Bansal N,Yendluri V,Wenham RM.The molecular biology of endometrial cancers and the implications for pathogenesis,classification,and targeted therapies[J].Cancer Control,2009,16(1):8-13.
[4]Foran E,Garrity-Park MM,Mureau C,et al.Upregulation of DNA methyltransferase-mediated gene silencing,anchorage-independent growth,and migration of colon cancer cells by interleukin-6[J].Mol Cancer Res,2010,8(4):471-481.
[5]Liao X,Siu MK,Chan KY,et al.Hypermethylation of RAS effector related genes and DNA methyltransferase 1 expression in endometrial carcinogenesis[J].Int J Cancer,2008,123(2):296-302.
[6]樂杰.婦產科學[M].7版,北京:人民衛生出版社,2008:272.
[7]Samarnthai N,Hall K,Yeh IT.Molecular profiling of endometrial malignancies[J].Obstet Gynecol Int,2010,2010:162363.
[8]Xiong Y,Xiong YY,Zhou YF.Expression and significance of betacatenin,Glut-1 and PTEN in proliferative endometrium,endometrial intraepithelial neoplasia and endometrioid adenocarcinoma [J].Eur J Gynaecol Oncol,2010,31(2):160-164.
[9]Wincewicz A,Baltaziak M,Kanczuga-Koda L,et al.Aberrant distributions and relationships among E-cadherin,beta-catenin,and connexin 26 and 43 in endometrioid adenocarcinomas[J].Int J Gynecol Pathol,2010,29(4):358-365.
[10]Tong JH,Ng DC,Chau SL,et al.Putative tumour-suppressor gene DAB2 is frequently down regulated by promoter hypermethylation in nasopharyngeal carcinoma[J].BMC Cancer,2010,10:253.

