耐力訓練引起大鼠免疫機能低下及補充中藥多糖的干預效果研究
周麗麗 伊木清 王啟榮 高紅 許葆華 楊則宜
國家體育總局運動醫學研究所(北京 100029)
長期高強度訓練增加運動員上呼吸道感染的危險性,這與運動員免疫功能下降有關[1]。神經內分泌系統具有重要的免疫調節功能[2],下丘腦室旁核(PVN)是下丘腦-垂體-腎上腺(HPA)軸活動的直接控制部位[3],下丘腦-垂體-腎上腺(HPA)軸激活引起的外周效應為糖皮質類固醇(主要為皮質醇)分泌增加,這是機體主要的應激反應體系之一[4],高濃度的糖皮質激素可選擇性抑制細胞免疫功能[5,6]。運動可誘發機體多種細胞因子發生變化,許多細胞因子有激活HPA軸活動的作用,IL-1、IL-6等對HPA軸有強興奮作用[4]。本研究采用流動水池建立大鼠遞增負荷游泳訓練模型,觀察6周耐力訓練后大鼠血清和外周血單核細胞(PBMC)培養后上清液IL-1β含量變化、下丘腦室旁核IL-1R表達和血清皮質酮含量的變化,探討IL-1及其受體與HPA軸活化的可能關系和意義,同時選用牛膝多糖和黃芪多糖進行干預,為改善耐力訓練引起的免疫低下尋找干預措施。
1 材料與方法
1.1 動物分組與飼養
6周齡、體重110~130g的SPF/VAF級雄性Wistar大鼠48只(購自北京維通利華實驗動物技術有限公司,質量合格證號0043356),在清潔級動物房常規飼養近1周后,通過游泳能力篩檢篩選出40只大鼠,按體重隨機分為安靜對照組、耐力訓練組、訓練+黃芪多糖組、訓練+牛膝多糖組4組,每組10只。清潔級動物房室內溫度為20℃~26℃,濕度50% ~70%,晝夜節律用日光燈控制,每日光照時間12小時(早8點~晚8點),大鼠分籠飼養,每籠最多5只,自由進食和飲水。
1.2 中藥多糖補充方案
黃芪多糖(APS)提取物(購自浙江霍夫曼德公司)和牛膝多糖(APBS)提取物(購自上海實久科技有限公司)用雙蒸水配制。從正式實驗開始,每日上午訓練開始前60分鐘對大鼠進行灌胃1次。訓練+黃芪多糖組按2 g·kg-1劑量(相當于黃芪多糖1 g·kg-1)灌服黃芪多糖提取物,訓練+牛膝多糖組按1 g·kg-1劑量(相當于牛膝多糖0.7·kg-1)灌服牛膝多糖提取物,安靜對照組和耐力訓練組灌服等量安慰劑(雙蒸水)。
1.3 訓練方案
安靜對照組不運動,其他3組在流動游泳水池中進行訓練。水深50~60 cm(約為大鼠體長的1.5~2倍),水溫32±2℃,水流量4 m3/h。每天上、下午各訓練1次,每周訓練5天,共6周,訓練時間由40 min/d逐漸增加到160 min/d,具體訓練方案見表1。

表1 大鼠游泳訓練方案(時間×次數)
1.4 取材
最后一次訓練結束36小時后取材。采用25%烏拉坦按0.5 m l·100g-1體重的劑量進行腹腔麻醉,真空肝素鋰抗凝采血管腹主動脈取血,用于外周血單個核細胞(PBMC)的分離與培養,帶分離膠全血真空管制備血清后放于?80℃低溫冰箱,用于測定IL-1β、睪酮、皮質醇。酒精消毒腹部后剖開腹腔,行左心室至主動脈插管,經4%多聚甲醛約150m l灌注固定后,取出腦組織,每組取3只大鼠腦組織測定下丘腦IL-1R。因測試試劑和采血量限制,部分指標測試樣本數有所減少。
1.5 檢測指標和方法
1.5.1 血清指標
采用ELISA方法測定血清IL-1β,試劑盒為美國Biosource公司產品。采用放射免疫分析法測定血清睪酮和皮質酮,試劑盒均為美國DSL公司產品。
1.5.2 PBMC分泌IL-1β的測定
在超凈臺上按無菌操作分離PBMC細胞。分離方法及其無菌細胞懸液的制備方法見文獻[6],最后用RPmi1640將細胞懸液濃度調整到2×106個細胞/m l。
在24孔板上每個樣品設2孔,每孔加細胞懸液1 m l,加入有絲分裂原 ConA(終濃度為 5 μg/m l),將培養板置于37℃、5%CO2培養箱中培養36小時后收獲培養上清液,2000 r/min離心10分鐘,上清移出置-80℃凍存,用ELISA方法測定上清液IL-1β(試劑盒為美國Biosource公司產品)。
1.5.3 下丘腦IL-1R表達測定
取腦組織放入30%蔗糖溶液浸泡,4℃過夜。經干冰-正己烷(?70℃)驟冷,參照大鼠腦圖譜進行下丘腦室旁核定位,做額狀面連續切片(20 μm),將4張切片裱于同一張玻片上。
腦組織Nissl染色:Nissl染液20分鐘,蒸餾水洗,50%酒精分色,無水乙醇脫水,二甲苯透明,樹膠封固。
腦組織免疫化學染色:冷凍切片經冷風吹干后,用PV-6001/6002二步法顯示下丘腦室旁核IL-1R。加入3%H2O2孵育10分鐘,阻斷內源性過氧化氫酶;加入兔抗鼠多克隆抗體(1:100),37℃放置1 h,4℃冰箱過夜,第2日取出,室溫放置1 h,用0.01MPBS沖洗;滴加羊抗兔IgG抗體-HRP多聚體(1:100),37℃,1 h,用0.01MPBS沖洗;加入DAB復合物顯色5~10分種,用0.01MPBS沖洗,蒸餾水終止反應;50%、70%、80%、95%酒精脫水各5分鐘,100%酒精脫水5分鐘2次,二甲苯透明,樹膠封固。
光密度測定:免疫組織化學染色后,每組取3只動物,每只動物取2~3張片子,每張片子隨機取3個視野,在相同的光學和光源條件下,采用Leica公司Q550CW圖像分析系統采集圖像和Qw in圖像分析軟件分析測定觀察部位的平均光密度值(AOD)。
1.6 統計學分析
使用SPSS for Windows 11.0統計分析軟件完成,用One-Way ANOVA進行方差分析,方差齊次性時,采用LSD法進行多組之間比較;方差不齊次性時,用Tamhane’s T2法復選項進行多組之間比較。統計數值用mean±SD表示,顯著性差異水平 α = 0.05。
2 結果
2.1 血清和PBMC培養后上清液IL-1β含量
表2顯示,耐力訓練組血清IL-1β含量最高,與安靜對照組相比有顯著性差異(P < 0.01)。2個補充組大鼠血清IL-1β顯著低于耐力訓練組(P <0.05),而與安靜對照組水平接近(P > 0.05)。
耐力訓練組大鼠PBMC培養后上清液IL-1β含量最高,與安靜對照組相比有顯著性差異(P <0.01)。2個補充組PBMC生成IL-1β能力高于安靜對照組(分別高26.1%、21.3%),低于耐力訓練組(分別低10.2%、13.6%),但均無統計學意義。
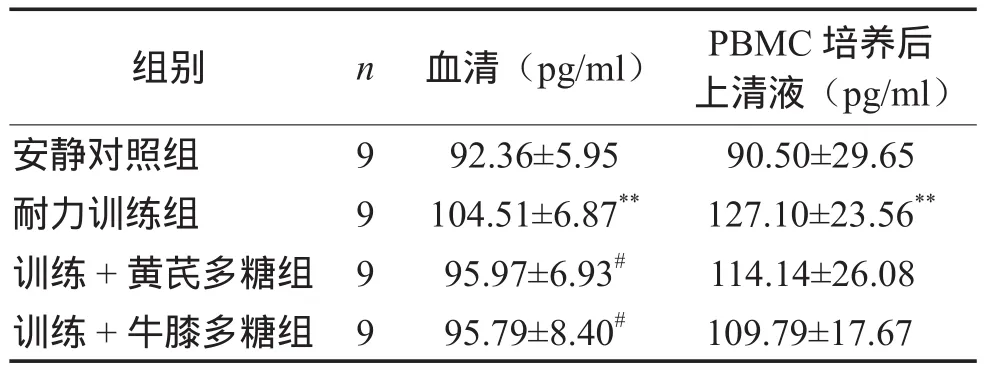
表2 各組大鼠血清和PBMC培養后上清液IL-1β含量比較
2.2 下丘腦室旁核IL-1R表達
由表3可見,耐力訓練組大鼠下丘腦室旁核IL-1R表達最高,與安靜對照組相比有顯著性差異(P< 0.05)。補充牛膝多糖組大鼠下丘腦室旁核IL-1R表達與安靜對照組相同,顯著低于耐力訓練組(P< 0.01)。補充黃芪多糖組高于安靜對照組,略低于耐力訓練組,但均無統計學意義。
2.3 血清皮質酮和總睪酮含量
表4顯示,耐力訓練組大鼠血清皮質酮含量最高,與安靜對照組相比有顯著性差異(P < 0.05)。補充牛膝多糖組血清皮質酮與安靜對照組相同,但顯著低于耐力訓練組(P < 0.01);補充黃芪多糖組血清皮質酮低于耐力訓練組(低17.3%),高于安靜對照組(高26.5%)。

表3 各組大鼠下丘腦室旁核IL-1R表達比較
耐力訓練組大鼠血清總睪酮最低,與安靜對照組相比有顯著性差異(P < 0.05)。2個補充多糖組血清總睪酮分別高于耐力訓練組54.3%和54.4%,低于安靜對照組21.4%和21.2%。
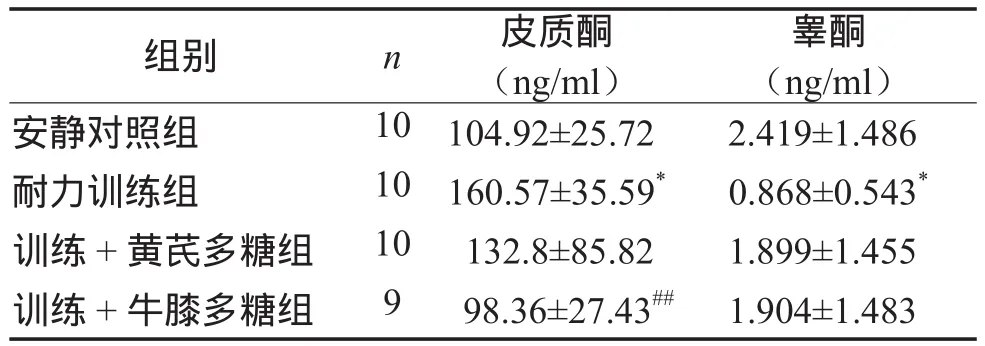
表4 各組大鼠血清睪酮和皮質酮含量比較
3 討論
目前,關于高強度、長期運動影響機體免疫功能的確切機制尚不清楚。高強度、長期運動訓練是一種刺激,會引起機體的應激反應,機體出現的應激反應首先涉及中樞神經系統機能,繼而出現內分泌和免疫系統機能的改變。研究發現,細胞因子不但是重要的免疫調節因子,而且具有廣泛的中樞調節作用[7]。從細胞因子-神經-內分泌調節角度探討訓練對免疫功能的影響已經引起一些學者的關注。
我們以前的研究發現,6周耐力訓練可引起大鼠T細胞數量和功能變化,主要表現為活化的T淋巴細胞數量下降、T細胞亞群中CD4+細胞數量下降及CD4+/CD8+比值下降、T淋巴細胞增殖轉化能力降低等[8-10],這些變化提示6周的耐力訓練可引起大鼠細胞免疫功能下降。
研究顯示運動訓練能引起體液中細胞因子的改變[11,12]。一次運動或長期訓練均可使血漿或血清IL- 1水平或單核/巨噬細胞產生IL-1的能力顯著提高[13,14]。有學者提出,長時間劇烈運動時,由于內臟器官與運動器官之間血液重新分配,機體高代謝反應以及其它未確定的原因,腸腔內革蘭氏陰性菌的胞壁成份LPS穿過腸粘膜屏障移位進入血液,運動者會出現類內毒素血癥反應。LPS進入血液后可以刺激單核-巨噬細胞合成與分泌IL-1等細胞因子,推測這是運動后血漿IL-1等細胞因子濃度增加的一個主要原因[15]。同時IL-1被認為是運動應激刺激釋放的首批細胞因子之一[16],被分類為促炎性細胞因子,通過與相應高親和力受體IL-1R結合發揮作用,有致熱和介導炎癥的作用,與機體免疫反應有密切關系。本研究結果顯示,6周耐力訓練能引起大鼠血清IL-1β含量和PBMC生成IL-1β的能力提高,而訓練同時補充黃芪多糖提取物或牛膝多糖提取物可防止血清中IL-1β含量明顯升高以及PBMC生成IL-1β過多的趨勢。
在生理情況下,腦內的血管內皮細胞、小膠質細胞、星形細胞和神經細胞均具有合成IL-1的能力。外周血中少量IL-1可經腦室周圍組織如正中隆起、終板血管器等進人中樞神經系[17]。IL-1有IL-1α和IL-1β兩種亞型,均須與IL-1R結合后才發揮作用。IL-1和IL-1R在中樞神經系統定位于下丘腦和腦干等部位,下丘腦弓狀核、室旁核等均有IL-1β的免疫陽性細胞,下丘腦、海馬、小腦、大腦皮質等部位均有IL-1R及受體mRNA表達[18-20]。下丘腦室旁核是HPA軸活動的直接控制部位[21,22],IL-1對HPA軸主要是興奮作用,引起的外周效應為糖皮質類固醇(主要為皮質醇)分泌增加,具體表現為IL-1作用于下丘腦神經元,通過HPA軸引起促腎上腺皮質激素(ACTH)及其前體阿黑皮原mRNA表達,最終血漿糖皮質激素(如皮質酮)升高[4,7,23]。IL-1 還能抑制下丘腦-垂體-性腺軸功能(HPG),從而抑制促性腺激素誘導的睪酮分泌,表現為血液睪酮含量下降[24],下丘腦室旁核IL-1R表達升高將有利于IL-1發揮對HPA軸的激活和對HPG軸的抑制作用[4]。本研究結果顯示,6周耐力訓練引起大鼠下丘腦室旁核IL-1R表達升高,同時耐力訓練大鼠血清中皮質酮含量增加、總睪酮含量明顯下降,提示下丘腦IL-1R表達升高、血清中IL-1增高及血清皮質酮升高、睪酮下降這些在耐力訓練中的改變與IL-1及IL-1R對HPA軸的激活和對HPG軸的抑制作用表現的外周效應一致。本實驗關于2種中藥多糖的干預研究顯示,訓練同時補充牛膝多糖或黃芪多糖有防止大鼠下丘腦室旁核IL-1R過多表達的作用,而且牛膝多糖較黃芪多糖更明顯。訓練同時補充牛膝多糖或黃芪多糖有防止血清皮質酮含量明顯升高、總睪酮含量顯著下降的趨勢。
4 總結
耐力訓練引起細胞免疫功能下降可能與血清及PBMC中IL-1β升高和下丘腦室旁核IL-1R表達增加并激活HPA軸有關。訓練補充牛膝多糖或黃芪多糖有防止血清IL-1β升高、降低大鼠下丘腦IL-1R表達過高的作用或趨勢,補充牛膝多糖、黃芪多糖的免疫保護作用可能與其防止HPA軸的過度激活有關。
[1] Martin SA,Pence BD,Woods JA. Exercise and respiratory tract viral infections. Exerc Sport Sci Rev,2009,37(4):157-164.
[2]Habib KE,Gold PW,Chrousos GP. Neuroendocrinology of stress. Endocrinol Metab Clin North Am,2001,30(3):695-728.
[3] 鄧旻,田國燕,史亦謙. 中藥多糖的免疫調節作用研究進展. 醫學研究雜志,2007,36:26-28.
[4] 楊權. 下丘腦-垂體-腎上腺皮質軸應激反應的中樞控制. 生理科學進展,2000,31(3):222-226.
[5] 徐唯. 糖皮質激素與免疫功能的關系及在運動免疫學中的作用. 中國組織工程研究與臨床康復,2008,12(5):954-957.
[6]Zen M,Canova M,Campana C,et al. The kaleidoscope of glucorticoid effects on immune system. Autoimmun Rev,2011 Jan 9.[ Epub ahead of print]
[7] Ga dek-michalska A, Bugajski J. Interleukin-1(IL-1) in stress-induced activation of limbic-hypothalamic-pituitary adrenal axis. Pharmacol Rep,2010,62:969-982.
[8] 周麗麗,王啟榮,伊木清,等. 中藥多糖對耐力訓練大鼠外周血T淋巴細胞亞群及活化T細胞數量的影響.西安體育學院學報,2006,23:63-67.
[9] 周麗麗,王啟榮,伊木清,等. 補充中藥多糖對耐力訓練大鼠淋巴細胞免疫功能低下的預防作用. 天津體育學院學報,2005,20:18-25.
[10]周麗麗,王啟榮,伊木清,等. 耐力訓練及補充中藥多糖對大鼠PBMC分泌細胞因子和血清中細胞因子含量的影響. 中國免疫學雜志,2006,22:1119-1123.
[11] S uzukiK,Nakaji S,Yamada M,et al. Systemic inflammatory response to exhaustive exercise. Cytokine kinetics. Exerc Immunol Rev,2002,8:6-48.
[12] S uzukiK,Nakaji S,Yamada M,et al. Impact of a competitive marathon race on systemic cytokine and neutrophil responses. Med Sci Sports Exerc,2003,35 :348-55.
[13]Suzuki K,Nakaji S,Yamada M,et al. Systemic inflammatory response to exhaustive exercise. Cytokine kinetics. Exerc Immunol Rev,2002,8:6-48.
[14]Baum M,K l?pping-Menke K,Müller-Steinhardt M,et al. Increased concentrations of interleukin 1-beta in whole blood cultures supernatants after 12 weeks of moderate endurance exercise. Eur J Appl Physiol Occup Physiol,1999,79(6):500-3.
[15]岳學狀,張蘊琨,王雪梅. 運動與促炎性細胞因子.南京體育學院學報(自然科學版),2002,1(2):5-13.
[16]陳佩杰 . 運動免疫學研究進展 . 體育科學,2000,20(6):41-46.
[17]張國榮,張月華,吳希如. 白細胞介素-1在中樞神經系統中的作用. 神經科學,1997,4(1):44-48.
[18]Friedman WJ. Cytokines regulate expression of the type I interleukin-1receptor in rat hippocampal neurons and glia.Exp Neurol,2001,168(1):23-31.
[19]Sairanen TR,Lindsberg PJ,Brenner M,et al. Global forebrain ischemia results in differential cellular expression of interleukin-1beta and its receptor at mRNA and protein level. J Cereb Blood Flow Metab,1997,17(10):1107-1120.
[20]劉國法,呂證寶,安林. 大鼠腦內白細胞介素1I型受體mRNA的分布. 解剖學雜志,1999,22(1):27-30.
[21]Habib KE,Gold PW,Chrousos GP. Neuroendocrinology of stress. Endocrinol Metab Clin North Am,2001,30(3):695-728.
[22]Silverman MN,Pearce BD,Biron CA,et al. Immune modulation of the hypothalamic-pituitary-adrenal(hpa)axis during viral infection. Viral Immunol,2005,18 :41-78.
[23] W ieczorekM,Dunn AJ. Relationships among the behavioral,noradrenergic,and pituitary-adrenal responses to interleukin-1 and the effects of indomethacin. Brain Behav Immun,2006,20(5):477-487.
[24]Besedovsky HO and Rey AD. Immune-neuro-endocrine interactions:facts and hypotheses. Endocrine Reviews,1996,17(1):64-102.

