VEGF重組質粒轉染骨髓間充質干細胞及表達的檢測
崔可賾,張明磊
(1.海口市人民醫院 骨科,海南 海口 570208;2.吉林大學中日聯誼醫院 骨科,吉林 長春 130021)
當細胞植入體內后,必須盡快發生血管化,建立血液循環,通過血液-細胞間液使細胞獲得營養及氧氣,維持其活力,進而發揮成骨作用,修復骨缺損。充分的血液供應是保證細胞在體內存活的決定性因素。在應用大塊組織工程骨修復骨缺損時,其核心部位往往發生缺血性壞死,其原因是不能實現早期的血管化,導致支架中心的細胞因無法進行正常的新陳代謝而大量死亡[1]。有研究表明,植入體內后,遠離毛細血管200 μ m以上的細胞將因為得不到營養和氧氣而死亡,限制了在臨床上的應用[2]。血管化已經成為骨組織工程的關鍵技術,能夠將氧氣及營養物質攜帶到局部微環境中,帶走新陳代謝產生的廢物及壞死分解產物,以維持一個動態的局部微環境。
1 材料和方法
1.1 材料pEGFP-N1/VEGF真核表達質粒,LIPofectamineTM脂質體轉染試劑盒(Gibco公司),DMEM培養基(美國Gibco公司),胎牛血清(美國Hyclone公司),SP免疫組化試劑盒、DAB,兔抗人VEGF抗體(Santa Cruz)。
1.2 方法
1.2.1 細胞的轉染 轉染前一天,采用胰酶消化法將處于對數生長期的細胞制備成單個細胞液,計數后調整細胞濃度為2×105細胞/ml,接種于6孔板,每孔2 ml。次日細胞融合鋪滿板底80%左右時進行轉染。轉染采用LIPofect-amineTM試劑盒進行。
1.2.2 轉染后的觀察及計算轉染率 細胞轉染48小時,光鏡和熒光顯微鏡下觀察細胞轉染后熒光表達情況。
轉染效率計算:10個視野轉染陽性細胞數之和/細胞總數之和=該孔細胞轉染效率。
1.2.3 ELISA方法檢測BMP-2的表達 分別于1 d、4 d、7 d、10 d 、15 d、21 d 采用 ELISA 方法檢測轉染了各組質粒的BMSCs培養液中VEGF蛋白的表達。
1.2.4 免疫組織化學染色 細胞以1×105/mL、2 mL/孔,接種于鋪有經多聚賴氨酸處理過的蓋玻片的24孔培養板中,培養24 h。PBS輕洗3次,4%的多聚甲醛4℃固定,血清封閉,室溫孵育10 min。傾去血清,滴加抗體,滴加 50 μ l生物素標記的1∶100稀釋的二抗,37℃孵育30 min,PBS沖洗,滴加50 μ l新配置的DAB顯色劑溶液,顯色后,自來水沖洗,蘇木素復染。梯度乙醇脫水,二甲苯透明,中性樹膠封片。
2 結果
2.1 熒光顯微鏡下觀察
熒光顯微鏡下觀察,pEGFP-Nl/VEGF轉染組發出綠色熒光。通過計算,轉染率為40.1%,見圖1。
2.2 ELISA方法檢測VEGF
結果顯示正常BMSCs及VEGF轉染組均有目的蛋白的分泌,對兩組組間進行統計學分析,BMP-2轉染組與正常細胞有顯著性差別(P<0.05)。
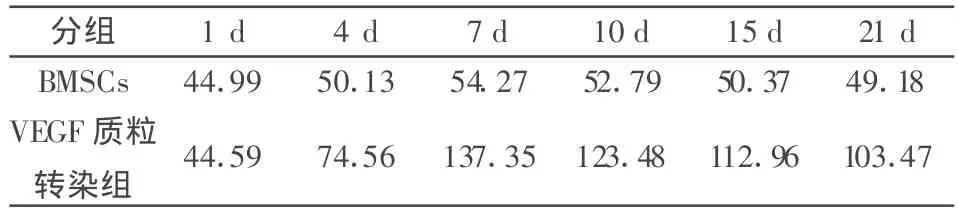
表1 各組平均VEGF(pg/ml)
2.3 免疫組化染色
顯微鏡下觀察,轉染組細胞中均可見深棕黃色染色。提示BMP-2基因轉染后在細胞中表達目的基因,并促進成骨方向轉化,見圖2。
2.4 RT-PCR結果
利用RT-PCR檢測細胞的mRNA表達,在相應分子量處出現條帶,說明目的基因在細胞中高表達。見圖3。
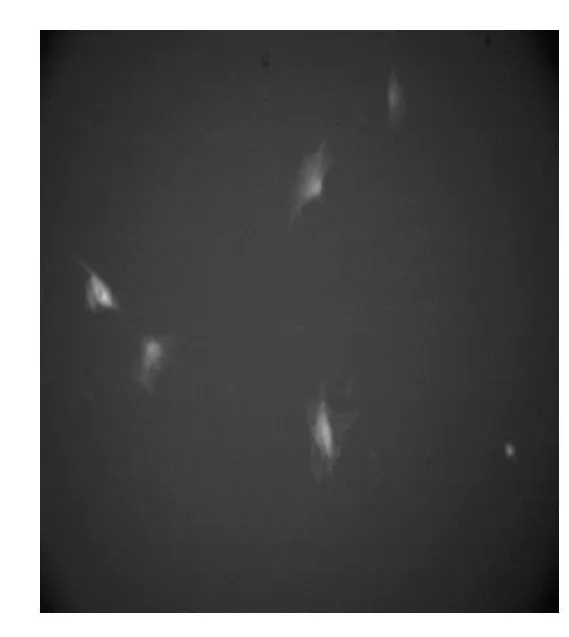
圖1 質粒轉染后的熒光照片×200

圖2 VEGF免疫組化染色×200
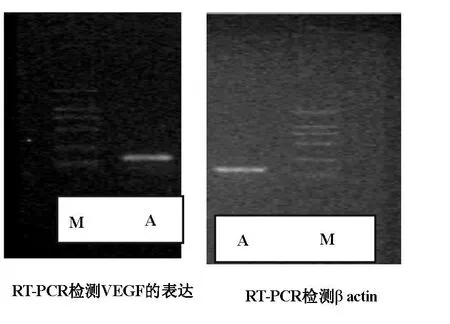
圖3 RT-PCR結果
3 討論
血管再生的形態發生過程有幾個基本步驟[3]:(1)血管的舒張,相鄰細胞間的接觸減少,生長因子的作用下EC被激活;(2)EC增殖;(3)大量蛋白溶解酶分泌激活,降解血管基底膜,形成新血管的芽突;(4)形成細胞外基質,血漿和血漿蛋白從血管中外滲,其中含有的纖維素和纖維粘連蛋白形成膠樣物質,沉積在細胞外間質內,對血管內皮細胞起到支架作用;(5)EC形成血管樣結構(6)血管的成熟和改建,新生血管在蛋白酶的作用下,管壁逐漸增厚,彈性增加;(7)平滑肌細胞、成纖維細胞等參與使血管定型。血管內皮細胞在血管再生的過程中起到重要的作用,因此,血管化的關鍵環節是內皮細胞的增殖、分化、遷移和聚集。
VEGF是一種糖蛋白,具有特異性促血管內皮細胞生長和血管生成誘導作用的因子[4],在骨愈合過程中具有重要作用,其與血管內皮細胞表面的特異性受體結合,一方面可以促進內皮細胞增殖、遷移;另一方面增加局部毛細血管通透性,使纖維蛋白原滲出,于周邊形成凝膠樣基質,可支持并誘導毛細血管長入[5]。
VEGF作為旁分泌因子參與骨的形成與代謝[6],并在骨折的修復、塑型和改造過程中發揮作用,對骨形成及修復起到正性調節作用[7]。Spector[8]發現VEGF能引發成骨細胞的遷移及分化,且引起成骨細胞遷移及分化所需的濃度比BMP-2還低100倍。VEGF對原始成骨細胞有趨化遷移作用,對骨的形成和重建有功能性的作用[9]。
[1]Griffith LG,Naughton G.Tissue engineering-current challenges and expanding opportunities[J].Science,2002,295(5557):1009.
[2]Niklason LE,Langer RS.Advances in tissue engineering of blood vessels and other tissues[J].Transpl Immunol,1997,5(4):303.
[3]Canneliet P.Mechanisms of angiogenesis and arteriogenesis[J].Nat Med,2000,6(4):389.
[5]Frelin C,Ladoux A,Dangelo G.Vascularendothelial growth factors and angiogenesis[J].Ann Endocrinol Paris,2000,61(1):70.
[6]Wang DS,Miura M,Demura H,et al.Anabolic effects of 1,25-dihydroxyvitamin D3 on os teoblas ts are enhanced by vascular endothelial growth factor produced by os teoblas ts and by growth factors produced by endothelial cells[J].Endocrinology,1997,138(7):2953.
[7]Ferrara N,Davis-Smyth T.The biology of vascularendothelial growth factor[J].Endocr Rev,1997,18(1):4.
[8]Spector JA,Mehrara BJ,Greenwald JA,et al.Os2teoblast expression of vascular endothelial growth factor is modulated by the extracell-ular microenvironment[J].Am J Physiol Cell Physiol,2001,280(1):C72.
[9]Mayr-Wohlfart U,Waltenberger J,Hausser H,et al.Vascular endothelial growth factor stimulates chemotactic migration of primary human osteoblasts[J].Bone,2002,30(3):472.

