彌漫性腦創傷后Bcl-2家族與線粒體途徑細胞凋亡的相關性分析
王金林,尹立國,李 軍
(1.唐山市工人醫院,河北唐山 063000;2.遵化市人民醫院;3.玉田縣第二醫院)
隨著凋亡機制的深入研究,線粒體在細胞凋亡過程中的中心地位逐漸得到確認,線粒體通透性轉換孔(mitochondrial permeability transition pore,MPTP)由于其在線粒體和細胞存活和死亡中的重要作用而備受廣大學者關注。近年來的研究顯示,bcl-2家族與線粒體膜通透性轉換孔關系密切。Bcl-2和Bax是Bcl-2家族中最主要的兩個成員,分別具有抑制和促進細胞凋亡的作用,本研究以Marmarou方法建立大鼠彌漫性腦創傷模型,試圖通過相關性分析進一步說明其在線粒體途徑細胞凋亡中的作用。
1 材料與方法
1.1 腦創傷模型的制備與分組雄性成年SD大鼠90只,體重300-350 g,隨機分為實驗對照組、顱腦創傷組 。每組設傷后 1 h 、3 h、6 h、24 h 、48 h、72 h 6個時相點。對照組每個時相點3只大鼠,創傷組每時相點6只大鼠。各組未達到規定時相點死亡的大鼠從實驗中剔除。動物置乙醚麻醉缸中,以乙醚吸入方式深度麻醉動物,麻醉后的大鼠俯臥于落體致傷海綿墊上,70%酒精消毒顱頂部皮膚,沿正中線矢狀切開頭皮,剝離骨膜,顯露人字縫與冠狀縫,將一不銹鋼墊固定在大鼠冠狀縫與人字縫之間將大鼠頭部固定于打擊模型架下的頭部固定裝置中,使重450 g,直徑18 mm的銅柱沿垂直玻璃管于1.2 m高度自由落下,撞擊大鼠顱骨頂部的鋼墊,造成大鼠中度彌漫性顱腦損傷。撞擊后即刻移開大鼠,以免銅柱反彈造成頭部二次打擊傷,給予顱腦損傷后大鼠,頭皮切口常規消毒、縫合。對照組僅給予相同的麻醉處理及沿中線矢狀切開頭皮、剝離骨膜、在冠狀縫與人字縫之間粘鋼墊,置致傷海綿墊上,但不行自由落體致傷,而后常規消毒、縫合切口.各組未到規定時相死亡的大鼠予以剔除。
1.2 細胞色素c、Bax和Bcl-2檢測標本甲醛固定,石蠟切片,按武漢博士德提供檢測試劑盒說明書方法進行檢測。
1.3 原位細胞凋亡檢測(TUNEL法)按Roche公司提供TUNEL檢測試劑盒進行操作。
1.4 陽性細胞免疫反應強弱采用Motic Med 6.0計算機真彩色圖象分析系統以平均光密度進行半定量分析;實驗數據用SPSS11.5 for windows軟件進行統計學處理。
2 結果
2.1 傷后1 h至24 hCytc表達與TUNEL陽性細胞數密切相關(r=0.958,P<0.05)(圖1)。
2.2 傷后1 h至24 h Bax和Bcl-2二者的比例與Cytc免疫反應相關(r=0.996,P<0.01)(圖2)。
2.3 傷后1 h至72 h Bax和Bcl-2二者的比例與TUNEL陽性細胞數密切相關(r=0.925,P<0.01)(圖3)。
2.4 但Cytc表達峰值(24 h)早于Bax和Bcl-2二者的比例高峰值(48 h)(表1)。
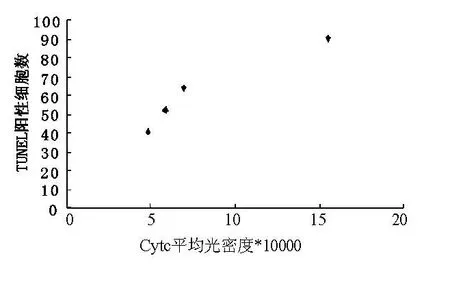
圖1 Cytc表達與TUNEL陽性細胞數的相關性
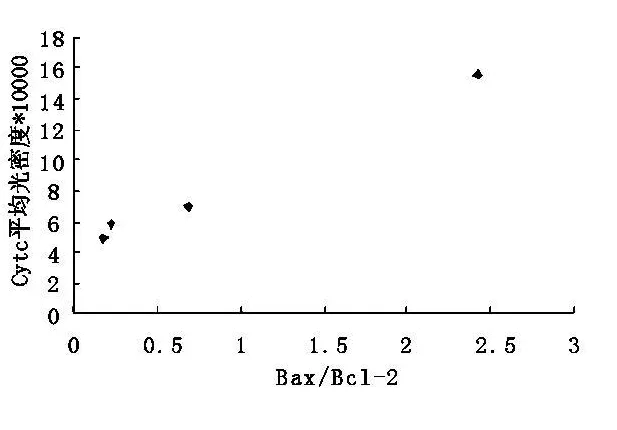
圖2 Cytc表達與bax/bcl-2的相關性
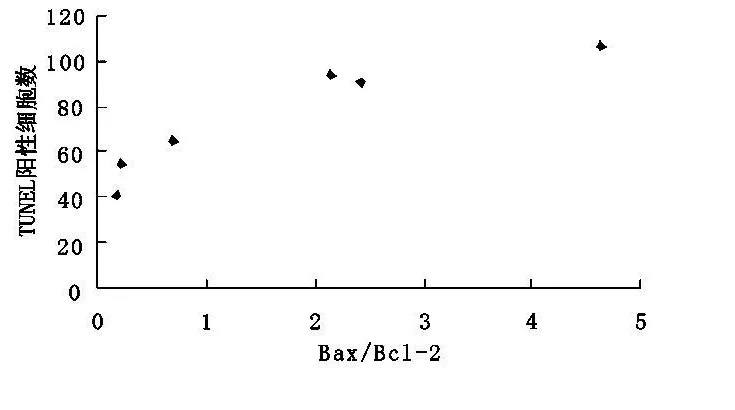
圖3 bax/bcl-2與TUNEL陽性細胞數的相關性

表1 腦創傷后 cyt-c、bax、bcl-2與細胞凋亡數的動態變化
3 討論
Bcl-2屬于一類新的癌基因家族,主要包括抗凋亡蛋白(bcl-2、bcl-xl、bcl-wl等)和促凋亡蛋白(bax、bak、bolt等)。近年來研究顯示Bcl-2家族蛋白對PTP的開放和關閉起著關鍵的調節作用,促凋亡蛋白bax等可以通過與ANT或VDAC的結合介導PTP開放,而抗凋亡蛋白bcl-2、bcl-xl等可以通過與bax競爭性的與ANT結合,或直接阻止bax與ANT、VDAC的結合來發揮其抗調亡作用[1,2]。在純化的線粒體中重組Bax、Bak具有開放PT孔的作用。可能是因為其具有與通道蛋白相似的三維空間結構,能形成足夠大的通道來轉運ctyc,平時Bax與Bcl-2或Bcl-xl形成異二聚體,使PT處于關閉狀態。當細胞發生調亡時,與Bcl-2,Bcl-xl相連的Bax含量增加,形成Bax同型二聚體,PT通道開放,使ctyc釋放[3]。目前大量的研究顯示細胞內還存在著以bax為核心的不依賴與PTP復合體的凋亡調控機制。體外實驗中發現bax能在人工構建的脂質體膜上形成通過大分子物質的孔道而不需要PTP復合體的參與,但必須依賴于bid蛋白和心肌磷脂的存在[4],提示bax可能具有不依賴PTP復合體來介導細胞色素c等物質釋放的能力。而在生理狀況下bax以單體的形式于胞漿中,研究表明只有在受到凋亡信號刺激后,bax轉位到線粒體膜并暴露其BH3結構域后,才能介導細胞色素c釋放等下游事件[5]與此同時,相關研究還發現bax單體無法在線粒體膜上形成孔道和釋放細胞色素c,只有在形成低聚物后才能介導細胞色素 c釋放。進一步的研究顯示體外培養的HeLa細胞在外界凋亡誘導因子的作用下細胞內的bax形成了兩種結合于線粒體膜的高分子量低聚復合物,而此低聚復合物中并不含有構成PTP復合體的主要成分VDAC和ANT。還有學者發現,發生膜轉位的bax在線粒體膜上形成了四聚體到十聚體組成的低聚復合物,同樣此低聚復合物中并不含有構成PTP復合體的主要成分VDAC和ANT顯著,而bcl-2則可以顯著抑制此低聚復合物的形成[6]。另有研究顯示bax在凋亡信號介導下發生膜轉位后,形成數千個bax分子簇,bcl-xl超表達沒有阻止bax膜轉位發生,但可以抑制分子簇的形成和凋亡的發生。有此可以看出bax對細胞色素c釋放起關鍵性作用,在凋亡信號刺激下bax從胞漿轉位到線粒體膜上從而啟動了線粒體介導的調亡途徑。同時轉位到線粒體膜上bax和bak低聚化或者分子簇形成很可能決定凋亡是否發生。這其中,bax很可能決定凋亡發生與否的必要因素,而bak則是其調控因素[7]。抗凋亡類bcl-2蛋白可以通過阻止促凋亡蛋白在線粒體膜上形成高分子低聚物或是在線粒體膜附近形成分子簇發揮其抗調亡作用。當然上述研究大部分限于體外實驗,我們Marmarou方法建立彌漫性腦創傷模型對大鼠體內cytc、Bcl-2、Bax蛋白進行動態觀察和相關分析,結果發現傷后1 h至24 h Bax和Bcl-2二者的比例與Cytc免疫反應相關(r=0.996,P<0.01)說明bcl-2家族與cytc釋放關系密切,細胞色素c從線粒體釋放到胞漿后,在dATP/ATP存在下,首先與凋亡激活因子1(apoptosis protease activeing factor,Apaf-1)結合,形成多聚復合體[8,9]。后者充分聚合胞質中的procaspase-9,并導致其自動活化[10]成caspase-9,然后啟動級聯反應,繼續活化下游的Caspase,如Caspase-3和Caspase-7,整個過程為一正反饋,活化的Caspases能對其底物特異性的切割,DNA片段化,細胞發生凋亡,并出現凋亡形態學改變[11,12,13]。凋亡誘導因子(AIF)從線粒體釋放后直接進入胞核內,獨立的將DNA裂解引起染色體和DNA的大規模片斷化,導致核凋亡[14,15]。我們的相關結果也顯示cytc陽性表達與TUNEL陽性細胞數密切相關,Bax和Bcl-2二者的比例與TUNEL陽性細胞數密切相關,結合前人成果可以確認腦創傷cytc釋放、bcl-2家族比例變化引發了細胞凋亡。同時我們也對時相變化進行分析,結果發現但Cytc表達峰值(24 h)早于Bax和Bcl-2二者的比例高峰值(48 h),說明另有其它因素作用于線粒體膜通透性轉換孔引起cytc釋放。
[1]Zomora M,Granell M,Mampel T,et al.Adenine nucleotide translocase 3(ANT3)overexpression inducws apoptosis incultured cells[J].FEBS Lett,2004,563(1-3):155.
[2]Belzacq AS,Helena LAV,Guido K,ed al.The adenine nucleotide translocator in apoptosis[J].Biochimic,2002,84(2-3):167.
[3]Degli Esposti M,Dive C.Mitochondrial Membrane permeabilisation by Bax/Bak[J].Biochemical&Biophysical Communications,2003,304(3):455.
[4]Kuwana T.Mackey MR.Perkins G,et al.Bid,Bax,and lipids cooperate to form supramolecular openings in the outer mitochondrial membrane[J].Cell,2002,111(3):331.
[5]Jia L.Patwari Y.Srinivasula SM,et al.Bax translocation is crucial for the sensitivity of leukaemic cells to etoposide-induced apoptosis[J].Oncogene,2001,20(35):4817.
[6]Mikhailov V,Mikhailov M,Donna J et al.Bcl-2 prevent Bax Oligomerization in the Mitochondrial Outer Membrane[J].J Biol Chem,2001,276(21):18361.
[7]Mikhailov V,Mikhailov M,Degenhardt et al.Association of Bax and Bak Homo-oligomers in Mitochondria[J].J Biol Chem,2003,278(7):5367.
[8]Hu Y,Benedict MA,Ding L,et al.Role of cytochrome c and dATP/ATP hydrolysis in Apaf-1-mediated caspase-9 activation and apoptosis[J].EMBO J,1999,18(13):3586.
[9]Yoshida H.Apaf-1 isrequired for mitichondrial pathways of apoptosis and brain development[J].Cell,2002,94:739.
[10]Hatai T,Matsuzawa A,Inoshita S,etal.Execution of apoptosis signal-regulating kinase-1(ASK1)-induced apoptosis by the mitochondrial-dependent caspase activation[J].J Biol Chem,2000,275(34):26576.
[11]Li Jia,Srinivasa M.Srinivasula,Feng-Ting Liu,et al.Apaf-1 protein deficiency confers resistance to ctyochrome c-dependent apoptosis in human leukemia cells[J].Blood,2001,98:414.
[12]Kawane K,Fukuyama,Yoshida H,et al.Impaired thymic development in mouse embryos deficient in apoptotic DNA degradation[J].Nat Immunol,2003,4(2):138.
[13]Pawlowski J,Kraft AS.Bax-induced apoptotic cell death[J].Proc Natl A-cad Sci USA,2000,97(2):529.
[14]Patterson SD,SD,Spahr CS,Daugas E,et al.Mass spectrometric identification of proteins released frommitochondria undergoing pemeability transition[J].Cell Death Differ,2000,7(2):137.
[15]Susin SA,Daugas E,Ravagnan L,et al.Two distinct pathways leading to nuclear apoptosis[J].J Exp Med,2000,192(4):571.

