母胎界面MCP-1表達異常與不明原因早期復發性流產的關系
張 鈺 李俊霞 顧 艷 李 奕
天津醫科大學第二醫院計劃生育科(300211)
早期復發性流產(ERSA)發病率為3% ~5%。排除臨床上可明確的病因(染色體、解剖、內分泌及感染因素),仍有近1/2的ERSA病因未明,稱不明原因早期復發性流產(UERSA)。隨著生殖免疫學的發展,逐步認識到UERSA是一種同種免疫病,其發病可能是由于母胎界面種植部位局部細胞功能的異常和細胞因子的分泌異常[1],但導致UERSA的具體發病機制尚不完全清楚。單核細胞趨化蛋白 -1(MCP-1)是在體外最早發現的具有趨化活性的細胞因子之一,屬于趨化因子家族。文獻已證實早孕絨毛和蛻膜組織中均有MCP-1的表達,母胎界面產生的MCP-1與蛻膜局部的單核巨噬細胞的募集與激活有關[2,3],但其與UERSA發病的研究尚未見報道。本研究通過篩選UERSA患者,采用實時熒光定量聚合酶鏈反應(RT-PCR)和酶聯免疫吸附測定(ELISA)方法,研究UERSA患者絨毛和蛻膜組織中MCP-1 mRNA的表達異常及血清MCP-1的蛋白含量與UERSA發病的相關性,為臨床建立有效的監測指標和成功的治療方案提供理論依據。
1 對象與方法
1.1 對象
在知情同意下,選擇2008年6月~2009年6月在天津醫科大學第二醫院計劃生育科就診的UERSA患者30例(UERSA組),超聲檢查提示胚胎發育停止或孕卵枯萎,無胎心搏動。UERSA患者應符合以下診斷標準[4]:①與同一性伴侶連續發生至少2次自然流產,流產孕周為7~12周;②夫婦外周血染色體核型均正常;③生殖器官解剖結構未見異常;④內分泌激素(如性激素、血糖、胰島素水平和甲狀腺功能)均正常;⑤血清TORCH-IgM檢測陰性,宮頸分泌物衣原體、解脲支原體檢測均為陰性;⑥自身抗體陰性(外周血抗心磷脂抗體陰性,抗β2-糖蛋白1抗體陰性,狼瘡抗凝物陰性)。同期隨機收集自愿要求終止妊娠的健康早孕婦女30例為對照組,無自然流產、死胎、死產等不良孕產史,孕周7~12周,B超提示胚胎發育正常,本次妊娠期間無陰道流血、腹痛等先兆流產的癥狀和體征,未放置宮內節育器。
1.2 方法
1.2.1 標本采集及處理所有受試對象完善血常規、心電圖、白帶常規等各項檢查,未發現異常后行負壓吸宮手術。手術前采集肘靜脈血5ml,室溫靜置2h后,2 500r/min離心15min,取上清液放入凍存管,置于-80℃冰箱凍存待測。手術后,無菌條件下選取絨毛、蛻膜組織約0.3g,立刻用焦碳酸二乙酯(DEPC)處理過的無菌磷酸鹽緩沖液漂洗,置于凍存管封存,液氮保存。
1.2.2 實時熒光定量RT-PCR技術檢測絨毛、蛻膜組織中MCP-1 mRNA的表達①主要試劑:RNAiso Plus、RT-PCR試劑盒、熒光染料SYBR Green購自大連寶生物工程有限公司。熒光定量PCR儀:LightCycler(Roche公司)。②引物的設計和合成:根據Gen-Bank所發布的基因序列,由天津六合通生物技術有限公司設計和合成。MCP-1上游引物序列:5'-CAATCAATGCCCCAGTCACC-3',下游引物序列:5'-CCTGAACCCACTTCTGCTTG-3'。選擇 β -actin為內參照基因,其上游引物序列:5'-GCAAAGACCTGTACGCCAAC-3',下游引物序列5'-ACATCTGCTGGAAGGTGGAC-3'。③絨毛、蛻膜組織中MCP-1 mRNA的檢測:提取絨毛、蛻膜組織總RNA,按RTPCR試劑盒說明進行逆轉錄,獲得cDNA。實時熒光定量RT-PCR總反應體系為:cDNA模板1μl,上、下游引物各 0.3μl,SYBY Green 染料 10μl,用雙蒸水補足至20μl。反應條件為:95℃預變性10s,95℃變性5s、60℃退火20s、72℃延伸10s,共40 個循環,并且做熔解曲線和擴增曲線分析。④數據分析:根據Livak和Schmittgen[5]設計的比較閾值法來測定目的基因的相對表達,目的基因的相對表達量=2-△△Ct。
1.2.3 血清MCP-1蛋白含量測定Human MCP-1 ELISA測定試劑盒由美國R&D公司提供,嚴格按說明書操作。用Model 680酶標儀(Sanyo,Japan)在450nm波長依序測量各孔的OD值,制作標準曲線并計算出相應的MCP-1濃度。
1.2.4 統計學分析所得數據以±s的形式表示,應用統計軟件SPSS 11.0分析處理,計量資料分析采用Student-t檢驗。
2 結果
2.1 兩組婦女臨床相關指標比較
UERSA組和正常早孕組的年齡、孕次、停經天數均無統計學差異(P>0.05),具有可比性。UERSA組因為胚胎停育,胎囊小于正常早孕組(<0.05)。見表1。
2.2 早孕絨毛、蛻膜組織MCP-1mRNA的表達
本實驗采用實時熒光定量RT-PCR技術,MCP-1基因的熔解曲線和擴增曲線見圖1、2。熔解曲線提示本實驗目的基因擴增的特異性較高,擴增曲線提示本實驗擴增質量良好。實驗結果表明正常早孕婦女和UERSA患者絨毛、蛻膜組織均可見MCP-1mRNA的表達,絨毛、蛻膜組織MCP-1與內參基因β-actin濃度比值分別為1.68 ±0.42,2.30 ±0.86,差異有統計學意義(P<0.01)。
2.3 兩組絨毛、蛻膜組織中MCP-1 mRNA的表達量和血清中MCP-1蛋白含量的比較
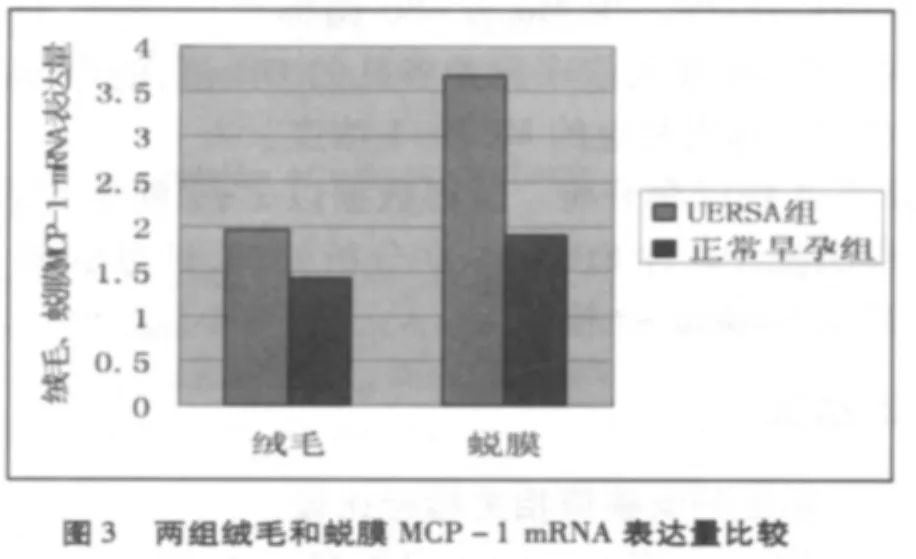
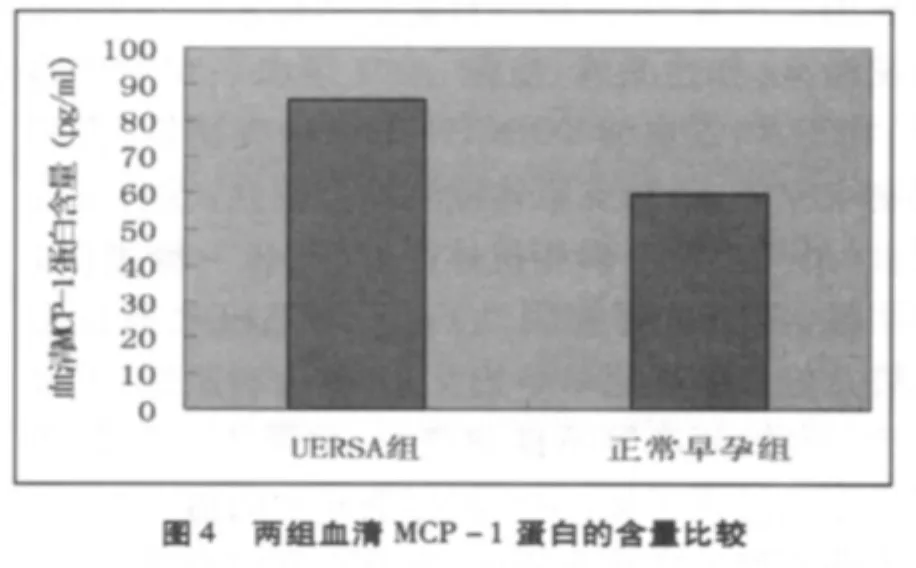
UERSA組絨毛和蛻膜組織中MCP-1 mRNA的表達量均顯著高于正常早孕組(P<0.01);UERSA組血清中MCP-1蛋白的含量顯著高于正常早孕組(P <0.01)。見圖3、4。
表1 兩組研究對象一般情況比較(±s)
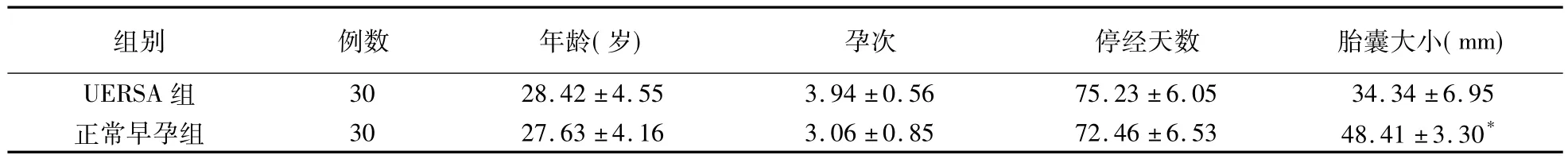
表1 兩組研究對象一般情況比較(±s)
*與UERSA組比較P<0.05
組別 例數 年齡(歲) 孕次 停經天數 胎囊大小(mm)UERSA 組 30 28.42 ±4.55 3.94 ±0.56 75.23 ±6.05 34.34 ±6.95正常早孕組 30 27.63 ±4.16 3.06 ±0.85 72.46 ±6.53 48.41 ±3.30*
2.4 血清MCP-1蛋白含量與絨毛、蛻膜組織中MCP-1mRNA表達量的相關性
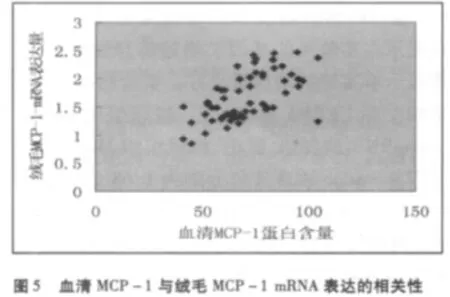
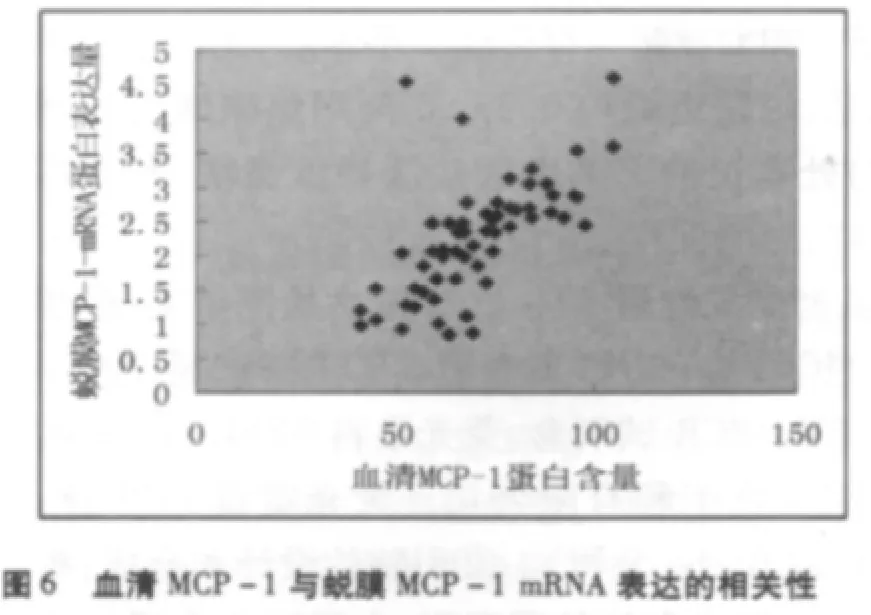
UERSA組和對照組血清中MCP-1蛋白含量與絨毛組織中MCP-1 mRNA的表達量之間呈正相關(r=0.595,P <0.05),與蛻膜組織中 MCP-1mRNA的表達量之間也呈正相關(r=0.655,P<0.05),見圖 5、6。
3 討論
3.1 母胎界面MCP-1的表達與正常早期妊娠的維持
從免疫學角度而言,自然妊娠是一種特殊類型的“半同種異體移植”。胚胎種植的免疫過程受胚胎和母體兩方面的共同調節,發生在母胎界面的免疫反應使胚胎能夠成功侵入子宮內膜并使子宮內膜的血管發生重鑄,從而使胚胎能夠從母體得到良好的血液供養而發育成熟[6]。母胎界面的胎兒面主要由絨毛滋養細胞組成,母體-蛻膜面富集著母方來源的免疫活性細胞,由子宮自然殺傷細胞(uNK細胞)、巨噬細胞和T淋巴細胞組成。已有研究表明,母胎界面局部免疫活性細胞并非源于前體細胞在子宮內膜的自我更新,而是從外周血中被募集遷移而來的。趨化因子MCP-1在單核-巨噬細胞的遷移、募集和歸巢中發揮決定性作用,參與胚胎種植階段母胎界面的免疫反應[7,8]。本研究結果顯示,在早孕絨毛和蛻膜組織中共表達MCP-1 mRNA,且在蛻膜的表達高于絨毛,提示MCP-1可能參與復雜的母胎界面的整合性調控,在蛻膜巨噬細胞的招募和遷移中發揮重要作用。推測胎盤絨毛和蛻膜組織可能通過自分泌和旁分泌MCP-1調節滋養細胞和蛻膜免疫活性細胞的功能,從而調節母胎免疫耐受,最終成功妊娠。
3.2 絨毛、蛻膜組織中MCP-1mRNA的表達與UERSA
目前認為巨噬細胞活性和功能的異常是導致母胎免疫耐受失衡、發生 UERSA 的重要原因[9,10],病理機制可能是:①巨噬細胞被激活后,可造成腫瘤壞死因子(TNF)-α、白介素(IL)-1等炎癥細胞因子水平升高,高濃度的炎癥細胞因子可以通過多種途徑導致流產[11];②巨噬細胞激活后不能及時清除凋亡的滋養細胞,凋亡的滋養細胞蓄積,可引發針對胎兒抗原的免疫攻擊;③巨噬細胞激活后可激發Thl型免疫反應,促使母體排斥胚胎組織[12],最終導致自然流產的發生。體外試驗研究發現滋養細胞與蛻膜接觸時會誘導巨噬細胞大量分泌MCP-1,從而吸引外周血中的單核細胞和蛻膜組織中的巨噬細胞不斷聚集在種植部位并激活,激活的巨噬細胞在滋養細胞的誘導下分泌誘導局部免疫抑制反應以及營養胚胎的細胞因子。如果提升蛻膜組織中MCP-1的濃度,會使巨噬細胞的招募變得不可抑制,而升高內膜中炎癥細胞因子TNF-α、IL-1等的濃度,均可誘導MCP-1的表達,這將構成一個正反饋放大環路[13,14]。米亞英等[15]研究發現:自然流產小鼠模型蛻膜組織中MCP-1、TNF - α 的表達顯著升高,Chaiworapongsa等[16]發現,羊水中MCP-1水平升高是自然流產的一個危險因素,這些研究均提示MCP-1的表達與自然流產的發生及發展密切相關。本研究發現UERSA組絨毛、蛻膜組織中MCP-1 mRNA表達量顯著高于正常妊娠組,提示母胎界面MCP-1表達上調可能與UERSA的發病有關,MCP-1參與了自然流產過程。推測MCP-1可能是巨噬細胞參與母胎界面免疫反應的始動因素,母胎界面MCP-1表達上調,直接導致了巨噬細胞的數量和免疫活性異常,數量增多、功能增強的巨噬細胞再分泌大量的MCP-1,誘導更多巨噬細胞聚集,由此產生級聯放大作用,發揮免疫效應,可能是最終導致胚胎死亡的重要機制。
3.3 血清MCP-1蛋白含量和絨毛、蛻膜組織中MCP-1-mRNA表達的相關性及意義
胚胎發育停止在臨床上屬于稽留流產的范疇,如不及時診斷、治療,胚胎可發生機化,與子宮壁粘連,在清宮術中易導致子宮穿孔、吸宮不全、子宮出血、感染等嚴重的并發癥,增加清宮手術的難度。目前對妊娠早期胚胎發育的監測主要通過超聲檢查和血清人絨毛膜促性腺激素(hCG)的測定來完成,B超下孕卵形態或位置的改變,胎心的消失,血hCG的明顯降低都能較準確地指示流產的發生。然而B超和血hCG測定預測胚胎發育不良仍有一些不足之處,當患者停經天數較少、月經不規律、B超未見胚胎心管搏動時,僅憑B超檢查無法確定胚胎發育情況,往往需連續觀察數周。而血清hCG半衰期長,濃度變異范圍較大,正常早期妊娠與稽留流產之間交叉部分較大,且單次測定可能存在誤差,因此僅憑測定hCG也不足以診斷。故能否找到一些更有價值的指標來監測胚胎停育,為胚胎發育不良的早期發現、診斷和治療提供幫助,成為眾多學者廣泛研究的問題。目前已有報道,某些細胞因子對自然流產、早產等不良妊娠結局有一定的預測作用[17,18],但國內外關于此方面的研究頗少。如前所述,母胎界面MCP-1是絨毛和蛻膜組織共同分泌的,是妊娠早期成功種植胚胎和胎盤形成過程中重要的決定因素,與自然流產的發生密切相關。但直接進行絨毛和蛻膜活檢檢測MCP-1表達是侵入性方法,可能引起流產和胚胎損傷。本研究發現,UERSA組血清中MCP-1蛋白的含量高于正常早孕組,且血清中MCP-1含量與母胎界面MCP-1 mRNA表達水平有良好的相關性,提示可以通過檢測孕母血清MCP-1的水平來反應母胎界面MCP-1 mRNA的表達水平。通過監測孕母血清MCP-1的水平評價胚胎發育情況,作為鑒別正常早期宮內妊娠和胚胎發育不良的診斷依據,對于早期診斷胚胎停育具有重要意義。
總之,通過上述研究提示母胎界面絨毛、蛻膜組織MCP-1高表達,可能導致蛻膜巨噬細胞數量和活性改變而直接影響母胎間的免疫平衡,最終導致UERSA的發生。這一結果將有利于深入探討改變母胎界面MCP-1表達在UERSA治療中的可行性。
1 林其德,汪希鵬.原因不明復發性流產的病因病理生理機制與治療臨床進展[J].中國實用婦科與產科雜志,2007,23(1):5-8.
2 Meter RA,Wira CR,Fahey JV,et al.Secretion of monocyte chemotactic protein-1 by human uterine epithelium directs monocyte migration in culture[J].Fertil Steril,2005,84(1):191 - 201.
3 馬方,杜美蓉,李大金.早孕期人絨毛趨化因子CCL2及其受體CCR2的表達[J].生殖與避孕,2009,29(11):755-758.
4 林其德.復發性流產免疫學診斷和治療共識[J].生殖醫學雜志,2008,17(1):4 -5.
5 Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))Method[J].Methods,2001,25(4):402 -408.
6 王瓊,周燦權.胚胎種植與免疫[J].中國實用婦科與產科,2007,23(12):898-900.
7 Bonecchi R,Galliera E,Borroni EM,et al.Chemokines and chemokine receptors:an overview[J].Front Biosci,2009,14:540 -551.
8 Red-Horse K,Drake PM,Fisher SJ.Human pregnancy:the role of chemokine networks at the fetal- maternal interface[J].Expert Rev Mol Med,2004,6(11):1 -14.
9 Renaud SJ,Graham CH.The role of macrophages in utero-placental interactions during normal and pathological pregnancy[J].Immunol Invest,2008,37(5):535 -564.
10 金妍,林其德,汪希鵬,等.原因不明復發性流產患者巨噬細胞表面TSP1、CD36、CD47的表達及其細胞因子的分泌.現代婦產科進展,2006,15(2):926 -929.
11 Yu XW,Yan CF,Jin H,et al.Tumor ncrosis factor receptor 1 expression and early spontaneous abortion[J].Int J Gynecol Obstet,2005,88(1):44 -48.
12 Mor G,Abrahams VM.Potential role of macrophages as immunnoregulators of pregnancy[J].Reprod Biol Endocrinol,2003,1:119.
13 Fest S,Aldo PB,Abrahams VM,et al.Trophoblast-macrophage interactions:a regulatory network for the protection of pregnancy[J].Am J Reprod Immunol,2007,57(1):55 -66.
14 Lockwood CJ,Matta P,Krikun G,et al.Regulation of monocyte chemoattractant protein-1 expression by tumor necrosis factor-alpha and interleukin-1 beta in first trimester human decidual cells:implicationsfor preeclampsia[J].Am J Pathol,2006,168(2):445 -452.
15 米亞英,楊俊英.自然流產小鼠蛻膜組織腫瘤壞死因子-α和單核細胞趨化蛋白-1的表達[J].中國計劃生育學雜志,2007,15(7):411-413.
16 Chaiworapongsa T,Romew R,Tolosa JE,et a1.Elevated monocyte chemotactic protein-1 in amniotic fluid is a risk factor for pregnancy loss[J].J Matern Fetal Neonatal Med,2002,12(3):159 -164.
17 Whitcomb BW,Schisterman EF,Klebanoff MA,et al.Circulating Chemokine Levels and Miscarriage[J].Am J Epidemiol,2007,166(3):323-331.
18 van Mourik MS,Macklon NS,Heijnen CJ.Embryonic implantation:cytokines,adhesion molecules,and immune cells in establishing an implantation environment[J].J Leukoc Biol,2009,85(1):4 -19.

