自體DC疫苗對惡性黑色素瘤術后患者免疫功能的影響
姚宇鋒, 賴婭娜, 陳環球
惡性黑色素瘤(Maligant Melanoma,MM)是指來源于神經嵴的黑色素細胞在免疫缺陷、遺傳因素及多種理化因素等影響下惡變而形成的一種惡性腫瘤。是一種高度惡性腫瘤,對放化療不敏感,手術治療是其主要治療手段。近年來用樹突狀細胞(Dendritic cell,DC)疫苗治療晚期惡性黑色素瘤的研究甚多[1-2],但是國內外尚缺少DC疫苗治療無遠處轉移的可根治手術MM的資料。為此,我們對2008年1月至2009年12月我科收治的12例肢體MM患者根治術后進行負載腫瘤細胞抗原的DC疫苗治療,并與同期30例未接受DC疫苗治療的肢體MM患者進行比較分析。
1 資料與方法
1.1 一般資料
本研究共納入42例進展期(Ⅱ、Ⅲ期)肢體MM患者,男22例,女20例,年齡33~67歲,中位年齡56.8歲。42例患者均行根治性手術治療并經病理學證實為MM,影像學檢查排除遠處轉移,KPS≥60分;血常規、肝腎功能、心肺功能基本正常。其中12例簽署知情同意書接受常規免疫治療聯合DC疫苗治療,其余30例患者僅接受常規免疫治療。
1.2 方法
1.2.1 熱休克凋亡MM細胞抗原負載的DC疫苗的制備和回輸 按參考文獻[3]方法進行DC疫苗的制備。按參考文獻[4]方法進行DC疫苗的回輸,每周注射1次,劑量為4×106細胞/次,共注射4次,部分患者注射5~8次。注射前按2005版《中華人民共和國藥典》第三部規定的方法進行無菌和內毒素檢測合格。
1.2.2 治療方法 常規組術后只接受IL-2/IFNα-2b治療方案。IL-2 200萬U肌肉注射,qod;IFNα-2b 300萬U肌肉注射,qod;1個月為1個療程。IL-2及IFNα-2b間隔應用。治療組在行上述方案治療的進行DC疫苗注射,方法和劑量同前。
1.2.3 免疫學指標觀察 分別在DC疫苗治療前和結束1周后用流式細胞儀檢測外周血 CD3+、CD4+、CD8+等T淋巴細胞亞群、自然殺傷(nature kill,NK)細胞的比率及 IFN-γ+CD8+T細胞數量[5],ELISA試劑盒(晶美生物工程有限公司)檢測血清 IL-2、IL-10、IL-12、TNF-α 和 IFN-γ 的水平。DTH試驗:DC免疫治療結束1周時進行DTH(delayed type hypersensitivity)試驗,用l mL青霉素試驗注射器吸取0.2 mL制備好的DC懸液,于一側上肢前臂內側行皮內注射,同時在對側前臂內側皮內注射0.2 mL生理鹽水作為對照。注射后48~72 h內通知患者觀察注射部位有無紅腫及硬,直徑大于5mm者判斷為DTH試驗陽性。
1.2.4 安全性評價 在DC輸注后30min及24 h觀察局部及全身急性毒性反應并作及時處理,直至毒性反應消失或接受其他治療。整個治療過程中參照國家規定的《抗腫瘤藥物急性與亞急性毒性反應分度級標準》觀察患者是否出現不良反應并且動態監測患者血液細胞學和肝腎功能變化。
1.3 統計學分析
2 結果
2.1 免疫指標變化
聯合DC治療組在DC免疫治療后外周血CD3+、CD3+CD4+、CD4+/CD8+及 NK 細胞比率較治療前明顯升高(P<0.05),且明顯高于常規治療組(P<0.05)(表1);同時DC治療后患者血清IL-2、IL-12、IFN-γ、TNF-α 水平均較治療前及常規治療組顯著上升(P<0.05)(表2)。另外對常規免疫治療聯合DC組12例患者進行了IFN-γ+CD8+細胞檢測和DTH試驗,7例患者治療后IFN-γ+CD8+T細胞數量升高2倍以上,其中5例治療后DTH試驗呈陽性反應。
2.2 不良反應
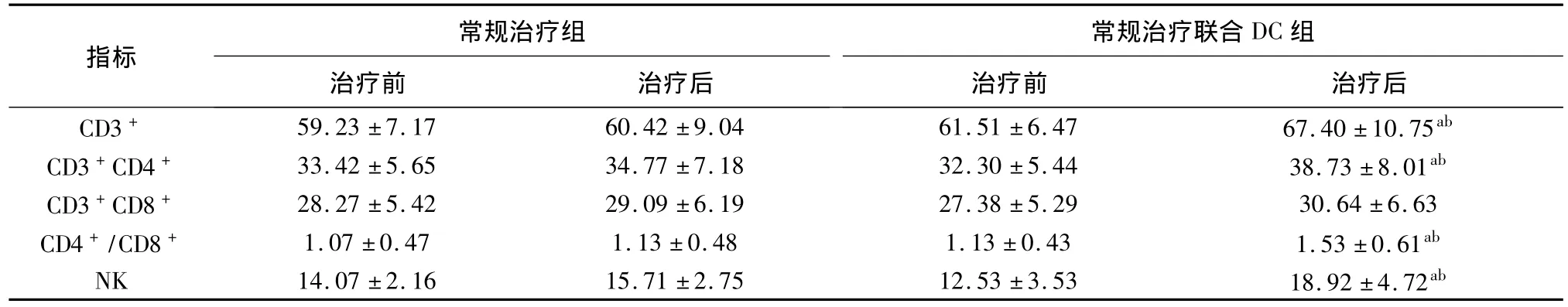
表1 兩組治療前后T淋巴細胞亞群及NK細胞比率的變化(x ± s,%)
表2 兩組治療前后細胞因子的變化(±s,pg/mL)
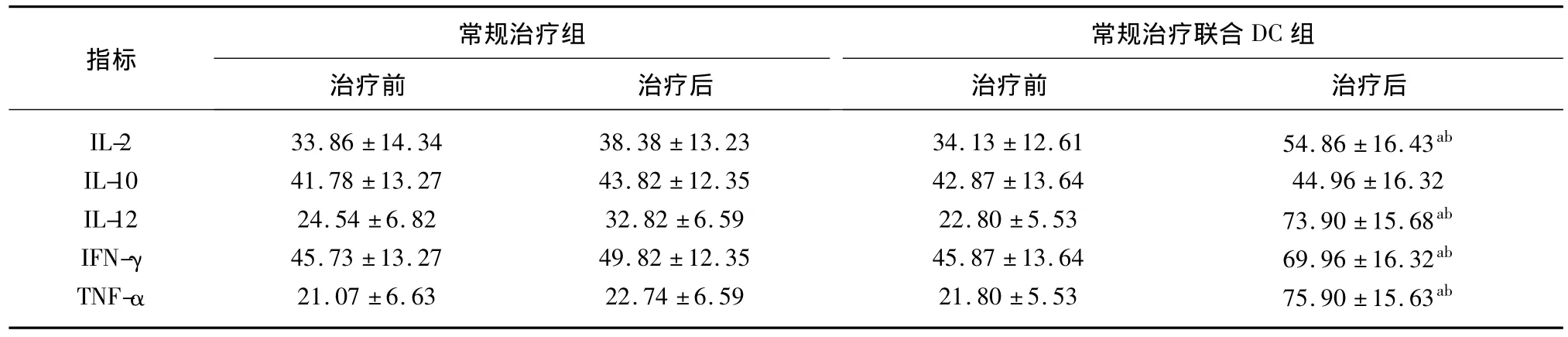
表2 兩組治療前后細胞因子的變化(±s,pg/mL)
a:與DC治療前比較,P<0.05;b:與常規組治療后比較,P<0.05
常規治療組常規治療聯合DC組指標治療前 治療后IL-2 33.86 ±14.34 38.38 ±13.23 34.13 ±12.61 54.86 ±16.43ab IL-10 41.78 ±13.27 43.82 ±12.35 42.87 ±13.64 44.96 ±16.32 IL-12 24.54 ±6.82 32.82 ±6.59 22.80 ±5.53 73.90 ±15.68ab IFN-γ 45.73 ±13.27 49.82 ±12.35 45.87 ±13.64 69.96 ±16.32ab TNF-α 21.07 ±6.63 22.74 ±6.59 21.80 ±5.53 75.90 ±15.63治療前 治療后ab
常規治療聯合DC組的12例患者,皮下注射后30 min內均未出現惡心、嘔吐、頭痛、寒戰、高熱等不良反應,3例患者在整個疫苗治療過程中出現低熱反應,未予特殊處理后恢復,4例患者出現注射局部紅腫、硬結,給予對癥處理后,紅腫消失、局部硬結未出現擴大現象。所有患者均未出現嚴重的血液細胞學、肝腎功能的變化。上述結果顯示DC疫苗注射是安全的,無明顯毒副作用。
3 討論
目前手術治療仍是治療MM最行之有效的方法。由于MM對放療、化療不敏感,病死率仍很高。近年來,生物治療在惡性腫瘤治療中的應用技術日趨成熟,如白介素-2(IL-2),干擾素(IFN)等。而DC免疫治療在惡性黑色素瘤治療中的應用也越來越受到人們的重視。影響DC免疫治療的因素很多,其中與MM臨床預后有關的一個重要因素就是DC負載的腫瘤抗原[6]。DC疫苗的抗原負載體系有多種不同形式,如單個腫瘤抗原肽、混合腫瘤抗原多肽、腫瘤細胞裂解液、腫瘤細胞核酸等。與上述抗原制備方式不同的是,本研究采用熱休克方式誘導腫瘤細胞凋亡,制備自體腫瘤抗原。由于熱休克可以誘導腫瘤細胞高表達熱休克蛋白(heat shock protein,HSP),DC表面表達多種HSP受體(如CD91,CD40,TLR2/4或LOX1),通過受體介導的內吞機制將使DC高效地攝取 HSPs-多肽復合物抗原,用富含HSPs的腫瘤細胞進行抗原負載可提升DC疫苗的效率[7]。本研究采用熱休克凋亡的自體腫瘤細胞制備抗原,在避免腫瘤抗原缺失造成免疫逃避的同時提高DC疫苗的免疫原性,研究其治療MM的臨床應用價值。
外周血 中 CD3+、CD3+CD4+、CD3+CD8+、CD4+/CD8+比例、NK細胞比率的變化是反映人體特異性和非特異性免疫功能的重要指標,其中CD3+、CD3+CD4+、CD3+CD8+、CD4+/CD8+比例反映機體特異性免疫功能,NK細胞反映機體非特異性細胞免疫功能。本研究發現,12例患者在經過DC 疫苗治療后 CD3+、CD3+CD4+、CD4+/CD8+及NK細胞比率明顯升高,說明DC疫苗治療能夠提高MM患者的特異性和非特異性免疫功能,對于增強患者術后的抗腫瘤功能具有重要意義。
IL-2、IL-12、IFN-γ 和 TNF-α 在機體抗腫瘤免疫中發揮重要作用,如 IL-2、IL-12刺激 NK細胞或CTL的殺瘤活性,IFN-γ具有較強的抗腫瘤和免疫調節作用,TNF-α可直接造成腫瘤細胞的凋亡,其中IL-2、IL-12 和 IFN-γ 均為 Thl細胞直接分泌[7]。腫瘤患者手術前后都可出現Thl反應向Th2的漂移(Th1/Th2 漂移),機體出現 Thl弱勢[8-9],使機體的免疫功能進一步降低。本研究顯示自體DC免疫治療后,Th1 類細胞因子 IL-2、IL-12、IFN-γ 和 TNF-α的水平明顯升高,而Th2型細胞因子IL-10的變化沒有統計學意義,提示DC疫苗能誘導增強體內抗腫瘤細胞免疫,可激發腫瘤患者的Th1型免疫反應,有利于殘余微小病灶的清除。有文獻報道DC免疫治療后DTH陽性及特異性T細胞免疫應答與患者的生存期有一定的相關性[10]。在本研究中,12例常規治療聯合DC組患者有7例患者治療后IFN-γ+CD8+T細胞數量升高2倍以上,其中5例患者治療后DTH試驗呈陽性反應。
毒副作用的觀察提示,在DC疫苗治療過程中,僅少數患者出現低熱反應及輕微的瘤苗注射局部的紅腫、硬結,沒有觀察到嚴重的局部反應及血液細胞學、肝腎功能方面的明顯變化。說明通過熱休克腫瘤細胞后負載DC制備的DC疫苗以及疫苗的治療方式對于患者是相對安全的,可以在臨床推廣應用。總之,我們的研究通過DC疫苗的免疫學效應證實,負載腫瘤細胞抗原的DC疫苗對于惡性黑色素瘤根治術后的輔助治療是安全有效的。但是評價DC輔助治療是否有效的最終指標是無病生存期和總生存期,因此我們將繼續隨訪DC輔助治療對于生存期的影響,以明確其臨床價值。
[1] Redman BG,Chang AE,Whitfield J,et al.Phase Ib trial assessing autologous,tumor-pulsed dendritic cells as a vaccine administered with or without IL-2 in patients with metastatic melanoma[J].J Immunother,2008,31(6):591-598.
[2] O'Rourke MG,Johnson MK,Lanagan CM,et al.Dendritic cell immunotherapy for stage IV melanoma[J].Melanoma Res,2007,17(5):316-322.
[3] 朱玉蘭,錢科卿,高海燕,等.熱休克凋亡乳腺癌細胞負載的DC體內激發Thl型免疫反應[J].南京醫科大學學報,2008,28(1):113-116.
[4] 邵純,宋潔,徐志萍.DC疫苗埋藏式多點皮內注射在腫瘤免疫治療中的應用及臨床觀察[J].護士進修雜志,2008,23(7):649-650.
[5] Brossart P,Wirths S,Stuhler G,et al.Induction of cytotoxic T-lymphocyte response in vivo after vaccinations with peptide-pulsed dendritic cells[J]〗.Immunibiology,2000,96(9):3102-3108.
[6] Engell-Noerregaard L,Hansen TH,Andersen MH,et al.Review of clinical studies on dendritic cell-base vaccination of patients with malignant melanoma:assessment of correlation between clinical response and vaccine parameters[J].Cancer Immunol Immunother,2009,58(1):1-14.
[7] Shi H,Cao T,Connlly JE,et al.Hyperthermia enhance CTL cross-priming[J].J Immuno,2006,176(4):2134-2141.
[8] Hadden JW.Immunodeficiency and cancer:prospects for correction[J].Int Immunopharmacol,2003,3(8):1061-1071.
[9] 沈洪彥,孫治君.Th1/Th2細胞與腫瘤復發[J].中國普外基礎與臨床雜志,2006,13(4):490-492.
[10] López MN,Pereda C,Segal G,et al.Prolonged survival of dendritic cell-vaccinated melanoma patients correlates with tumorspecific delayed type IV hypersensitivity response and reduction of tumor growth factor beta-expressing T cells[J].J Clin Oncol,2009,27(6):945-952.

