Ⅱ、Ⅲ期食管癌術后早期腸內營養的臨床應用分析
侯宜軍,王頂賢,翁文俊
(南京醫科大學第三附屬醫院,江蘇儀征,211900)
絕大多數可行手術治療的Ⅱ、Ⅲ期食管癌患者術前均存在不同程度的營養不良,加上因消化道重建要求的手術早期禁食以及手術創傷應激代謝增高,使營養不良及機體免疫功能進一步加重,影響患者的術后恢復,因此,良好的術后早期營養支持必然成為食管癌治療的重要輔助措施。相對于傳統的腸外營養支持(PN),作者自2000年起,對食管癌患者術后開展了早期腸內營養(EN),取得了滿意效果。現以Ⅱ、Ⅲ期食管癌手術患者為研究對象,采用PN和EN隨機分組方法,通過系統的臨床觀察和生化檢測,探討早期腸內營養的可行性和臨床應用價值。
1 資料和方法
1.1 一般資料
選擇2000年1月~2010年12月本院收治的Ⅱ、Ⅲ期食管癌(UICC 2002)手術患者220例,隨機分為早期腸內營養組(EN)和腸外營養組(PN),2組患者在年齡、體重、術前人血白蛋白、血紅蛋白、術中出血量和術后胸腔引流量方面無明顯差異,見表1。2組患者均有不同程度的吞咽困難、體重減輕,術前經X線鋇餐檢查和胃鏡活組織檢查確診,無內分泌及代謝性疾病,術前肝腎功能正常,術后病理均為鱗癌。

表1 2組患者一般臨床資料
1.2 方法
所有患者均為食管中下段癌,術前1d給予番瀉葉泡飲,在全身麻醉下行食管癌切除,行左胸后外側切口經肋間或中斷肋骨進胸,胃代食管經主動脈弓上至胸頂,圓形管狀吻合器吻合。
營養方法:EN組使用北京靈澤醫藥技術開發有限公司生產的佰通鼻腸管,管徑為CH10。術前將營養管插入胃管側孔,經鼻插入胃內,術中分開將鼻腸管頭端插至十二指腸遠端或空腸上段。術后24 h內給予5%的糖鹽水250 mL,術后第2天給予瑞素500 mL(熱量500 kcal,蛋白質19 g),根據患者耐受情況術后第3~4天增至1 000 mL/d,術后 5~7 d增至1 500 mL/d。靜脈營養組行頸內或鎖骨下靜脈置管,以3 L袋全靜脈營養支持。患者熱量術后早期按25~30 kcal/(kg·d),后期按30~35 kcal/(kg·d)計算,氮量按0.2~0.25 g/(kg·d),EN組不足部分由靜脈補充,以氨基酸為氮源。需水量按1 mL/kcal,并根據損失量加減。2組無吻合口瘺的患者均于術后第6~7天經口進流質飲食,第9天進半流質飲食,第11~13天EN組拔除鼻腸管停腸內營養,PN組停3 L袋全靜脈營養,多數患者于術后第14~15天治愈出院。
1.3 觀察指標
對2組患者術后連續性腸鳴音恢復、肛門排氣時間、營養支持費用,術后第8、14天和出院后首次復診時的體重(Wt)、血紅蛋白(Hb)、外周血淋巴細胞計數(TLC)、人血白蛋白(ALB)以及手術并發癥的情況進行監測和分析。出院后首次復診時間為術后1個月。
2 結 果
2.1 2組患者術后恢復情況及支持費用
EN組部分患者早期出現惡心、腹脹、腹痛癥狀,給予相應處理后逐步耐受。EN組術后連續性腸鳴音和肛門排氣時間明顯縮短,營養支持費用明顯減少。見表2。

表2 2組患者術后恢復情況和營養支持費用的比較
2.2 2組患者體重及血液檢測結果
術后第8天體重、血清ALB2組相比無統計學差異,術后第14天2組相比差異明顯,EN組術后14d與出院后首次復診相比差異明顯;Hb相比2組術后第8、14天無統計學差異,但出院后首次復診與術后14 d同組相比差異明顯;T LC2組相比,術后第8、14天均有明顯差異,見表3。
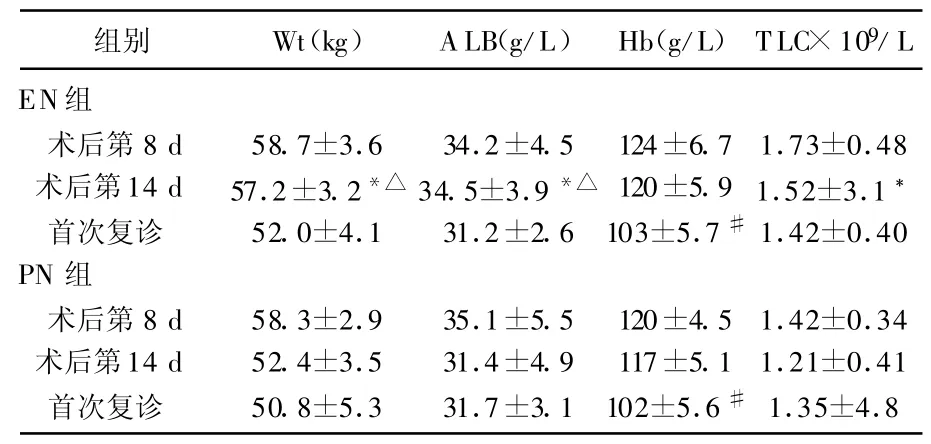
表3 2組患者術后體重及血液檢測結果
2.3 術后并發癥比較
2組術后并發癥的發生率無統計學差異,但吻合口瘺發生后的治療時間和治療費用EN組明顯少于PN組,見表4。

表4 2組患者術后并發癥和吻合口瘺治療情況
3 討 論
營養不良使機體免疫功能受損,增加感染的機會和手術的風險,影響傷口的愈合,增加術后并發癥和死亡率,增加醫療費用[1-2]。食管癌手術范圍廣、創傷大,以往術后多需禁食5~7 d后才能少量經口進食,加速康復外科(FTS)的理念就是利用和調動患者生理機能,盡快使患者恢復自然狀態。因此,食管癌術后良好的營養支持是食管癌治療的重要輔助措施[3]。食管癌術后早期營養支持有PN和EN 2種,比較而言,腸內營養有促進腸蠕動,增加門靜脈系統血流,促進胃腸激素釋放,改善腸黏膜屏障功能,減少腸道細菌和毒素移位等優點。早期腸內營養不但可以改善患者術后營養狀況,還具有免疫調節作用,提高細胞免疫功能,增加患者術后抵抗感染能力[4]。EN患者感染的風險要比PN者為低。長時間禁食導致腸廢用,腸壁通透性增高,還導致腸黏膜細胞絨毛脫落,蛋白含量減低,損害腸道的免疫功能,而早期腸內營養有助于克服以上缺點。本研究顯示,在促進恢復、減少費用方面,腸內營養優于腸外營養。優先考慮給予腸內營養,盡可能地利用有功能的腸道已成為學術界的共識,研究認為消化道手術后胃腸道麻痹僅局限于胃、結腸,而小腸的蠕動、消化和吸收功能在術后6~12 h即可恢復[5],只要術后第1天患者的循環、呼吸穩定,即可實施腸內營養。
急性應激期營養支持應掌握“允許性低熱卡”原則,在應激與代謝狀態穩定后,能量供給適當的增加。本組食管癌術后早期,能量供給在25~30 kcal/(kg·d),即所謂“允許性”低熱卡喂養。其目的在于避免營養支持相關的并發癥。應激期后,合成代謝占優勢,能量補充可達30~35 kcal/(kg·d),以糾正患者的低蛋白血癥[6]。腸梗阻、嚴重腹脹應避免使用腸內營養,腹瀉經一般處理無改善的患者,也應暫時停用腸內營養。輸注營養液要嚴格掌握“三度原則”,即溫度、速度、濃度。以動力泵輸注最為合適,如無條件可重力輸注。在喂養管末端夾加溫器將溫度控制在38~40℃,循序漸進,由少到多,由慢到快,由稀到濃。出現腹痛、腹脹、便頻、惡心、嘔吐等不耐受癥狀要做好解釋工作,可給予解痙、止瀉等藥物。輸注過程中每隔4h以及輸注完畢,宜用溫開水沖管,避免附壁營養液堵管。
有報告認為術后腸內營養組患者肺部感染、心率失常、心力衰竭和切口感染的發生率較靜脈營養組低[7-8]。本組觀察,EN利于患者圍術期恢復,但未能降低并發癥的發生率。作者體會食管癌術后上述并發癥的發生主要取決于圍術期的正確處理,早期腸內營養雖可提高食管癌術后患者的營養狀況和生化指標的恢復,卻不能降低早期并發癥的發生率。但EN對患者營養狀態的良好支持,有利于并發癥發生后的處理,尤其是吻合口瘺。瘺發生后腸內營養組患者的住院時間和治療費用明顯減少證明了上述觀點。食管癌術后胃癱是常見的并發癥之一,采取腸內營養完全能保證患者的營養和水電解質平衡的需要,減少臥床時間,還可刺激腸道蠕動,促進胃癱恢復。
[1] 王傳湄,徐麗丹,江美芳,等.危重癥患者腸內與腸外營養支持的對比觀察[J].腸外與腸內營養,2009,16(3):157.
[2] 陳強譜,邢月利,歐 琨,等.早期腸內營養對胃腸癌患者術后T淋巴細胞亞群的影響[J].中國腫瘤雜志,2001,20(3):154.
[3] 周建萍,張蘭鳳,杭小平.加速康復外科理念在食管癌術后早期腸內營養中的應用及護理[J].實用臨床醫藥雜志,2010,14(20):123.
[4] 張 毅,譚黎杰,錢 成,等.食管癌患者術后早期腸內營養支持的作用[J].腸外與腸內營養,2007,14(5):282.
[5] MinardG,Kudsk K A.Is early feeding beneficial How early is early[J].New Horiz,1994,2(2):156.
[6] 黎介壽.臨床營養支持的發展趨勢[J].腸外與腸內營養,2010,17:1.
[7] 王楚華,沈有期,黃世英.不同營養支持療法對術后早期食管癌和賁門癌患者的影響[J].廣東醫學,2010,31(1):107.
[8] 王化勇,胡正群,李 勇,等.食管癌患者術后早期腸內營養的臨床研究[J].腸外與腸內營養,2008,15(5):295.
[9] Braga M,Gianotti L,Radaelli G,et al.Preoperative immunonutrition in patients undergoing cancer surgery:result of a randomized double-blind phase 3 trial[J].Arch Surg,1999,134(4):428.

