二氫吡啶類鈣通道拮抗劑的劑型研究進展
覃小恒, 鄒巧根, 張尊建*
(1.教育部藥物質量與安全預警重點實驗室,江蘇 南京 210009;2.中國藥科大學分析測試中心,江蘇 南京 210009;3.南京工業大學生物與制藥工程學院,江蘇 南京 210009)
高血壓是我國最常見的心腦血管疾病,也是目前對人類威脅最大,死亡率最高的疾病之一。二氫吡啶類(dihydropyridine,DHP)鈣拮抗劑,俗稱“地平類降壓藥”,為20世紀60年代后期研究開發的一類新型藥物,現已成為治療高血壓最重要的藥物類別之一。第一代DHP鈣拮抗劑又稱短效DHP鈣拮抗劑,代表藥物有硝苯地平和尼卡地平等,其體內半衰期(t1/2)及藥效持續時間均較短;第二代DHP也稱長效DHP鈣拮抗劑,如貝尼地平、尼索地平和尼群地平等,與第一代DHP鈣拮抗劑相比,第二代DHP鈣拮抗劑藥效持續時間顯著延長,但其水溶性較差,即使藥物在體內釋放完全,生物利用度也較低;第三代DHP鈣拮抗劑克服了前兩代DHP鈣拮抗劑藥效持續時間短及生物利用度低的缺點,代表化合物有氨氯地平和拉西地平等。以氨氯地平為例,其在人體中的t1/2為35~50 h,生物利用度為64% ~88%,顯著優于前兩代DHP鈣拮抗劑[1-3]。
第一、二代DHP鈣拮抗劑大多為水難溶性化合物,且吸收過程中可發生首過效應,從而導致其生物利用度較低;另外,此類藥物藥效持續時間通常較短,若要達到平穩降壓的目的則需讓患者頻繁服藥,因此依從性較低。然而這些藥物又有其獨特的臨床價值而不能被替代,因此,除通過大規模的有機合成和篩選工作,獲得生物利用度和t1/2均顯著改善的新型DHP鈣拮抗劑外,研究人員也嘗試對現有的DHP鈣拮抗劑進行劑型改進,以達到改善其藥動學及藥效學特性的目的。本文重點介紹國內外有關DHP鈣拮抗劑劑型改進方面的研究成果,旨在為部分DHP鈣拮抗劑類藥物的進一步開發提供參考。
1 提高藥物的生物利用度
如前所述,導致DHP鈣拮抗劑類藥物生物利用度較低的原因主要有兩點:第一,溶解性較差。藥物口服后先在消化道內溶解于消化液中,然后通過被動擴散或主動轉運等吸收機制進入血液循環,若其溶解性較差,則在消化液中溶出速率也偏低,從而影響藥物吸收;第二,存在首過效應,首過效應可使一部分藥物被肝藥酶代謝而損失,導致生物利用度偏低。針對上述問題,研究人員采用固體分散技術、環糊精包合技術和脂質體技術等手段,提高藥物的體內溶出度;通過改變給藥途徑如靜脈給藥、鼻腔給藥或口腔黏膜給藥以避免首過效應以改善藥物在體內的吸收,進而提高生物利用度。
1.1 固體分散體
固體分散體(solid dispersion,SD)系指藥物以分子、膠體、微晶或無定形的形式均勻分散在固態載體物質中而形成的體系。應用SD技術,可大大提高難溶性藥物的溶出度,從而提高其口服生物利用度。常見SD制備方法有熔融法、溶劑法和研磨法等。
管清香等[4]采用熔融法,將聚乙二醇 6000(PEG 6000)和泊洛沙姆188按質量比1∶39混合作為載體制備了尼莫地平的固體分散體。體外溶出試驗顯示,該固體分散體中尼莫地平在pH 6.8磷酸鹽緩沖液中溶出50%所需時間僅為19.90 min,遠遠短于尼莫地平原料藥粉末(溶出50%所需時間在1000 min以上)。趙艷花等[5]采用熔融法,以泊洛沙姆188為載體制備了尼群地平固體分散體,發現藥物在水中的溶解度隨載體比例增大而升高:尼群地平在水中的溶解度為0.102 mg·L-1,當尼群地平與泊洛沙姆188的質量比為1∶1時,尼群地平溶解度為5.351 mg·L-1;而當該比例達1∶8時,尼群地平在水中溶解度大于38.26 mg·L-1,為單獨使用尼群地平時藥物溶解度的300倍以上。靖博宇等[6]采用溶劑法、熔融法和溶劑蒸發-沉積技術,分別以聚乙烯吡咯烷酮(PVPK30)、泊洛沙姆188或吐溫80為載體,制備了非洛地平固體分散體。體外釋藥研究顯示,藥物累積釋放量隨載體比例增大而升高,但升高到一定水平便再無顯著變化:當非洛地平與PVPK30的質量比為1∶10時,非洛地平在水中1 h內的累積釋放量最高可達58%;非洛地平與泊洛沙姆的質量比為1∶8時,非洛地平在1 h內的累積釋放量最高可達70%;非洛地平、吐溫80和吸附劑聚乙烯聚吡咯烷酮(PVPP)的質量比為1∶4∶5時,1 h累積釋放量最高可達90%以上,約為相同溶出條件下非洛地平原料藥的15倍。不同制備工藝對固體分散體中藥物的溶出度也有不同程度的影響。Won等[7]以羥丙甲纖維素(HPMC)為載體,氫化蓖麻油和泊洛沙姆為表面活性劑,分別采用傳統溶劑蒸發法(CSE)和超臨界抗溶劑沉積法(SAS)制備了非洛地平的固體分散體,溶解性研究顯示,上述2種固體分散體中非洛地平在水中的溶解度分別為40.55和107.24 mg·L-1,而非洛地平原料藥的溶解度僅為0.5 mg·L-1。將SAS法制備的非洛地平固體分散體壓制成片,其在pH 6.5的磷酸緩沖液中2 h內溶出度在90%以上。
1.2 環糊精包合物
包合物系指某種物質分子被全部或部分包合于另一種分子的空穴結構內所形成的特殊的絡合物。包合物技術可提高難溶性藥物的溶解度和生物利用度,也可調節藥物釋放速率,掩蓋藥物不良氣味。目前,制劑工藝中常用包合材料為環糊精(cyclodextrin,CD)及其衍生物。環糊精的空穴開口處呈親水性,空穴內部呈疏水性,若將疏水性藥物包合于環糊精內,則可改善藥物水溶性不佳的問題。管清香等[8]采用飽和水溶液法制備了尼群地平的環糊精包合物,經過正交試驗確定最佳制備條件為:尼莫地平與β-CD的摩爾比1∶2,攪拌時間4 h,攪拌溫度50℃。該條件下所制得的尼群地平環糊精包合物在蒸餾水中溶解度為(8.48±0.07)mg·L-1,約為尼群地平原料藥溶解度的10.5倍,顯著改善了尼群地平的溶解性。
1.3 脂質體和前體脂質體
脂質體是由磷脂和膽固醇組成的具有類似生物膜雙分子層結構的封閉膜性微球,其可將脂溶性藥物包裹在疏水基團的夾層中,從而增加藥物的水溶性。此外,該類藥物載體具有組織相容性、細胞親和性和靶向性等特點,還可使所載藥物緩釋或控釋,因而近年來受到研究人員的廣泛關注。Wang等[9]采用改良乙醇注射法制備了尼莫地平脂質體,在大鼠體內進行的藥動學研究顯示,靜脈注射該脂質體的尼莫地平AUC為普通尼莫地平注射液的1.78倍。
前體脂質體(proliposome)是一種干燥的、具有良好流動性的粉末,系將脂質體膜材與藥物的混合溶液在減壓攪拌下逐步分布到一種可溶性固體載體表面所形成的體系。普通脂質體在放置過程中,其磷脂雙分子層易發生聚集,從而破壞了體系的均一性和穩定性,使藥物易發生滲漏,因此其使用受到了一定限制;前體脂質體則由于尚未形成脂質雙分子層,不會發生脂質體聚集融合,使用前只需加水即得脂質體,因此可在一定程度上克服傳統脂質體穩定性不佳、不宜久置的缺陷。夏萌申等[10]采用薄膜載體沉積法制備了尼莫地平的前體脂質體。分別給大鼠尾靜脈注射上述尼莫地平前脂質體和普通尼莫地平注射液,結果顯示兩者AUC分別為42991.2和24025.9 μg·min·L-1,表明尼莫地平制成前脂質體后其生物利用度明顯提高。
1.4 自乳化釋藥系統
自乳化釋藥系統 (self emulsifying drug delivery system,SEDDS)是由藥物、油相和表面活性劑按一定比例組成的各向同性的混合物,通常還含有一種或多種親水性的助溶劑或輔助乳化劑。SEDDS在胃腸道內,或環境溫度適宜(通常為37℃)及溫和攪拌的條件下,可迅速形成精細的水包油乳劑結構。通常SEDDS所形成的精細乳劑粒徑范圍較大,從幾納米到幾微米不等。當體系中親水性表面活性劑較多或在體系中添加助溶劑時,輕微攪動下即可形成更精細的乳劑(粒徑范圍為100~250 nm),即自微乳化釋藥系統(SMEDDS)[11-12]。SEDDS可提高水難溶性藥物和脂溶性藥物的水溶性,促進藥物的吸收,從而提高藥物的生物利用度;其水包油結構可避免穩定性較差的藥物發生水解及刺激性藥物對胃腸道的刺激;此外,其還具有服用方便、制備簡單以及適合大規模生產等優點。因此,SEDDS也常被用作DHP鈣拮抗劑的釋藥系統。
紀海英等[13]用肉豆蔻酸異丙酯、葵酸酯、吐溫80和十二烷基硫酸鈉制備了載有尼群地平的SEDDS,將所得SEDDS灌裝于軟膠囊中,然后進行體外釋藥研究,結果顯示,膠囊中尼群地平在蒸餾水、0.1 mol·L-1HCl和 pH 6.8磷酸鹽緩沖液中45 min時的溶出度均在75%以上,遠高于市售尼群地平片劑(約為6%)。傳統的SEDDS通常為液態形式,為方便口服需灌裝在軟膠囊或硬膠囊中,但該劑型存在藥物易泄露與沉降、膠囊老化,以及生產成本偏高等缺點。因此,近來也有人嘗試將液態SEDDS改良為固態 SEDDS。Wang等[14]采用擠出-滾圓法,以微粉硅膠(SYLOID?244 FP)為吸附劑,將尼群地平液態SEDDS制成了固態SEDDS,并加入微晶纖維素(MCC)改善其成粒性。在比格犬體內進行的藥動學研究顯示,經口使用尼群地平固態SEDDS的生物利用度約為尼群地平普通片劑的1.6倍,雖與尼群地平的液態SEDDS相近,但卻具有更好的制劑穩定性,以及更低的藥物泄露率和沉降率。
1.5 微乳
微乳系由水相、油相、表面活性劑和助表面活性劑按適當比例混合而自發形成的各向同性、透明、熱力學穩定的一種分散體系,液滴粒徑為100~1000 nm時稱為亞微乳,粒徑為10~100 nm時則稱為納米乳。亞微乳是近年來研究較多的一種新型液體劑型,可使藥物均勻分布于油相,大大提高其穩定性,適合用作易水解藥物的載藥系統;也能提高水難溶性藥物的溶解度,解決其在被制成注射劑使用時易出現的問題。傳統的尼莫地平注射劑在放置過程中易析出晶體,使用前需溫熱使之溶解;此外,由于尼莫地平水溶性較差,需在注射劑中添加乙醇促進藥物溶解,但若長期用藥,制劑中的乙醇會對血管壁造成刺激。為克服這一問題,張翠霞等[15]采用磷脂和泊洛沙姆188(質量比為2∶1)制備了尼莫地平亞微乳,包封率達97.9%,該釋藥體系在常溫及加速試驗條件下放置3個月均性質穩定,克服了傳統尼莫地平注射劑不穩定及刺激性較大等缺點,使尼莫地平靜脈給藥更加安全。
納米乳具有經熱壓滅菌或離心也不會分層,液滴粒徑小,黏度低,可減輕注射時的疼痛感及緩釋和靶向性等特性,因此,作為一種新型載藥系統受到廣泛關注。Jain等[16]以吐溫80為表面活性劑、Transcutol P(二乙二醇單乙基醚)為增溶劑、Solutol?HS-15(聚乙二醇十二羥基硬脂酸酯)為輔助表面活性劑,制備了尼群地平納米乳,用于鼻腔噴霧給藥。該制劑穩定性較好,放置1個月體系無明顯變化,在家兔中進行的研究顯示,該尼群地平納米乳鼻噴劑和市售口服片劑AUC分別為1524.81 和 932.05 ng·min·L-1,表明鼻噴劑生物利用度顯著高于市售尼群地平片劑。
1.6 口腔粘附制劑
口腔粘附制劑是一種新型藥物釋放系統,主要是利用一些藥用高分子材料可與口腔黏膜緊密粘附的特性,將藥物與合適的高分子材料制成片劑粘附于口腔黏膜,使藥物經由黏膜吸收,從而避免藥物的首過效應,提高生物利用度。Charde等[17]采用羥丙基甲基纖維素(HPMC)為生物粘附劑,以聚環氧乙烯(PEO)為緩釋材料制備了樂卡地平口腔粘附片,給家兔分別經口使用樂卡地平普通片劑與該課題組制備的口腔粘附片,結果顯示2種制劑血藥濃度達峰時間(tmax)分別為1.0和2.0 h,AUC分別為(1202.5 ±143.8)和(1997.4 ±261.0)μg·h·L-1,表明該課題組制備的樂卡地平口腔粘附片生物利用度明顯高于普通片劑。
2 延長藥物的作用時間
硝苯地平等短效DHP拮抗劑給藥后的血藥濃度迅速達到峰值,不利于用藥者血壓的平穩下降(Ochs等,Klin Wochenschr,1984 年;R?msch 等,Am J Nephrol,1986年),而且該類藥物的普通制劑需多次給藥,劑量也需嚴格控制。然而,多次給藥往往容易造成反射性心率加快,已有越來越多的證據表明短效DHP鈣拮抗劑在降低心血管病發病率和死亡率以及改善病人生活質量方面并不令人滿意,且有增加癌癥發病率和胃腸道出血的風險[18]。因此,近年來國內外研究人員也在相繼開發DHP鈣拮抗劑類藥物的緩控釋制劑,一方面可減少給藥次數,提高療效及病人的依從性;另一方面也能使病人血壓平穩下降,用藥更為安全。
2.1 骨架型緩釋片
骨架型緩釋片是最常見的緩釋制劑類型,其又可分為溶蝕型、親水凝膠型和非親水凝膠型。HPMC為常用骨架材料,其遇水則發生水化呈凝膠狀,藥物可通過擴散和溶蝕雙重機制從中釋放。陳崇清[19]以HPMC為骨架材料,制備了尼索地平的親水凝膠型骨架緩釋片。體外釋放研究顯示,該骨架緩釋片在0.5%十二烷基硫酸鈉水溶液中12 h內呈一級釋放,緩釋行為與拜耳公司開發的尼索地平緩釋片SULAR?相似。向軍濤等[20]采用聚甲基丙烯酸甲酯作為緩釋骨架材料制備了硝苯地平非親水凝膠型緩釋片,克服了HPMC作為骨架材料時緩釋片釋放速度容易受釋放介質離子強度影響的缺點,使緩釋片中硝苯地平在消化道內不同部位均可穩定釋放。該緩釋片制備工藝重復性好,在0.1 mol·L-1HCl溶液中2、4和8 h時的累積釋放度分別為30% ~50%、50% ~70%和70%以上,符合藥品標準規定。Penwest制藥公司研制了一種名為TIMERx?的藥物緩釋系統,該系統是以雜多糖黃原膠和半乳甘露聚糖槐豆膠這2種天然多糖為材料制成的親水骨架基質材料,在水性環境下骨架基質層中的2種多糖起協同作用,形成一層緊密的、可緩慢溶蝕的凝膠層,從而控制藥物從制劑中釋放的速度。Mylan公司和賽諾菲-圣德拉堡(Sanofi-Synthelabo)公司分別利用這項專利技術開發了硝苯地平的緩釋片,商品名分別為Generic Version of Procardia?XL(即由拜耳公司開發的Procardia?XL的仿制藥)和Slofedipine?XL[21],每日僅需服藥 1 次,而普通硝苯地平片劑需每日服藥3次。
近來,有研究人員開發了一種將速釋與緩釋技術相結合的新型制劑,主要目的是在減少患者服藥次數的同時降低血藥濃度峰谷波動的幅度,使血藥濃度達到相對平穩的水平。張勇等[22]根據尼索地平在人體胃和小腸吸收能力較強而在結腸段吸收較弱的特點,制備了尼索地平控釋包心片。該片劑外層為緩釋部分,以HPMC為藥物緩釋骨架材料,使藥物在胃和小腸部分緩慢釋藥;片心為速釋部分,可在結腸段迅速釋藥以彌補該部位吸收較弱的缺陷。在0.2%十二烷基硫酸鈉水溶液中進行的體外釋放研究結果顯示,該制劑的緩釋部分在第0~6 h釋放,速釋部分在第6~10 h內釋放。兩階段的釋藥機制均為非Fick擴散,即藥物擴散與骨架溶蝕協同作用。在緩釋制劑中加入速釋部分的另一個目的是為了在藥物長時間維持治療濃度的前提下,迅速達到降壓效果。王穎等[23]研制了尼群地平雙層緩釋片,其中包含速釋層與緩釋層。在含有乙醇的人工胃液中進行的體外釋放研究結果顯示,片劑速釋部分首先釋放,10 min內釋藥量達40%,提示該制劑口服后可在體內迅速達到有效治療濃度;隨后,緩釋部分緩慢釋放,可維持24 h。
2.2 滲透泵片
滲透泵片是由藥物、半透膜材料、滲透壓活性物質及推動劑等組成的一種控釋制劑,以藥片內高滲透壓為推動力恒速釋放藥物,且釋藥不受胃腸道生理環境影響。滲透泵片按結構特點可分為單室型和多室型。單室型滲透泵片一般適用于易溶性藥物,包括片芯和包衣膜兩部分,其中,片芯由藥物和高滲透性物質組成,包衣膜為半透膜,膜上通常打一小孔作為藥物輸出孔道。多室型滲透泵片一般至少由藥室和動力室這兩部分組成,使用時,水分由包衣膜進入動力室,動力室中的高分子材料吸水膨脹,從而擠壓藥室使藥物經包衣膜上小孔釋放(見圖1)。而難溶性藥物的溶解度較低,難以在片芯微環境中形成較高的濃度和滲透壓來維持有效釋藥速度,需使用大量促滲劑來維持持久恒定的滲透壓,但此舉往往使藥片片重超過正常范圍。因此,單室型滲透泵片不適用于難溶性藥物,需增加動力室,即制成多室型滲透泵片方能確保藥物恒速釋放。德國拜耳公司開發的硝苯地平控釋片Procardia?XL就采用了多室型滲透泵片技術。G·韋尼奧等[24]發明了尼索地平多室型控釋口服片劑,其中心層含有尼索地平和控釋成分;上下兩層為阻擋層,含有可膨脹且易溶蝕的聚合物,可使藥物延遲一段時間再釋放;最外層包有半透膜。人體藥動學研究表明:該課題組制備的尼索地平控釋片tmax為9.42 h,明顯長于尼索地平普通片(tmax為1 h)。在尼索地平載藥量相同的條件下,該課題組制備的尼索地平控釋片和市售尼索地平緩釋片SULAR?的 AUC 分別為72.84 和68.21 μg·h·L-1。
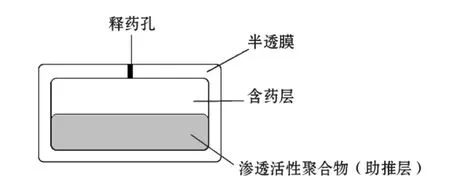
圖1 雙室滲透泵片結構示意圖Figure 1 The structural diagram of bilayer-core osmotic pump tablet
葉琳琳等[25]采用聚環氧乙烷為助懸劑,用激光打孔機在外層包衣膜上下各打一個釋藥孔,如此制備的硝苯地平單室型滲透泵片與市售口服硝苯地平雙室型滲透泵片在5%乙醇溶液中釋放行為一致,具有良好的零級釋放特征;且21 h內制劑形態良好,可有效防止藥物突釋。雖然在國外雙室型滲透泵片的產品已經上市,但其在制備過程中需使用帶有藥物辨識功能的激光打孔機,成本高昂,且多層滲透泵片劑的制備工藝復雜,故而其在國內的開發和應用均受到一定限制,因此研發結構簡單、適合工業化生產的滲透泵片成為國內該領域的熱點。徐向寧[26]使用帶針沖頭的壓片機制備了由帶孔藥物層和助推層組成的雙層片芯(見圖2),并對其進行包衣,即得硝苯地平雙室型滲透泵片,通過調整包衣膜厚度及增塑劑比例使藥物達到零級釋放。該工藝的創新之處在于,藥物層上的孔具有足夠大的空間,包衣膜厚度較小,因此在包衣過后,孔洞不會被包衣膜完全封閉,未被包裹的空隙即滲透泵片的釋藥孔,可使藥物經由小孔緩慢釋放,免去激光打孔過程,大大降低了生產成本。體外釋放研究顯示,該課題組制備的硝苯地平滲透泵片在人工胃液和腸液中24 h內接近恒速釋放,釋藥速率約為每分鐘3.75%,其釋放曲線與市售硝苯地平控釋片Procardia?XL相比,f2因子達62.4,表明其控釋效果良好。
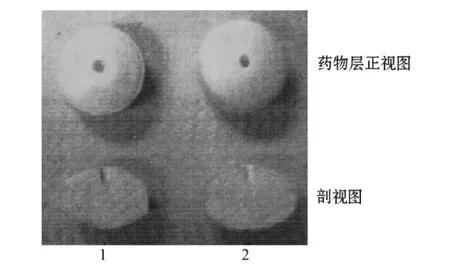
圖2 使用帶針沖頭壓片機制備的雙層滲透泵片Figure 2 The bilayer-core osmotic pump tablet prepared by tablet press machine with needle on its punch pin
2.3 緩釋微丸
微丸為一種粒徑在0.25~2.5 mm之間的微球或類球形制劑,藥物以溶解狀態或分散狀態存在于球形骨架中,口服后可廣泛、均勻地分散在胃腸道。該劑型具有流動性好、釋藥穩定以及局部刺激小等優點。采用不同材料對微丸進行包衣,可達到緩、控釋的目的,常用緩釋微丸包括膜控型、骨架型,以及膜控與骨架技術結合的微丸。任君剛等[27]先以聚乙二醇4000為載體,制備了硝苯地平固體分散體,然后采用擠出-滾圓法制備了硝苯地平24 h骨架型緩釋微丸。在犬中進行的藥動學研究結果顯示,該課題組自制微丸與硝苯地平控釋片Procardia?XL的tmax分別為(5.0±1.1)和(5.7±0.8)h,AUC 分別為(311.3 ±71.7)和(308.6 ±70.1)μg·h·L-1,相對生物利用度為(102.1±18.4)%,提示兩者具有生物等效性;與Procardia?XL相比,該課題組設計的制備工藝更為簡單。劉偉芬[28]將其制備的硝苯地平膜控型脈沖釋藥緩釋微丸給大鼠灌胃使用,結果顯示硝苯地平在給藥后約4.49 h開始釋放,6.18 h時血藥濃度達到峰值,更符合時辰治療學強調的在特定時間產生一定藥物濃度的要求;而普通硝苯地平片劑血藥濃度達峰時間僅為0.61 h,無延遲釋藥效果。
DHP鈣拮抗劑類藥物在吸收過程中普遍存在較強的首過效應,制成緩釋制劑后藥物吸收時間延長,故而生物利用度低于相同劑量下的普通制劑。為解決這一問題,可增加給藥劑量或添加速釋部分以使肝藥酶達到飽和狀態。Teramura等(Xenobiotica,1997年)將鹽酸巴尼地平的速釋微丸與緩釋微丸按質量比1∶2混合,得到了生物利用度較高的鹽酸巴尼地平緩釋膠囊,AUC0-∞為鹽酸巴尼地平普通制劑的97%±15%,是單獨口服鹽酸巴尼地平緩釋微丸的1.4倍。
2.4 原位凝膠
原位凝膠系指一類以溶液形式存在的制劑,給藥后立即在用藥部位發生相轉變,由液態轉化為非化學鍵交聯的半固體凝膠。這種由水溶性高分子材料制備的原位凝膠具有高度親水性的三維網格結構,以及良好的組織相容性、生物黏附性和獨特的溶液-半固體凝膠轉變性質,此外,其還有制備工藝簡便、應用方便、在用藥部位滯留時間較長及緩釋性能良好等優點。任逢曉等[29]采用泊洛沙姆407和泊洛沙姆188為載體材料制備了尼莫地平脂質體原位凝膠。給家兔左后腿股四頭肌肌內注射該自制凝膠或尼莫地平溶液,結果顯示,兩者的tmax分別為(2.0±0.7)和(0.6±0.3)h,表明該原位凝膠系統具有明顯緩釋作用;此外,自制原位凝膠和溶液劑中尼莫地平的AUC0-∞分別為(402 ±15)和(227 ±53)μg·h·L-1,提示原位凝膠中尼莫地平的生物利用度更高。
3 結語
隨著科學技術的不斷發展,各種增溶技術及緩控釋技術相繼出現與成熟,使得一些原本因理化性質與體內藥動學參數不佳而應用受到限制的藥物重獲新生,DHP鈣拮抗劑便是很好的例子。根據臨床高血壓治療所強調的平穩降壓的原則,長效DHP鈣拮抗劑越來越受到患者青睞,緩控釋劑型的開發和改進仍將是DHP鈣拮抗劑研究領域的熱點。可以相信,隨著對制劑技術研究的不斷深入,一定會有更多溶解性好、生物利用度高及作用時間持久的新型DHP鈣拮抗劑和相關新制劑問世,為患者帶來希望。
筆者所在課題組以鹽酸巴尼地平為主藥,聚甲基丙烯酸酯為包衣材料,制備了膜控型緩釋微丸和速釋微丸,目前正在進行處方工藝的優化和篩選工作,并計劃以該制劑在比格犬體內的生物利用度為考察指標,確定速釋成分與緩釋成分的最佳配比,以期獲得具有較高生物利用度的鹽酸巴尼地平緩釋微丸。
[1]Lüscher T F,Cosentino F.The classification of calcium antagonists and their selection in the treatment of hypertension.A reappraisal[J].Drugs,1998,55(4):509-517.
[2]孟舒獻,溫曉娜.二氫吡啶類鈣通道阻滯劑的研究進展[J].廣東藥學院學報,2004,20(2):170-172.
[3]張石革,馬國輝,臧靖.二氫吡啶類鈣通道阻滯劑的研究進展與合理應用[J].中國全科醫學,2006,9(4):314-316.
[4]管清香,林天慕,劉晶瑤,等.尼莫地平固體分散體的制備[J].吉林大學學報:醫學版,2003,29(1):72-75.
[5]趙艷花,傅紅興,李校堃,等.尼群地平-泊洛沙姆188固體分散體的制備[J].溫州醫學院學報,2007,37(6):591-592.
[6]靖博宇,王志遠,李燕,等.非洛地平固體分散體的制備和體外溶出度考察[J].沈陽藥科大學學報,2010,27(3):185-190.
[7]Won D H,Kim ms,Lee S,et al.Improved physicochemical characteristics of felodipine solid dispersion particles by supercritical anti-solvent precipitation process[J].Int J Pharm,2005,301(1/2):199-208.
[8]管清香,林天慕,丁志英,等.尼群地平-β-環糊精包合物的制備[J].吉林大學學報:醫學版,2005,31(5):811-813.
[9]Wang Z X,Deng Y J,Zhang X P,et al.Development and pharmacokinetics of nimodipine-loaded liposomes[J].J Pharm Pharmacol,2006,58(9):1289-1294.
[10]夏萌申,黃莉穎,殷璐璐.尼莫地平前體脂質體的制備和大鼠藥動學的研究[J].華西藥學雜志,2002,17(2):98-103.
[11]Gursoy R N,Benita S.Self-emulsifying drug delivery systems(SEDDS)for improved oral delivery of lipophilic drugs[J].BiomedPharmacother,2004,58(3):173-182.
[12]Kohli K,Chopra S,Dhar D,et al.Self-emulsifying drug delivery systems:an approach to enhance oral bioavailability[J].Drug Discov Today,2010,15(21/22):958-965.
[13]紀海英,張鈞壽.尼群地平膠囊自乳化釋藥系統處方優化研究[J].中國藥科大學學報,2004,35(3):211-214.
[14]Wang Z,Sun J,Wang Y,et al.Solid self-emulsifying nitrendipine pellets:preparation and in vitro/in vivo evaluation[J].Int J Pharm,2010,383(1/2):1-6.
[15]張翠霞,王東凱,王海鳳,等.尼莫地平亞微乳的制備及其性質考察[J].中國新藥雜志,2006,15(15):1264-1267.
[16]Jain R,Patravale V B.Development and evaluation of nitrendipine nanoemulsion for intranasal delivery[J].J Biomed Nanotechnol,2009,5(1):62-68.
[17]Charde S,Mudgal M,Kumar L,et al.Development and evaluation of buccoadhesive controlled release tablets of lercanidipine[J].AAPS PharmSciTech,2008,9(1):182-190.
[18]劉天行.對鈣拮抗劑安全性的提示[J].中國醫院藥學雜志,2001,21(1):61.
[19]陳崇清.尼索地平凝膠骨架片的制備[J].中國現代藥物應用,2009,3(11):5-6.
[20]向軍濤,蔣琳蘭.硝苯地平骨架緩釋片的制備及體外釋放度的考察[J].廣東藥學院學報,2006,22(5):489-491.
[21]張彥,呂竹芬.新型緩(控)釋骨架片的研究進展[J].藥品評價,2006,3(6):446-449.
[22]張勇,宗莉,平其能,等.尼索地平控釋包心片釋藥機理的研究[J].中國藥科大學學報,2003,34(5):426-429.
[23]王穎,侯峻冰.尼群地平雙層緩釋制劑:中國,1524526[P].2004-09-01.
[24]G·韋尼奧,P·格勒尼耶,A·尼安米斯.包含尼索地平的控釋固體口服制劑:中國,101516352A[P].2009-08-26.
[25]葉琳琳,蔣國強,陳軍,等.硝苯地平口服滲透泵片的制備及其體外釋藥特性[J].精細化工,2002,19(11):628-647.
[26]徐向寧.免激光打孔法制備雙層芯滲透泵片的研究[D].杭州:浙江大學,2007.
[27]任君剛,鄒梅娟,王悅,等.硝苯地平骨架緩釋微丸的制備及在家犬體內的藥物動力學[J].沈陽藥科大學學報,2007,24(2):70-73.
[28]劉偉芬.硝苯地平脈沖釋放微丸的研制[D].開封:河南大學,2007.
[29]任逢曉,姚靜,周建平,等.LC-MS法研究尼莫地平脂質體原位凝膠在家兔體內的藥動學[J].中國新藥與臨床雜志,2008,27(5):341-345.

