氧化應激在高脂高鹽飲食伴高糖飲水誘導的代謝綜合征腎病大鼠中的作用*
孔 祥, 張道友, 張 妍, 吳海兵, 李芳霞
(皖南醫學院1藥理學教研室,國家中醫藥管理局中藥藥理三級實驗室,2弋磯山醫院腎內科,3弋磯山醫院消化內科,安徽 蕪湖 241001)
代謝綜合征(metabolic syndrome,MS)是以胰島素抵抗為病理生理基礎,伴有中心性肥胖、高血脂、高血壓、糖尿病或空腹血糖增高的癥候群,已經成為危害人類生命健康的全球性問題[1]。近年來研究證實MS不僅是心、腦血管疾病的危險因素,亦可導致腎臟損傷。文獻報道MS能夠引起進行性腎小球硬化,增高白蛋白尿和慢性腎病的發病率[2]。但是,MS腎病的發病機制尚未完全闡明,其主要原因之一是缺乏能充分模擬臨床特征的動物模型。
目前,長期飲食誘導(高脂和/或高糖喂飼)是建立MS大鼠模型的一種常用方法[3]。此方法建立的模型能夠模擬人類MS大多數特征,但未見腎臟功能和結構損傷的報道。實際上,長期攝入單純高脂、高糖飲食能否引起腎臟損傷尚存在爭議[4,5]。然而,有文獻報道高鹽攝入可引起大鼠高胰島素血癥、高血壓和腎臟損傷[6]。因此,我們通過長期高脂高鹽飲食和高糖飲水喂飼Sprague-Dawley(SD)大鼠,以期建立一種MS腎病動物模型。
氧化應激是指機體在遭受各種刺激時,自由基產生和抗氧化防御系統失衡的一種病理狀態,在高血脂、高血壓和糖尿病的發生和發展中起著不可忽視的作用[7]。然而氧化應激在MS腎病中的作用未見相關報道。故本研究在建立MS腎病大鼠模型的基礎上,探討腎臟中氧化應激的狀態、產生機制及其對腎臟結構和功能的影響。
材料和方法
1 材料
1.1 主要試劑 葡萄糖、甘油三酯(triglyceride,TG)和總膽固醇(total cholesterol,TC)試劑盒購自上海榮盛生物藥業有限公司;白蛋白和胰島素(insulin,Ins)放免試劑盒購自北京北方生物技術研究所;尿蛋白、肌酐、總抗氧化能力(total antioxidant capacity,TAOC)、抑制超氧陰離子能力(inhibiting superoxide anion capacity,ISAC)、丙 二 醛 (malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽過氧化物酶(glutathione peroxidase,GPx)和過氧化氫酶(catalase,CAT)活性檢測試劑盒購自南京建成生物工程研究所;Cu/Zn-SOD、NADPH氧化酶亞單位 p47phox和 p22phox抗體購自 Santa Cruz;β-actin抗體購自武漢博士德公司;辣根過氧化物酶標記Ⅱ抗購于北京中杉金橋生物技術有限公司;ECL試劑盒購于Pierce。
1.2 動物和飼料 7周齡雄性SD大鼠20只,體重200-240 g,購自浙江省試驗動物中心,許可證號為SCXK(浙)20080033。大鼠飼料購自南京青龍山實驗動物中心。高脂高鹽(high-fat and high-salt,HFS)飼料配方見作者之前報道[8]。(1)正常飼料(g·kg-1):蛋白質217,碳水化合物462,脂肪44,纖維素80,氯化鈉4,混合礦物質24,混合維生素2。HFS飼料(g·kg-1):蛋白質 211,碳水化合物 330,脂肪200(含15%豬油和1%膽固醇),纖維素65,氯化鈉40,混合礦物質24,混合維生素2。(2)飼料熱量組成和密度如下:正常飼料,蛋白質占總熱量27.8%,碳水化合物 59.3%,脂肪 12.8%,3.1 kCal·g-1;HFS飼料,蛋白質21.3%,碳水化合物45.4%,脂肪33.3% ,4.0 kCal·g-1。
2 方法
2.1 模型建立及處理 大鼠分籠飼養,每籠1只,室溫(22~24)℃,自由進食飲水,適應1周后隨機分為2組,正常對照組(control,n=10,給于普通飼料和正常飲水)和模型組(MS,n=10,給于 HFS飼料和20%蔗糖飲水)。2組大鼠按此條件持續喂養20周。每周測量1次體重(body weight,BW)。每4周用ALC-NIBP無創血壓測定系統,測清醒狀態下大鼠尾動脈收縮壓(systolic blood pressure,SBP)[8,9]。于20周末代謝籠收集24 h尿液后,大鼠麻醉后腹主動脈取血,離心分離血清。稱內臟脂肪(visceral fat weight,VFW)和腎臟濕重(kidney weight,KW),計算其占體重比值。取部分腎臟用10%甲醛固定,用于PAS和Masson染色。其余凍存于-80℃冰箱備用。
2.2 血清和尿液指標檢測 酶比色法測血清TC、TG和空腹血糖(fasting blood glucose,FBG)含量,放射免疫法測血清空腹胰島素(fasting insulin,FIns)水平,計算穩態胰島素評價指數(homeostatic model assessment of insulin resistance,HOMA -IR)=[FBG(mmol/L)× FIns(mU/L)/22.5][10]。除蛋白法測血清和尿肌酐含量,并計算肌酐清除率(creatinine clearance,Ccr)=[尿肌酐(μmol/L)×24 h尿量(mL)/血肌酐(μmol/L)]×[1000/BW(g)]×[1/1440(min)][11]。Bradford 法測尿蛋白含量,計算尿蛋白排泄率(urinary protein excretion,UPE)。放射免疫法測尿白蛋白水平,并計算尿白蛋白排泄率(urinary albumin excretion,UAE)。電極法測定尿鈉含量,并計算尿鈉排泄率(urinary sodium excretion,USE)。
2.3 腎組織生化指標檢測 將腎組織剪碎后置于勻漿器,加入RIPA裂解液和混合蛋白酶抑制劑,反復碾碎組織,4℃ 12000×g離心15 min,取上清用Bradford法測蛋白濃度。采用比色法測腎勻漿TAOC和抗超氧陰離子能力、MDA含量以及SOD、CAT和GPX活性。
2.4 Western blotting 檢測腎臟 p47phox、p22phox和 Cu/Zn-SOD蛋白表達 以80 μg蛋白/泳道上樣,經SDS-PAGE凝膠電泳后,電轉膜至NC膜,室溫封閉2 h。洗膜后分別加入Ⅰ抗(p47phox1∶800,p22phox1∶500,Cu/Zn -SOD 1∶1000,β -actin 1∶500 稀釋)4℃孵育過夜。洗膜后Ⅱ抗37℃孵育1.5 h。ECL化學發光法顯色,拍攝照片。根據積分吸光度(integrated absorbance,IA)值對比分析條帶強弱,以βactin為內參照進行半定量分析。
2.5 腎臟病理檢查 切片常規脫蠟脫水,PAS和Masson染色后光鏡觀察腎小球硬化(glomerulosclerosis,GS)和腎小管間質損傷(tubulointerstitial injury,TI)。TI判斷標準包括:皮質區腎間質纖維化、炎癥細胞浸潤和腎小管擴張或萎縮。采用盲法半定量評估 GS 和 TI程度,評分標準如下[12,13]:0 分,正常;1分,病變面積<25%;2分,面積26% ~50%;3分,面積51% ~75%;4分,面積>76%。每張切片至少觀察50個腎小球(×400)和皮質區視野(×100),并計算其評分平均值。
3 統計學處理
結 果
1 兩組大鼠一般狀況的比較
入選分組時兩組大鼠BW無明顯差別[(267.1±10.5)g vs(269.5 ±14.6)g,P >0.05]。20 周時,MS大鼠BW、VFW、VFW/BW和KW較正常大鼠明顯增高(P<0.05)。MS大鼠KW/BW與正常大鼠無顯著差異(P>0.05),見表1。
入選分組時兩組大鼠SBP無明顯差別[(120.2±8.9)mmHg vs(118.8 ±8.4)mmHg,P >0.05]。8周時MS大鼠SBP升高[(139.6±9.3)mmHg vs(125.9±8.2)mmHg,P<0.05]。20周時 MS大鼠SBP[(149.4±9.4)mmHg]明顯高于正常大鼠[(119.3 ±8.6)mmHg,P <0.05],見圖1。
表1 兩組大鼠一般狀況的比較Table 1.Comparison of physiological parameters in the two groups(.n=10)
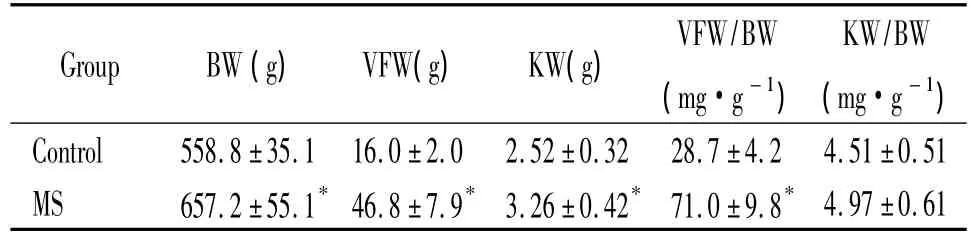
表1 兩組大鼠一般狀況的比較Table 1.Comparison of physiological parameters in the two groups(.n=10)
*P <0.05 vs control group.
Group BW(g) VFW(g) KW(g)VFW/BW(mg·g-1)KW/BW(mg·g-1)Control 558.8 ±35.1 16.0±2.0 2.52 ±0.32 28.7±4.2 4.51±0.51 MS 657.2 ±55.1*46.8±7.9* 3.26 ±0.42* 71.0±9.8*4.97±0.61
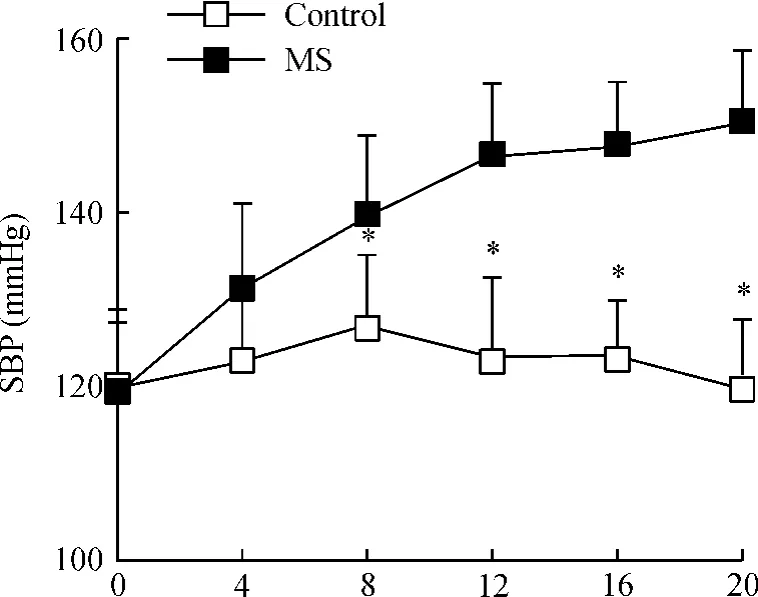
Figure 1.Comparison of SBP in the two groups..n=10.*P<0.05 vs MS group.圖1 兩組大鼠SBP的比較
2 兩組大鼠血脂、血糖、胰島素水平和穩態胰島素評價指數的比較
MS大鼠TC和TG明顯高于正常大鼠(P<0.05)。兩組大鼠血清FBG無明顯差別(P>0.05)。MS大鼠血清FIns水平和HOMA-IR較正常大鼠顯著增高(P<0.05),見表2。
表2 兩組大鼠TC、TG、FBG、FIns和HOMA-IR的比較Table 2.Comparison of TC,TG,FBG,FIns and HOMA-IR in the two groups(.n=10)

表2 兩組大鼠TC、TG、FBG、FIns和HOMA-IR的比較Table 2.Comparison of TC,TG,FBG,FIns and HOMA-IR in the two groups(.n=10)
*P <0.05 vs control group.
Group TC(mmol·L-1)TG(mmol·L-1)FBG(mmol·L-1)FIns(mU·L-1)HOMA-IR Control 1.42 ±0.65 0.88±0.29 5.33 ±0.49 38.7±22.1±7.19.9 9.2±2.4 MS 2.50 ±0.70*1.48±0.41*5.99 ±0.95 82.3±14.9*
3 兩組大鼠尿鈉、蛋白和白蛋白排泄率及肌酐清除率的比較
兩組大鼠UPE和Ccr無顯著差異(P>0.05)。MS大鼠 USE和UAE較正常大鼠明顯增高(P<0.05),見表 3。
4 兩組大鼠腎臟T-AOC、ISAC和MDA含量的比較
MS大鼠腎臟T-AOC和ISAC較正常大鼠顯著降低(P<0.05),MDA含量顯著增加(P<0.05),見表4。
表3 兩組大鼠USE、UPE、UAE和Ccr的比較Table 3.Comparison of USE,UPE,UAE and Ccr in the two groups(.n=10)

表3 兩組大鼠USE、UPE、UAE和Ccr的比較Table 3.Comparison of USE,UPE,UAE and Ccr in the two groups(.n=10)
*P <0.05 vs control group.
Control 1.1 ±0.4 7.0 ±2.4 13.3±3.7 2.55 ±0.92 MS 15.1±2.5* 11.2±6.0 39.5±9.5*1)2.77 ±0.84
5 兩組大鼠腎臟抗氧化酶活性的比較
MS大鼠腎臟SOD活性顯著低于正常大鼠(P<0.05),GPx和 CAT活性兩組間無顯著差異(P>0.05),見表 4。
6 兩組大鼠腎臟 p47phox、p22phox和 Cu/Zn-SOD蛋白表達的比較
MS大鼠腎臟p47phox蛋白表達(0.63±0.11)較正常大鼠顯著增高(0.34±0.08,P<0.05),Cu/Zn-SOD蛋白表達(0.50±0.07)較正常大鼠顯著降低(0.83±0.12,P<0.05)。兩組大鼠 p22phox蛋白表達無明顯差別(0.31±0.08 vs 0.21±0.05,P>0.05),見圖2。
表4 2組大鼠腎臟T-AOC、ISAC、MDA含量和抗氧化酶活性的比較Table 4.Comparison of renal T-AOC,ISAC,MDA level and antioxidant enzyme activities in the two groups(.n=10)

表4 2組大鼠腎臟T-AOC、ISAC、MDA含量和抗氧化酶活性的比較Table 4.Comparison of renal T-AOC,ISAC,MDA level and antioxidant enzyme activities in the two groups(.n=10)
*P <0.05 vs control group.
Group T-AOC(103U·g-1protein)ISAC(103U·g-1protein)MDA(μmol·g-1protein)SOD(103U·g-1protein)GPX(103U·g-1rotein)CAT(103U·g-1protein)Control 4.99 ±1.40 101.2 ±15.9 4.87 ±0.68 150.9 ±31.3 24.1 ±6.4 20.9 ±2.5 MS 2.48 ±0.45* 69.9 ±11.5* 7.74 ±1.51* 92.5 ±19.7*21.9 ±5.8 21.4 ±2.6
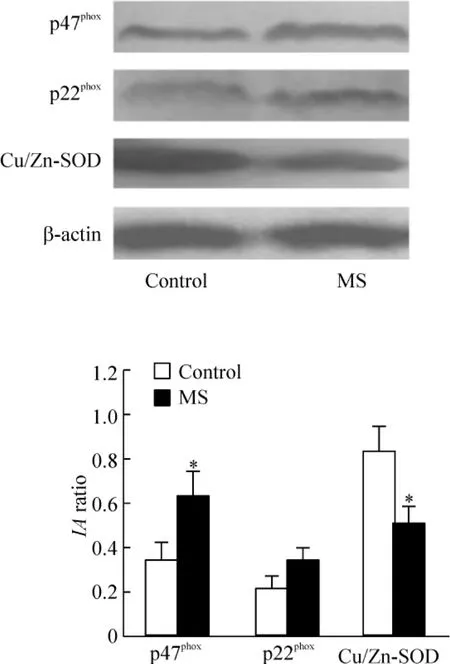
Figure 2.Renal protein expression of p47phox,p22phoxand Cu/Zn -SOD in the two groups.Representative bands and integrated absorbance(IA)normalized to the corresponding βactin were shown..n=4.*P <0.05 vs control group.圖2 兩組大鼠腎臟p47phox、p22phox和Cu/Zn-SOD蛋白表達的比較
7 兩組大鼠腎臟組織形態學比較
MS大鼠腎臟腎小球基底膜增厚,系膜細胞增生,基質增多,GS評分(1.10±0.25)較正常大鼠(0.18±0.07)明顯升高(P<0.05)。MS大鼠未見明顯腎間質纖維化、炎癥細胞浸潤和腎小管擴張或萎縮,TI評分兩組間無顯著差異,見圖3。
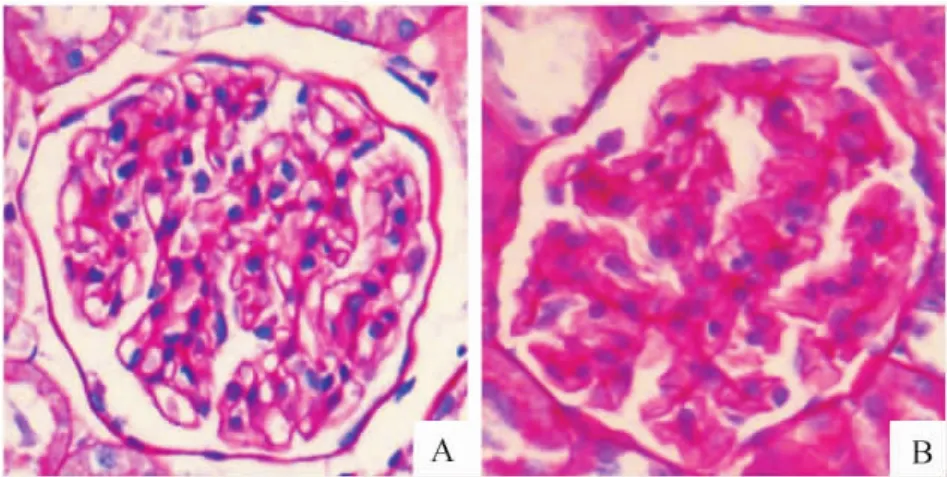
Figure 3.Representative micrographs of the kidneys in control(A)and MS(B)rats(PAS staining,×400).圖3 PAS染色觀察兩組大鼠腎臟組織形態改變
討 論
本實驗結果顯示,予以HFS飼料和高糖飲水20周后,SD大鼠體重、內臟脂肪重量、血脂、血壓明顯增高,且伴有顯著胰島素抵抗,說明MS模型制備成功。進一步觀察發現,大鼠腎臟濕重、UAE和GS評分亦顯著升高,UPE、Ccr和腎臟濕重占體重比值有增高趨勢,TI評分無顯著變化,提示MS大鼠伴有早期的腎臟功能和結構損傷。
氧化應激是指機體在遭受各種有害刺激時,體內高活性分子如活性氧簇(reactive oxygen species,ROS)等產生過多,氧化系統和抗氧化系統失衡,從而導致組織損傷。ROS主要包括超氧陰離子、羥自由基和過氧化氫等,其中超氧陰離子可與NO結合生成一種極為強大的氧化劑過氧亞硝酸鹽陰離子,導致自由基反應加劇,加重組織損傷[14]。本實驗發現MS大鼠腎臟T-AOC和抗超氧陰離子能力較正常大鼠降低,MDA含量增加,說明ROS在MS腎病大鼠生成明顯增多。進一步研究發現在MS大鼠腎臟,超氧陰離子主要來源之一的NADPH氧化酶亞單位p47phox蛋白表達明顯增加。上述結果提示NADPH氧化酶活化,生成大量超氧陰離子,進而激活各種信號轉導途徑是導致MS大鼠腎臟損傷的可能機制。
機體清除ROS的主要抗氧化酶系統包括SOD、GPx和CAT。SOD主要作用是清除超氧陰離子,GPx和CAT主要清除過氧化氫。文獻報道在各種ROS中,過氧化氫和NO等具有非常重要的信號作用,毒性作用很弱,而羥自由基和超氧陰離子毒性強,是導致細胞氧化損傷的主要介質[15]。本實驗發現MS大鼠腎臟SOD活性和Cu/Zn-SOD蛋白表達較正常大鼠明顯降低,提示超氧陰離子清除減少亦是導致MS大鼠腎臟損傷的可能機制。
綜上所述,長期HFS飲食和高糖飲水喂飼SD大鼠可建立具有大部分臨床特征的MS腎病大鼠模型。NADPH氧化酶表達增高和SOD表達減少而引起的氧化應激狀態在MS大鼠腎臟損傷的發生發展中起一定作用。
[1]Eckel RH,Grundy SM,Zimmet PZ.The metabolic syndrome[J].Lancet,2005,365(9468):1415 - 1428.
[2]Kurella M,Lo JC,Chertow GM.Metabolic syndrome and the risk for chronic kidney disease among nondiabetic adults[J].J Am Soc Nephrol,2005,16(7):2134 - 2140.
[3]周 勇,楊解人.芝麻素對高脂、高糖飼養大鼠血脂、血糖及血管重構的影響[J].中國病理生理雜志,2008,24(7):1286 - 1291.
[4]Altunkaynak ME,Ozbek E,Altunkaynak BZ,et al.The effects of high-fat diet on the renal structure and morphometric parametric of kidneys in rats[J].J Anat,2008,212(6):845 - 852.
[5]Andrews P,Karadaghi PA,Memon S,et al.No effect of high sucrose diets on the kidneys of Wister Kyoto(WKY)rats[J].Geriatr Nephrol Urol,1992,2(1):35 - 42.
[6]Ogihara T,Asano T,Ando K,et al.Insulin resistance with enhanced insulin signaling in high-salt diet-fed rats[J].Diabetes,2001,50(3):573 - 583.
[7]吳向起,楊解人.芝麻素的抗氧化作用及其對代謝綜合征大鼠腎病的影響[J].中國藥理學通報,2008,24(8):1065 -1069.
[8]Kong X,Zhang DY,Wu HB,et al.Losartan and pioglitazone ameliorate nephropathy in experimental metabolic syndrome rats[J].Biol Pharm Bull,2011,34(5):693-699.
[9]Kong X,Yang JR,Guo LQ,et al.Sesamin improves endothelial dysfunction in renovascular hypertensive rats fed with a high-fat,high-sucrose diet[J].Eur J Pharmacol,2009,620(1 - 3):84 - 89.
[10]Matthews DR,Hosker JP,Rudenski AS,et al.Homeostasis model assessment:insulin resistance and β-cell function from fasting glucose and insulin concentrations in man[J].Diabetologia,1985,28(7):412 - 419.
[11]Yokozawa T,Yamabe N,Kim HY,et al.Protective effects of morroniside isolated from corni fructus against renal damage in streptozotocin - induced diabetic rats[J].Biol Pharm Bull,2008,31(7):1422 - 1428.
[12]Qin J,Zhang Z,Liu J,et al.Effects of the combination of an angiotensin II antagonist with an HMG-CoA reductase inhibitor in experimental diabetes [J].Kidney Int,2003,64(2):565 - 571.
[13]Namikoshi T,Tomita N,Satoh M,et al.Pioglitazone enhances the antihypertensive and renoprotective effects of candesartan in zucker obese rats fed a high-protein Diet[J].Hypertens Res,2008,31(4):745 - 755.
[14]郭莉群,楊解人,孔 祥.芝麻素對代謝綜合征性脂肪肝大鼠肝組織iNOS和NT表達的影響[J].中國病理生理雜志,2010,26(2):337-340.
[15]Roberts CK,Barnard RJ,Sindhu RK,et al.Oxidative stress and dysregulation of NAD(P)H oxidase and antioxidant enzymes in diet- induced metabolic syndrome[J].Metabolism,2006,55(7):928 - 934.

