清胰湯對L-精氨酸誘發的重癥急性胰腺炎小鼠胰腺p-STAT3 表達的影響*
張曉芹, 賈曉云, 李 濤, 李保蘭, 史迎莉, 張 紅△
(1 陜西中醫學院基礎醫學院 病理生理學教研室,陜西 咸陽712046;2 敦化市醫院病理科,吉林 敦化133700)
重癥急性胰腺炎(severe acute pancreatitis,SAP)是一種危重疾病,病死率可高達20% ~30%。近年來的研究提示:細胞因子和炎癥介質在SAP 發生、發展中起著重要作用[1],尤其是白細胞介素6(interleukin-6,IL-6)在輕癥急性胰腺炎和重癥急性胰腺炎患者血清水平存在明顯差異,因此,IL -6 的血清水平已經作為反映SAP 嚴重程度的重要指標[2,3]。近來研究顯示IL-6 等細胞因子通過誘發其下游信號轉導和轉錄激活因子3(signal transducer and activator of transcription 3,STAT3)的活化促進炎癥的進一步發展[4]。而急性胰腺炎時STAT3 通路是否活化、抑制STAT3 活化是否可以有效減輕急性胰腺炎的炎癥損傷值得深入研究。
腹腔內注射大劑量L-精氨酸(L-arginine,LArg)是近年來開始使用的一種小鼠急性胰腺炎造膜方法,此法所誘導模型胰腺病變的程度在不同部位比較一致,與人類急性胰腺炎的病程及組織學改變相似,是研究急性胰腺炎及其防治措施的理想動物模型[5]。本課題采用20% L -Arg 復制小鼠急性胰腺炎模型,觀察急性壞死性胰腺炎模型胰腺STAT3活化程度的變化,及與SAP 進展密切相關的炎癥細胞因子單核細胞趨化蛋白-1[6](monocyte chemoattractant protein-1,MCP -1)的變化,并觀察清胰湯(Qingyi decoction,QYD)對急性壞死性胰腺炎小鼠胰腺STAT3 活性的影響及對胰腺、肺損傷的治療作用,從而探討STAT3 在急性胰腺炎中的作用和清胰湯治療SAP 的分子機制。為早期預測SAP 提供有臨床價值的指標,為清胰湯用于臨床治療急性胰腺炎提供理論依據。
材 料 和 方 法
1 動物
健康昆明小鼠(雄性)30 只,6 ~8 周齡,體重18~25 g,購自第四軍醫大學實驗動物中心(合格證書號0001442),各組小鼠分籠飼養,術前12 h 禁食,不禁水,室溫飼養。
2 藥品、試劑和儀器
L-Arg 購于Sigma -Aldrich(A8094);清胰湯由柴胡15 g、黃芩10 g、黃連10 g、白芍15 g、木香10 g、芒硝10 g、生大黃15 g(后下)組成,加水煎煮濃縮成85 mL(1.0 kg 生藥/L),分裝后置4 ℃保存備用。兔抗小鼠STAT3 單克隆抗體購于Santa Cruz(sc -21876 -R);HRP 標記的羊抗兔IgG 購于博士德試劑公司(BA1054);兔抗小鼠β-actin 單克隆抗體購于博奧森公司(bs-0061R);ECL 發光試劑盒購于博士德試劑公司(AR1170);淀粉酶試劑盒購于南京建成生物研究所;RNA 提取試劑、反轉錄及實時熒光定量PCR 試劑為天根公司產品;其它為當地試劑公司提供的分析純化學試劑;酶標儀(Bio-Tek ELX808IU);Western blotting 電泳轉膜及凝膠成像分析系統(Bio -Rad);7300型熒光定量PCR 儀(ABI)。
3 動物分組及造模
健康雄性昆明小鼠30 只(6 ~8 周齡,體重18 ~25 g),隨機分為3 組(n=10):對照組(control);模型組(SAP);清胰湯組(SAP +QYD)。除對照組外,模型組和清胰湯治療組給予腹腔注射20% L -Arg[5](3 g/kg,間隔1 h 再注射1 次);清胰湯治療組在第2 次腹腔注射20% L -Arg 30 min 后給予清胰湯濃縮液灌胃(10 mL/kg),之后每天灌胃2 次。
4 標本采集與檢測
造模后72 h 麻醉處死動物,經下腔靜脈取血,分離血清;完整摘除胰腺、稱重,將一部分胰腺置于10%甲醛溶液浸泡固定,另一部分胰腺迅速置入液氮中,再轉入-80 ℃冰箱,待提取蛋白行Western blotting 或提取RNA 行real - time PCR 檢測。開胸取左肺組織,于10%甲醛溶液浸泡固定,右肺迅速置入液氮中,再轉入-80 ℃冰箱,待測髓過氧化物酶(myeloperoxidase,MPO)的活性。
4.1 胰腺和肺組織的病理學變化 一部分胰腺及左肺組織經脫水、石蠟包埋、切片,進行HE 染色觀察胰腺及肺病理學改變。
4.2 血清淀粉酶檢測 采用化學比色法檢測血清淀粉酶的活性。
4.3 記算胰腺濕重比 胰腺濕重比= 胰腺重量(g)/體重(g)。
4.4 肺組織MPO 檢測 取整個右肺,加緩沖液制成肺組織勻漿,10 000 r/min 4 ℃離心10 min,提取上清液,加入鄰聯茴香胺,雙氧水反應,分光光度計470 nm 波長下掃描,記錄第30 s 和第90 s 的吸光度差值,以評價肺組織中性粒細胞浸潤程度。
4.5 Western blotting 檢測胰腺p -STAT3 的表達變化 取胰腺組織50 mg,加蛋白裂解液400 μL 勻漿,冰上放置30 min,10 000 r/min 4 ℃離心10 min,提取上清液,采用BCA 法進行蛋白定量后,用5 ×loading buffer 將樣品稀釋至4 g/L;以分子量18 ~94 kD 的marker 為參照,SDS - PAGE 膠蛋白電泳,電轉移至PVDF 膜,封閉液(5%脫脂奶粉)中緩慢搖蕩1 h ,用TBST 洗脫,滴加Ⅰ抗[分別為β - actin(1 ∶2 000);p-STAT3(1∶500)]至PVDF 膜,4 ℃搖床上孵育過夜。TBST 漂洗3 次,每次5 min。HRP 標記的羊抗兔IgG Ⅱ抗(1∶1 000 稀釋),室溫孵育1 h。TBST 漂洗3 次,每次10 min。ECL 滴加于PVDF 膜上,在暗盒中將X 光片曝光,顯影、定影后,根據marker,進行掃描。圖像經GelDoc XR 軟件進行吸光度值分析,并與內參照β -actin 比較,以相對吸光度值代表蛋白表達量。
4.6 實時熒光定量PCR(real-time PCR)法檢測胰腺MCP-1 mRNA 的表達變化 應用PrimerExpress軟件(PE Biosystems)設計基因特異性PCR 引物序列,MCP-1 上游引物為5' -GTTGGCTCAGCCAGATGCA -3',下游引物5' - AGCGTACTCATTGGGATCATCTTG -3';β -actin 上游引物為5' -CATCCTGCGTCTGGACCT - 3',下游引物5' - TCAGGAGGAGCAATGATCTTG-3'。按試劑的操作步驟提取胰腺組織中總RNA、逆轉錄成cDNA。以cDNA 為模板進行PCR,反應條件(20 μL 體系):SYBR Green Mix 9 μL,cDNA(20 mg/L)4 μL,上、下游引物(10 μmol/L)各0.5 μL,H2O 6 μL。擴增條件:預熱50℃2 min,預變性95 ℃10 min,95 ℃15 s,60 ℃30 s,72 ℃30 s,共40 個循環;以ΔCt 值表示目的基因MCP-1 相對表達量。
5 統計學處理
結 果
1 胰腺和肺組織的病理學變化
如圖1 所示,對照組小鼠胰腺及肺組織光鏡下未見病變;SAP 72 h 組胰腺腺泡細胞腫脹,可見多處不同程度片狀壞死,間質有大量炎癥細胞浸潤及出血。肺組織表現為肺泡間隔水腫、增寬,大量炎癥細胞浸潤;清胰湯治療組胰腺和肺組織病變明顯減輕,主要表現為胰腺腺泡輕度腫脹,間質小血管擴張、充血,有少量炎癥細胞浸潤。肺泡間隔輕度水腫、增寬,僅見少量炎癥細胞浸潤。
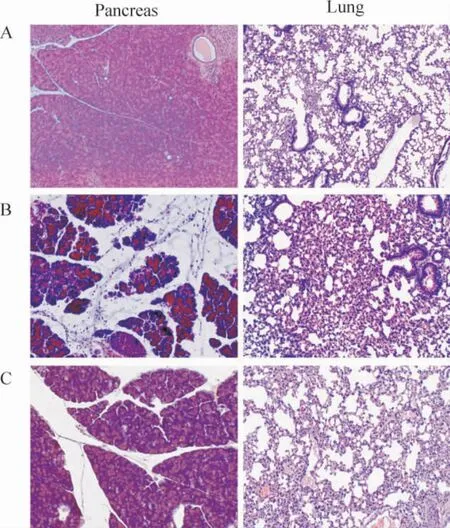
Figure 1. The effect of Qingyi decoction(QYD)on the pancreatic and lung morphology of mice with severe acute pancreatitis (ASP)at 72 h. A:control group;B:SAP group;C:SAP+QYD group.圖1 各組胰腺和肺組織的病理學變化
2 血清淀粉酶活性變化
如圖2 所示,SAP 誘發后,各組血清淀粉酶活性升高,與對照組相比較差異顯著(P <0.01);而清胰湯治療組淀粉酶的活性明顯降低,與SAP 組相比差異顯著(P <0.05)。
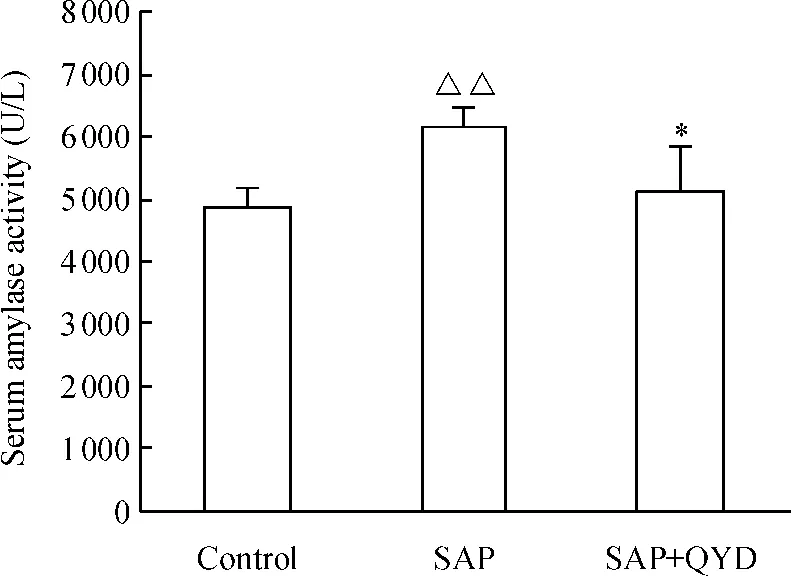
Figure 2. The effect of QYD on the amylase activity in serum of mice with acute pancreatitis. ±s.n=10. △△P <0.01 vs control group;* P <0.05 vs SAP group.圖2 各組血清淀粉酶活性變化
3 胰腺濕重比變化
如圖3 所示,SAP 誘發后,胰腺濕重比增加,與對照組相比較,差異顯著(P <0.05);清胰湯治療組胰腺濕重比降低,與SAP 組相比,顯著差異(P <0.05)。
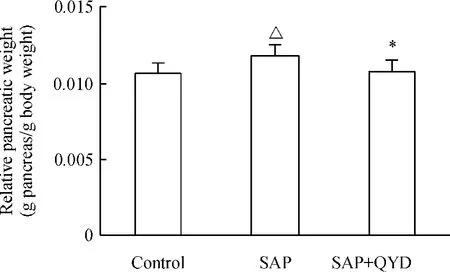
Figure 3. The effect of QYD on the relative pancreatic weight of mice with acute pancreatitis. ±s.n=10. △P <0.05 vs control group;* P <0.05 vs SAP group.圖3 各組胰腺濕重比變化
4 肺組織MPO 變化
如圖4 所示,SAP 誘發后,肺組織勻漿MPO 水平明顯升高,與對照組相比,差異顯著(P <0.01);清胰湯治療組MPO 水平明顯降低,與SAP 組相比,差異顯著(P <0.01)。
5 胰腺p-STAT3 的表達變化
如圖5 所示,對照組小鼠胰腺未見p -STAT3 的活性表達;SAP 組小鼠在胰腺炎誘發后72 h 胰腺p-STAT3 的活性表達明顯增強;而清胰湯治療組72 h胰腺p-STAT3 的活性表達明顯少于SAP 組(n =3,P <0.01)。
6 胰腺組織MCP-1 mRNA 的表達變化
如圖6 所示,SAP 誘發72 h,胰腺MCP -1 mRNA 的表達明顯升高,與對照組相比較,差異顯著(P <0.01);而清胰湯治療組胰腺MCP-1 mRNA 的表達明顯降低,與SAP 組相比差異顯著(P <0.05)。
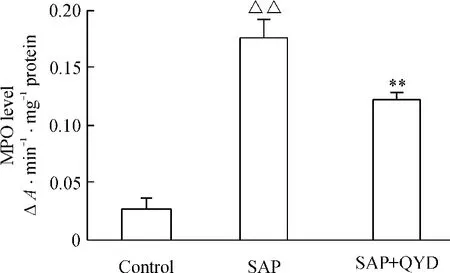
Figure 4. The effect of QYD on the MPO level in lung of mice with acute pancreatitis. ±s. n =10. △△P <0.01 vs control group;**P <0.01 vs SAP group.圖4 各組肺組織MPO 水平變化

Figure 5. Expression of p-STAT3 protein in pancreas following the development of acute pancreatitis. Pancreas protein extracts (20 μg)at the indicated time point (72 h)were analyzed by Western blotting using antibody against p-STAT3 and β -actin. ±s. n =3. △△P <0.01 vs control group;**P <0.01 vs SAP group.圖5 各組p-STAT3 蛋白表達比較
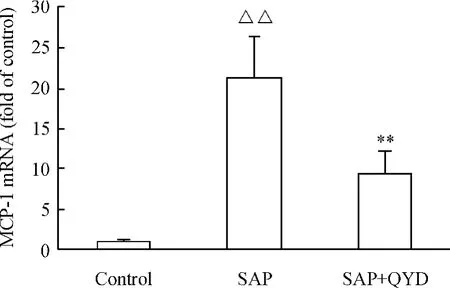
Figure 6. The effect of QYD on the MCP -1 mRNA expression in pancreas of mice with acute pancreatitis. The total RNA in pancreas was abstracted and reversibly transcribed into cDNA. The cDNA was further analyzed by real-time PCR. ΔCt was used to calculate the level of MCP -1 mRNA. ±s.n =10. △△P <0.01 vs control group;**P <0.01 vs SAP group.圖6 各組胰腺組織MCP-1 mRNA 表達變化
討 論
腹腔內注射大劑量L -Arg 復制小鼠急性胰腺炎,是研究急性胰腺炎及防治措施較為理想的動物模型。我們曾給小鼠腹腔注射不同劑量(2 g/kg、3 g/kg、4 g/kg)的20% L -Arg,發現小鼠死亡率及造模的成功率與劑量明顯相關。采用20% L -Arg 以2 g/kg 的劑量給小鼠進行腹腔注射,發現72 h 模型的成功率僅為60%,而4 g/kg 的劑量造膜后72 h 小鼠的死亡率超過了40%。因此我們選用了20% LArg 以3 g/kg 的劑量造模,72 h 后模型組動物可見胰腺腺泡細胞腫脹,及多處片狀壞死,間質有大量炎癥細胞浸潤及出血;肺組織表現為肺泡間隔水腫、增寬,大量炎癥細胞浸潤;血漿淀粉酶活性、胰腺重量、肺組織勻漿MPO 水平明顯增加,提示腹腔內注射大劑量L- Arg(3 g/kg)成功復制了小鼠急性胰腺炎模型。此法操作簡便,成本低,重復性好,病變的程度在不同胰腺部位比較一致,克服了其它模型需行剖腹術等缺點,再次證明L -Arg 腹腔注射是復制急性胰腺炎較為理想的方法[5]。
STAT3 是一種多功能的轉錄因子,廣泛表達于多種類型的細胞和組織中,可被JAKs(Janus kinases)通過酪氨酸磷酸化激活成為p - STAT3,p -STAT3 表達水平是STAT3 活化程度的指征[7]。對結腸炎的信號通路研究發現[8],過度生成的IL -6 首先與IL -6 受體結合,引發JAKs 磷酸化活化,繼而導致其下游的STAT3 磷酸化,磷酸化的STAT3(p -STAT3)分子形成二聚體,進入細胞核與特異的DNA序列結合,調節下游相關靶基因如炎癥細胞因子的轉錄和表達。而采用caerulein 聯合脂多糖誘發的小鼠SAP 模型[9]也發現:胰腺中STAT3 表達明顯增強,而IL-6 中和抗體可以抑制胰腺STAT3 的活化、減輕SAP 的損傷,提示胰腺STAT3 的活化可能與胰腺炎的病變程度存在著一定的因果關系。但是STAT3 在AP 發展中的作用尚不清楚。本課題采用20% L-Arg 復制小鼠急性胰腺炎模型,觀察SAP 模型胰腺STAT3 活化程度的變化,發現20% L - Arg注射后72 h,胰腺和肺組織可見明顯的病理損傷,胰腺p-STAT3 表達明顯增強,炎性細胞因子MCP -1 mRNA 表達增多,提示胰腺STAT3 活化可能參與SAP 的重癥化。由于在SAP 的動物實驗和臨床研究中均發現MCP-1 上調,MCP-1 在急性胰腺炎的炎癥損傷尤其在急性胰腺炎并發肺損傷的發病機制中起著重要的作用[10]。本實驗結果提示STAT3 活化后進入細胞核可能與特異性的DNA 序列結合,促進其下游MCP-1 基因的轉錄和表達。
清胰湯是大承氣湯的加減方,其功效主要為通里攻下,活血化瘀,在臨床上已廣泛應用于急性胰腺炎。研究發現,清胰湯除了能促使腸道功能恢復外,同時可以阻止炎癥介質IL-6 的釋放[11]。清胰湯是否對IL-6 下游的STAT3 有抑制作用及其機制尚不清楚。我們采用清胰湯對L -精氨酸所誘發的SAP小鼠進行治療發現:清胰湯治療組p-STAT3 的表達明顯減少,提示清胰湯可以抑制胰腺STAT3 的活化。另外清胰湯治療組的胰腺重量、血清淀粉酶活性、MPO 水平明顯降低,胰腺、肺組織學損傷程度明顯減輕,胰腺MCP-1 mRNA 的表達明顯減少,提示抑制STAT3 的活化可以減輕AP 的胰腺、肺的炎癥性損傷。本研究結果為SAP 的治療提供有價值的靶點,并為闡明清胰湯治療急性胰腺炎的作用和機制提供理論依據。
[1] Mayer J,Rau B,Gansauge F,et al. Inflammatory mediators in human acute pancreatitis:clinical and pathophysiological implications[J]. Gut,2000,47(4):546 -552.
[2] ?timac D,Fi?i E,Mili S,et al. Prognostic values of IL-6,IL-8,and IL-10 in acute pancreatitis[J]. J Clin Gastroenterol,2006,40(3):209 -212.
[3] 張曉云,汪東劍,余維濤.血清IL -6、IL -8 和TNF -α在重癥急性胰腺炎早期診斷中的臨床意義[J].胰腺病學,2004,4(1):26 -28.
[4] Atreya R ,Mudter J ,Finotto S ,et al . Blockade of interleukin 6 trans -signaling suppresses T -cell resistance against apoptosis in chronic intestinal inflammation:evidence in crohn disease and experimental colitis in vivo[J]. Nat Med,2000,6(5):583 -588.
[5] 劉君君,陳 墾,龍友明,等. L -精氨酸誘導大鼠急性壞死性胰腺炎模型的建立[J].中國藥理學通報,2009,25(10):1392 -1394.
[6] 林旭紅,李永渝. 急性胰腺炎發病機制及相關治療的研究進展[J]. 中國病理生理雜志,2010,26(5):1029-1032,1040.
[7] 鐘敦璟,郭 紅,郝 嘉,等. STAT3 對大鼠重癥急性胰腺炎血清體外作用AT -II SP -C 的影響[J]. 第三軍醫大學學報,2008,30(19):1807 -1809.
[8] Mitsuyama K,Sata M,Rose-John S. Interleukin-6 trans-signaling in inflammatory bowel disease[J]. Cytokine Growth Factor Rev,2006,17(6):451 -461.
[9] Chao KC,Chao KF,Chuang CC,et al. Blockade of interleukin 6 accelerate acinar cell apoptosis and attenuates experimental acute pancreatitis in vivo[J]. Br J Surg,2006,93(3):332 -338.
[10] Zhou GX,Zhu XJ,Ding XL,et al. Protective effects of MCP-1 inhibitor on a rat model of severe acute pancreatitis[J].Hepatobiliary Pancreat Dis Int,2010,9(2):201-207.
[11] 聞慶平,陳海龍,關風林.清胰湯對大鼠重癥急性胰腺炎時急性肺損傷治療作用的觀察[J].中國中西醫結合外科雜志,2003,9(4):302 -306.

