利多卡因對SH-SY5Y 細胞的損傷作用*
文先杰, 徐世元, 雷洪伊, 梁 樺, 鄭雪琴, 楊承祥
(1 南方醫科大學珠江醫院麻醉科,廣東 廣州510282;2 佛山市第一人民醫院麻醉科,廣東 佛山528000)
局麻藥在臨床常用濃度下也可導致神經細胞毒性損傷,表現為神經細胞的腫脹、退行性變,神經脫髓鞘、空泡癥、染色體溶解、細胞程序性死亡等。暫時性神經病學綜合征(transient neurological syndrome,TNS)和馬尾綜合征是臨床上常見局麻藥神經毒性反應[1]。SH-SY5Y 細胞株來源于人神經母細胞瘤,該細胞繁殖快,細胞形態、生理和系列化功能與正常神經細胞相似,因此該細胞是進行人類神經細胞研究較為理想的一種細胞模型[2]。本研究在SH-SY5Y 細胞體外培養的基礎上,采用MTT 法和流式細胞儀技術,觀察了不同濃度利多卡因對SH-SY5Y 細胞活力及細胞凋亡的影響,初步探討利多卡因的神經毒性損傷作用。
材 料 和 方 法
1 材料
鹽酸利多卡因標準品購自中國食品藥品檢定研究院,噻唑藍(MTT)購自中國醫藥(集團)上海公司,Annexin V-FITC 細胞凋亡檢測試劑盒購自BIPEC,SH-SY5Y 細胞株(中國科學院上海生命科學研究院細胞資源中心)。主要儀器包括全自動酶標儀(雷勃公司),分光光度計(GBC),流式細胞儀(BD)等。
2 方法
2.1 SH-SY5Y 細胞培養 將細胞培養于DMEM 培養液內(含有4.0 mmol/L 谷氨酰胺、4.5 g/L 的葡萄糖、100 mg/L 鏈霉素和100 U/L 青霉素),置于37 ℃、5%CO2培養箱中培養,待細胞生長至約90%時用于實驗。
2.2 實驗分組與處理 實驗分為4 組,即:正常培養組(對照組,未經藥物處理);0.5%、1%、2%利多卡因組(L1、L2、L3 組,相當于18.5 mmol/L、37 mmol/L、74 mmol/L 利多卡因處理細胞):分別用相應濃度的利多卡因處理SH-SY5Y 細胞10 min。
2.3 觀察指標
①SH-SY5Y 細胞形態學觀察 藥物處理10 min 后,在可見光顯微鏡下觀察細胞形態,評價細胞受損情況。
②MTT 法檢測SH-SY5Y 細胞相對活力 分別在藥物處理后5 min(T1)、10 min(T2)、藥物處理結束后15 min(T3)、藥物處理結束后12 h(T4)將細胞接種于96 孔板中,每組設6個復孔。細胞濃度為5 ×105cells/well,每孔加入MTT 溶液(5 g/L)10 μL,37 ℃繼續孵育4 h,終止培養,吸去孔內培養液,每孔加入DMSO 150 μL,振蕩10 min 使結晶充分溶解,于酶標儀檢測A570及A630值,計算A570與A630差值,并以正常培養組的差值1,其它各時點差值與其比值(%)為反映細胞活力的參數。
③細胞凋亡檢測 分別在藥物處理開始前(T0)、藥物處理后5 min(T1)、10 min(T2)、藥物處理結束后15 min(T3)、藥物處理結束后12 h(T4)將各組細胞制成單細胞懸液,調整細胞懸液濃度為5 ×108cells/well,接種于96 孔培養板,每孔加入細胞懸液100 μL ,培養箱中繼續培養4 h 時后檢測細胞凋亡率。取SH-SY5Y 細胞,置于離心管中,以離心半徑10 cm、1 500 r/min 離心5 min,收集懸浮細胞。PBS 洗滌細胞2次后,以離心半徑10 cm、1 500 r/min 離心5 min,然后收集細胞。用400 μL 1 ×結合緩沖液重懸細胞。將細胞懸液移至樣品試管中,加入5 μL Annexin V-FITC,輕輕混勻后于避光條件下室溫24 ℃孵育15 min。加入碘化丙啶10 μL,使終濃度為50 mg/L,染色5 min,24 ℃避光30 min 后,使用流式細胞儀檢測細胞凋亡情況,計算細胞凋亡率。每組設6 個復孔,每孔重復測定3 次,取平均值。
3 統計學處理
采用SPSS 11.0 統計軟件進行分析,計量資料以均數±標準差(±s)表示,組內比較采用重復測量設計的方差分析,組間比較采用單因素方差分析。
結 果
1 細胞形態改變
倒置顯微鏡下見正常培養SH-SY5Y 細胞胞體粗大,呈多角形,出現樹突狀突起,神經突起,多而粗大,分布成網絡,表現出一系列神經元的特征。實驗組不同濃度的利多卡因處理10 min 后均對SH-SY5Y 細胞形態有明顯影響,細胞變圓,回縮,軸突漸消失,見圖1。
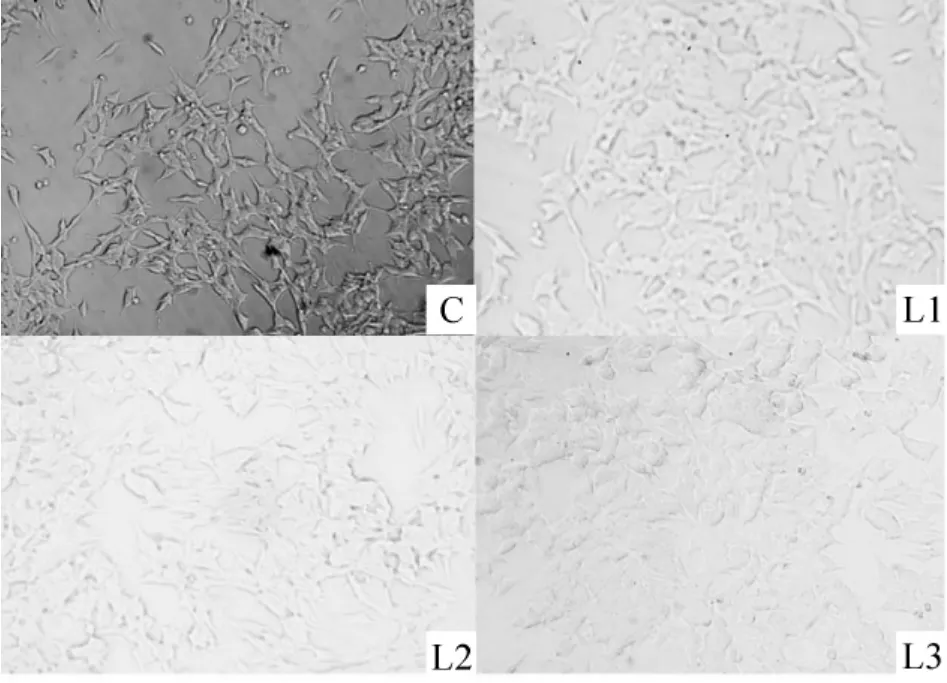
Figure 1. Morphocytology of SH-SY5Y cells (×100). C:SH-SY5Y were cultured under normal conditions;L1:SH-SY5Y were cultured with 0.5% lidocaine for 10 min;L2:SH-SY5Y were cultured with 1% lidocaine for 10 min;L3:SH-SY5Y were cultured with 2% lidocaine for 10 min.圖1 SH-SY5Y 細胞形態
2 細胞活力
各實驗組不同濃度的利多卡因對SH-SY5Y 細胞活力均有明顯影響,利多卡因處理5 min 后,各組細胞活力明顯下降,且隨劑量增加,細胞活力下降明顯增加。2%利多卡因處理5 min 后,細胞活力下降至67%,處理10 min 后,細胞活力則下降為61%,停止利多卡因處理后15 min,細胞活力繼續下降至53%,停止處理后12 h,細胞活力則恢復至65%,見表1。
表1 各組SH-SY5Y 細胞活力的比較Table 1. Cell viability of the SH-SY5Y cells in each group(%. ±s.n=6)
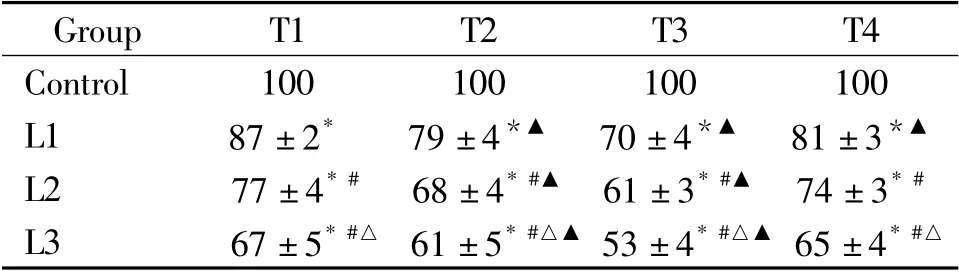
表1 各組SH-SY5Y 細胞活力的比較Table 1. Cell viability of the SH-SY5Y cells in each group(%. ±s.n=6)
T1:treatment for 5 min;T2:treatment for 10 min;T3:15 min after treatment;T4:12 h after treatment. * P <0. 05 vs control group;#P <0.05 vs L1 group;△P <0.05 vs L2 group;▲P <0.05 vs T1 group.
Group T1 T2 T3 T4 Control 100 100 100 100 L1 87 ±2* 79 ±4*▲ 70 ±4*▲ 81 ±3*▲L2 77 ±4* # 68 ±4* #▲ 61 ±3* #▲ 74 ±3* #L3 67 ±5* #△ 61 ±5* #△▲53 ±4* #△▲ 65 ±4* #△
3 細胞凋亡率
對照組細胞凋亡率在各時點保持在5.9% ~6.3%之間,實驗組細胞在利多卡因處理后各時點細胞凋亡率明顯增加,且隨著濃度的增加,細胞凋亡率也增加。2%利多卡因處理5 min、10 min 及停止利多卡因處理后15 min、12 h,細胞凋亡率分別為15.5%、23.0%、22.7%和19.3%,見表2。
表2 各組SH-SY5Y 細胞凋亡率的比較Table 2. Apoptotic rate of the SH-SY5Y cells in each group (%. ±s.n=6)
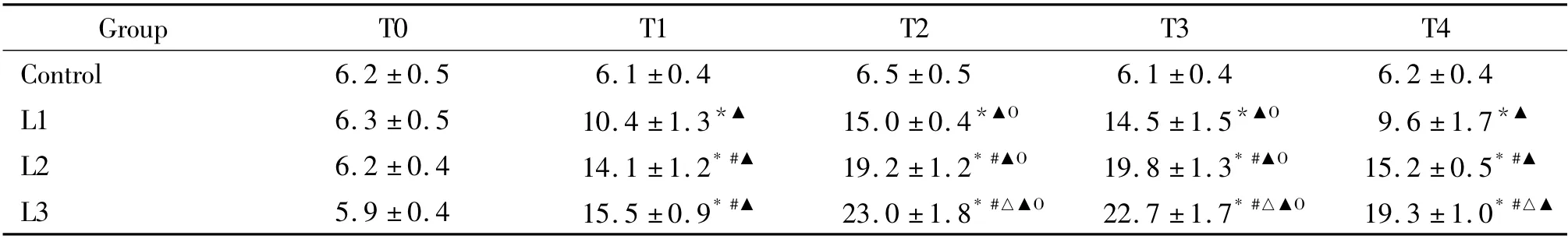
表2 各組SH-SY5Y 細胞凋亡率的比較Table 2. Apoptotic rate of the SH-SY5Y cells in each group (%. ±s.n=6)
T0:before treatment. * P <0.05 vs control group;#P <0.05 vs L1 group;△P <0.05 vs L2 group;▲P <0.05 vs T0 group;OP <0.05 vs T1 group.
Group T0 T1 T2 T3 T4 Control 6.2 ±0.5 6.1 ±0.4 6.5 ±0.5 6.1 ±0.4 6.2 ±0.4 L1 6.3 ±0.5 10.4 ±1.3*▲ 15.0 ±0.4*▲O 14.5 ±1.5*▲O 9.6 ±1.7*▲L2 6.2 ±0.4 14.1 ±1.2* #▲ 19.2 ±1.2* #▲O 19.8 ±1.3* #▲O 15.2 ±0.5* #▲L3 5.9 ±0.4 15.5 ±0.9* #▲ 23.0 ±1.8* #△▲O 22.7 ±1.7* #△▲O 19.3 ±1.0* #△▲
討 論
局麻藥對神經細胞的毒性與其劑量、濃度和作用時間相關,即使在臨床常用濃度下,也常導致神經細胞毒性損傷,導致的神經運動與感覺功能損害多數在數小時或數天可完全恢復,少數恢復時間更長,甚至為不可逆性。一項多中心研究發現,TNS 的發病率約為8.1%,表現為椎管內阻滯完全恢復后早期出現燒灼樣、持續固定、痙攣性、放射性疼痛的癥狀,多發于軀干下部、一般為雙側,可沿下肢放射至其末端或背部[1]。馬尾綜合征發病率遠低于TNS,但通常為永久性損害,表現為椎管內阻滯恢復后,持續性肛周、骶尾區、雙下肢感覺和運動功能障礙。
局麻藥的神經毒性作用的機制目前尚不完全明確,可能與以下幾方面有關。(1)神經元興奮性增加[3-5]。局麻藥引起的暫時性神經病學綜合征則表現為傳入神經元興奮性增加引起的向雙下肢放射的臀部神經病理性疼痛。研究表明,利多卡因可以使神經細胞膜上的鈉離子通道發生重排,使細胞內鈉離子濃度及細胞膜上鈉電流增加,神經細胞的興奮性增加。(2)細胞內鈣超載[6-8]。細胞內鈣超載可導致線粒體膜電位的破壞和功能障礙,線粒體腫脹,功能失調,導致細胞死亡。鈣超載可使一些酶激活,引起膜磷脂的分解,在分解過程中產生游離脂肪酸、前列腺素、白三烯、溶血磷脂等,均對細胞產生毒害作用。(3)p38 MAPK 途徑[9,10]。p38 MAPK的激活是細胞凋亡性死亡的細胞內信號途徑。研究表明,布比卡因神經毒性損傷與p38 MAPK 的激活有關。
本研究選擇利多卡因的濃度分別為0.5%、1%和2%,均為臨床上常用的神經阻滯濃度。實驗結果表明,臨床常用濃度的利多卡因也可導致離體培養的神經細胞損傷。本研究采用的是離體細胞培養模型,與在體研究存在比較大的差異。在整體實驗中,制備局麻藥神經損傷模型則需要較高濃度的利多卡因,通常達到5% ~10%,這可能與在體受多種因素如細胞內環境、神經元的種類等因素影響有關。關于利多卡因的在體神經損傷及其機制尚需進一步深入研究。但局麻藥神經毒性損傷已經成為神經阻滯的常見不良反應,且與局麻藥的濃度密切相關,因此在臨床工作中,在滿足臨床需要的同時,應采用最低有效濃度,盡可能減少局麻藥的神經毒性作用。
[1] Capdelila X,Pirat P,Bringuier S,et al. Continuous peripheral nerve blocks in hospital wards after orthopedic surgery:a multicenter prospective analysis of the quality of postoperative analgesia and complications in 1 416 patients[J]. Anesthesiology,2005,103(5):1035-1045.
[2] Perez-Castro R,Patel S,Garavito-Aguilar ZV,et al.Cytotoxicity of local anesthetics in human neuronal cells[J]. Anesth Analg,2009,108(3):997-1007.
[3] Xie W,Strong JA,Zhang JM. Increased excitability and spontaneous activity of rat sensory neurons following in vitro stimulation of sympathetic fiber sprouts in the isolated dorsal root ganglion[J]. Pain,2010,151(2):447-459.
[4] Onizuka S,Kasaba T,Hamakawa T,et al. Lidocaine increases intracellular sodium concentration through voltage- dependent sodium channels in an identified lymnaea neuron[J]. Anesthesiology,2004,101(1):110-120.
[5] Onizuka S,Kasaba T,Tamura R,et al. Lidocaine increases intracellular sodium concentration through a Na+-H+exchanger in an identified Lymnaea neuron[J]. Anesth Analg,2008,106(5):1465-1472.
[6] Johnson ME,Saenz JA,DaSilva AD,et al. Effects of local anesthetic on neuronal cytoplasmic calcium and plasma membrane lysis (necrosis)in a cell culture model[J].Anesthesiology,2002,97(6):1466-1476.
[7] Hogan QH. Pathophysiology of peripheral nerve injury during regional anesthesia[J]. Reg Anesth Pain Med,2008,33(5):435-441.
[8] 何 燕,鐘國強,曾志羽,等. 庚醇預處理對兔缺血再灌注心肌線粒體結構、功能及線粒體Cx43 的影響[J].中國病理生理雜志,2010,26(3):461-465.
[9] Lu J,Xu SY,Zhang QG,et al. Bupivacaine induces apoptosis via mitochondria and p38 MAPK dependent pathways[J]. Eur J Pharmacol,2011,657(1-3):51-58.
[10] 廖新學,阮經文,蘭愛平,等. p38 MAPK-iNOS-NO通路介導化學性缺氧對PC12 細胞的損傷作用[J]. 中國病理生理雜志,2010,26(12):2410-2414.

