內皮素-1及一氧化氮水平與2型糖尿病聽力損害的關系*
陳 雄, 林 碧, 龔小花, 吳文俊, 陳咨苗, 谷雪梅, 沈飛霞△
(溫州醫學院附屬第一醫院1內分泌科,2耳鼻咽喉科,浙江 溫州 325000)
自從1857年Jordao首次報道聽力損害(hearing impairment,HI)和糖尿病之間的關系之后,諸多臨床研究發現糖尿病是致聽力損害的重要原因之一。有學者認為糖尿病患者聽力損害的出現與累及視網膜和腎臟的糖尿病微血管相似的病理改變發生在耳蝸脈管系統所導致[1],也有研究發現糖尿病聽力損害與糖尿病神經及微血管并發癥無關[2],因此其具體機制尚未完全闡明。本研究通過檢測糖尿病伴聽力損害患者血漿內皮素-1(endothelin-1,ET-1)和血清一氧化氮(nitric oxide,NO)水平,初步探討上述2個指標與糖尿病聽力損害的關系。
材料和方法
1 一般資料
本研究選擇在溫州醫學院附屬第一醫院內分泌科就診的符合1999年WHO診斷標準的2型糖尿病患者88例作為糖尿病組(diabetes mellitus,DM),男47例,女41例,年齡(48.21±9.45)歲(<60 歲),糖尿病病程5(1,11)年。根據純音測聽結果,閾值≤25 dB定義為聽力正常,將上述患者分成2組。(1)糖尿病伴聽力損害(DM-HI組,42例):純音測聽閾值>25 dB;(2)糖尿病不伴聽力損害(DM-NoHI,46例):純音測聽閾值≤25 dB。另選同期健康體檢患者53例作為對照組(NC),男31例,女22例,年齡(44.59±10.02)歲(<60歲),同樣根據聽力損害與否進行分類,分為NC-HI組和NC-NoHI組,例數分別為21例和32例。糖尿病患者需通過眼底攝片、24 h尿蛋白定量及周圍神經檢查(包括10 g尼龍絲及肌電圖檢查)排除糖尿病視網膜病變、腎病及周圍神經病變的患者。其它排除標準:1型及其它特殊類型糖尿病,無糖尿病急性并發癥(糖尿病酮癥酸中毒、高血糖高滲狀態),無嚴重的心肌梗塞、腦梗塞病史,無中耳疾病、耳毒性藥物致聾史,無顱腦外傷、噪聲接觸史及遺傳因素致聾史。
2 方法
2.1 臨床生化指標 每位研究對象均空腹10 h次晨抽取靜脈血膽固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白膽固醇(lowdensity lipoprotein cholesterol,LDL - C)、高密度脂蛋白膽固醇(high-density lipoprotein cholesterol,HDL-C)和糖化血紅蛋白(glycation hemoglobin,HbA1c),測量并記錄身高、體重、收縮壓(systolic blood pressure,SBP)和舒張壓(diastolic blood pressure,DBP)。
2.2 純音測聽 每位研究對象均先進行聲導抗測試,在確定其鼓室壓圖為A型圖后,在本底噪音<30 dB的隔聲室中,采用MADSEN公司的ORBITER 922型純音聽力計進行兩耳純音聽閾測試,包括0.25 kHz、0.5 kHz、1 kHz、2 kHz、4 kHz、8 kHz等頻率。參照WHO聽力損傷分級法(1980)及Beauchamp分級標準(1977),取 0.5 kHz、1 kHz、2 kHz、4 kHz的平均氣導聽閾,如閾值>25 dB則定義為聽力損害,閾值≤25 dB為聽力正常。所有操作流程由測聽室專人負責完成。
2.3 血漿ET-1和血清NO測定 (1)血漿ET-1水平測定:采用放射免疫法測定血漿中ET-1水平(采用非平衡法),試劑盒購于解放軍總醫院放免技術中心;(2)血清NO水平測定:應用硝酸還原酶法檢測血清中NO水平,NO試劑盒由南京建成生物工程公司生產。實驗過程嚴格參照說明書進行。
3 統計學處理
結 果
1 2組一般臨床資料比較
如表1所示,DM組患者體重指數 (body mass index,BMI)和 SBP高于 NC 組(P <0.05),性別、年齡和DBP在2組間均無顯著差異。
表1 糖尿病組與對照組一般臨床資料比較Table 1.Characteristics in type 2 diabetes group and control group()
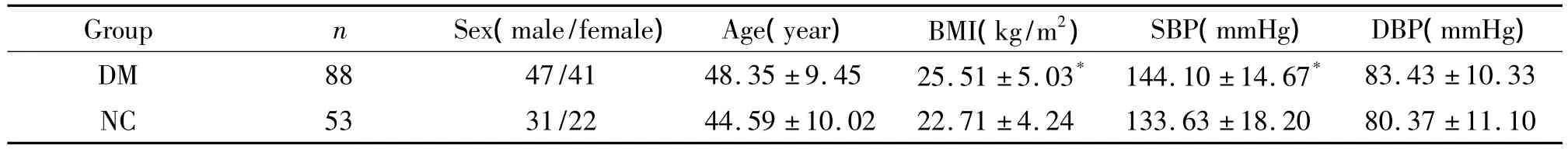
表1 糖尿病組與對照組一般臨床資料比較Table 1.Characteristics in type 2 diabetes group and control group()
DM:type 2 diabetes mellitus;NC:normal control;BMI:body mass index;SBP:systolic blood pressure;DBP:diastolic blood pressure.*P <0.05 vs NC group.
Group n Sex(male/female) Age(year) BMI(kg/m2) SBP(mmHg) DBP(mmHg)DM 88 47/41 48.35 ±9.45 25.51 ±5.03* 144.10 ±14.67*.20 80.37 ±11.1083.43 ±10.33 NC 53 31/22 44.59 ±10.02 22.71 ±4.24 133.63 ±18
2 2組生化指標的比較
如表2所示,DM組患者HbA1c和TC水平高于NC組(P<0.05),HDL-C水平低于 NC組(P<0.05),TG和LDL-C 2組間無顯著差異。
表2 糖尿病組與對照組生化資料比較Table 2.Biochemical parameters in type 2 diabetes group and control group()

表2 糖尿病組與對照組生化資料比較Table 2.Biochemical parameters in type 2 diabetes group and control group()
HbA1c:glycated hemoglobin A1c;TC:total cholesterol;TG:triglyceride;HDL-C:high-density lipoprotein cholesterol;LDL-c:low- density lipoprotein cholesterol;ET -1:endothelin -1;NO:nitric oxide.*P <0.05,**P <0.01 vs NC group.
Group n HbA1c(%) TC(mmol/L) TG(mmol/L) HDL-C(mmol/L) LDL-C(mmol/L)DM 88 7.71 ±1.80** 5.31 ±0.64* 1.52 ±0.61 1.04 ±0.47*2.98 ±0.853.08 ±0.76 NC 53 6.12 ±0.73 4.97 ±0.68 1.46 ±0.97 1.28 ±0.32
3 各組聽力損害與血漿ET-1和血清NO水平比較
如表3所示,DM組ET-1水平高于NC組(P<0.01),DM 組 NO 水平低于 NC 組(P <0.01)。DM-HI組(閾值>25 dD)與DM-NoHI組(閾值≤25 dB)比較,發現在糖尿病伴聽力損害患者中血漿ET-1水平增高(P<0.01),血清NO水平下降(P<0.05),差異顯著。對照組中,NC-HI組(閾值>25 dB)的血漿ET-1較NC-NoHI組顯著升高 (P<0.05),2組血清NO無顯著差異。
表3 糖尿病組與對照組中聽力損害與正常聽力對象血漿ET-1和血清NO水平的比較Table 3.Comparison of plasma endothelin-1 and serum nitric oxide between hearing impairment and non-hearing impairment in diabetic group and control group()
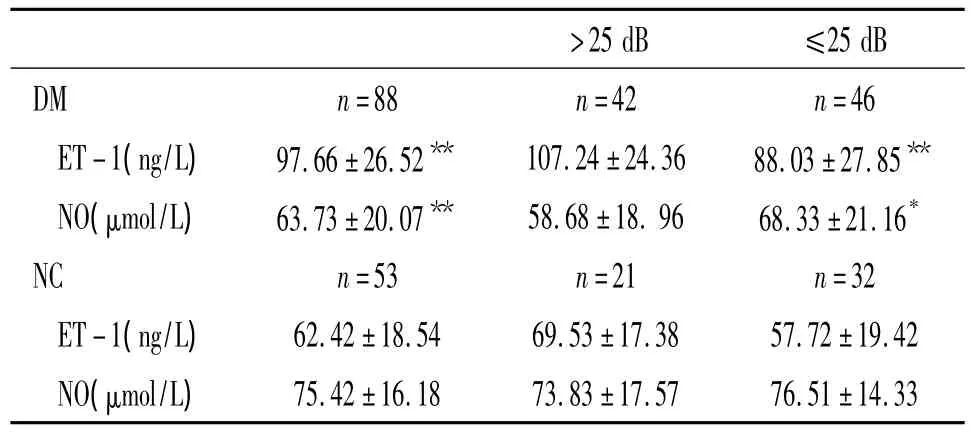
表3 糖尿病組與對照組中聽力損害與正常聽力對象血漿ET-1和血清NO水平的比較Table 3.Comparison of plasma endothelin-1 and serum nitric oxide between hearing impairment and non-hearing impairment in diabetic group and control group()
>25 dB:hearing impairment;≤25 dB:non-hearing impairment;ET -1:endothelin-1;NO:nitric oxide.*P <0.05,**P <0.01 vs NC group.
>25 dB ≤25 dB DM n=88 n=42 n 75.42±16.18 73.83±17.57 76.51±14.33=46 ET-1(ng/L) 97.66±26.52** 107.24±24.36 88.03±27.85**NO(μmol/L) 63.73±20.07** 58.68±18.96 68.33±21.16*NC n=53 n=21 n=32 ET-1(ng/L) 62.42±18.54 69.53±17.38 57.72±19.42 NO(μmol/L)
4 糖尿病聽力損害多因素logistic回歸分析
以糖尿病患者聽力損害與否為因變量,以年齡、SBP、DBP、TC、TG、LDL - C、HDL - C、HbA1c、ET -1和NO共10個因素作為自變量,經多因素logistic回歸分析,結果發現 HbA1c(OR=4.525,95%CI:1.104-8.311,P <0.05)、LDL - C(OR=2.381,95%CI:1.047-5.095,P <0.05)、ET -1(OR=6.207,95%CI:1.600-17.585,P <0.01)和 NO(OR=0.862,95%CI:0.553-0.941,P <0.05)進入模型。結果提示,高HbA1c、LDL-C、ET-1水平以及低NO水平是糖尿病聽力損害的危險因素。
討 論
目前已有許多研究發現糖尿病相關的聽力損害大都表現為雙側進展性感音神經性耳聾,可為耳蝸性聾或蝸后性聾或二者兼而有之[1]。本研究選擇不伴視網膜、腎臟微血管及神經并發癥的糖尿病患者作為研究對象,發現糖尿病患者在發生其它相關并發癥之前已經出現聽力損害,與文獻報道一致[3]。因而推測糖尿病聽力學的檢測較其它糖尿病并發癥的檢測手段,如眼底攝片、尿微量白蛋白、神經系統檢查等,可能更早地發現聽力損害這一糖尿病相關并發癥。
本研究結果顯示血糖控制不良是糖尿病聽力損害發生的重要危險因素,這與糖尿病其它相關并發癥發病特點相似,并與國內外相關研究報道一致[4,5]。此外,經多因素分析顯示高 LDL - c 水平是糖尿病聽力損害的獨立危險因素。Xu等[6]發現氧化低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)通過活性氧簇(reactive oxygen species,ROS)的累積刺激ERK的磷酸化,進而血管內皮轉錄因子活化蛋白-1和ET-1的表達分泌增加,導致微循環障礙。另外,有動物實驗證實高脂血癥可能引起氧化/硝基化作用從而導致內皮功能障礙[7]。我們推測糖尿病合并高脂血癥患者血液黏滯度顯著增高及內皮功能損傷,加重內耳微循環障礙導致聽力損害。
另外,我們的研究結果顯示無論是否存在糖尿病,聽力損害與血漿ET-1升高有關。Franz等[8]研究發現在內耳除Corti器的毛細胞外的其它細胞幾乎均有ET-1與ET-3分布。其中血管紋的邊緣細胞ET-1反應活躍,有學者推測在耳蝸外側壁(血管紋)ET可能是一種調節肽,與NO、前列腺素、心鈉素等相互作用,維持耳蝸微循環的正常及水電解質平衡。Scherer等[9]對離體的蝸軸螺旋動脈的研究發現ET-1與內皮素A受體(endothelin A receptors,ETA-R)作用,通過磷脂酶C及IP3受體介導肌漿網Ca2+的釋放,使血管產生收縮反應,尤其是誘導耳蝸側壁螺旋韌帶毛細血管收縮,從而影響耳蝸微循環。此外,本研究發現糖尿病組血漿ET-1水平高于對照組,血漿ET-1的升高在糖尿病聽力損害組中尤為顯著。目前針對ET-1與糖尿病微血管并發癥的關系研究揭示了ET-1在糖尿病微血管并發癥病理進程中起重要作用[10]。結合上述機制研究,我們推測高糖狀態可能誘導耳蝸脈管系統內皮細胞ET-1 mRNA表達增加,使耳蝸毛細血管收縮,血流下降,從而促使糖尿病聽力損害的發生發展。因此糖尿病早期伴聽力損害患者ET-1水平的增高提示可能已存在耳蝸微循環障礙。
本研究另一結果是血清NO是糖尿病聽力損害的重要的保護因素。新近報道包括NO在內的多項氧化應激指標與糖尿病患者聽力損害發生密切相關,這與我們研究結果相一致[3]。內源性NO是由L-精氨酸(L-arginine,L-Arg)與O2在一氧化氮合酶(nitric oxide synthase,NOS)的作用下生成的[11]。NO是具有神經遞質樣作用的自由基,通過可溶性鳥苷酸環化酶(guanylate cyclase,GC),使靶細胞內cGMP水平增高而發揮作用。目前諸多糖尿病慢性血管并發癥的研究均提示在糖尿病進程中NO合成受損導致內皮依賴的血管舒張功能障礙[12]。目前已知NOS廣泛分布于內耳的內皮細胞、神經細胞、毛細胞等。生理狀態下NO在內耳血流調節、局部水電解質平衡及神經信號傳遞等方面起重要作用,病理條件下NO則可能參與局部組織炎癥反應等病理過程[13]。目前有研究發現來自耳蝸血管壁的NO產物能夠調節耳蝸血管血流[3]。因此,血清NO水平的下降可能同樣預示糖尿病患者存在耳蝸血管循環障礙所致聽力損害。
綜上所述,本研究通過對尚未合并糖尿病視網膜、腎臟及神經病變的糖尿病患者研究發現在糖尿病上述相關并發癥發生之前已經存在與可能糖尿病相關的聽力損害。高HbA1c、LDL-c水平、血漿ET-1水平以及低血清NO水平可能參與糖尿病伴聽力損害的發病機制。因此,我們推測糖尿病微循環障礙更早地發生于耳蝸,表現為聽力損害。同時本研究結果也提示臨床醫務人員在糖尿病患者中應進行早期聽力篩查,嚴格控制血糖血脂水平,使用改善血管內皮功能的藥物可能延緩糖尿病伴聽力損害患者聽力下降。
[1]Hirose K.Hearing loss and diabetes:you might not know what you're missing[J].Ann Intern Med,2008,149(1):54-55.
[2]Díaz de León - Morales LV,Jáuregui- Renaud K,Garay-Sevilla ME,et al.Auditory impairment in patients with type 2 diabetes mellitus[J].Arch Med Res,2005,36(5):507-510.
[3]Aladag I,Eyibilen A,Guven M,et al.Role of oxidative stress in hearing impairment in patients with type two diabetes mellitus[J].J Laryngol Otol,2009,123(9):957 -963.
[4]樊云霞,韓 峰,崔小康,等.老年2型糖尿病患者聽力損害特征及相關因素分析[J].山東大學學報(醫學版),2008,46(7):707 -709.
[5]Bainbridge KE,Cheng YJ,Cowie CC.Potential mediators of diabetes-related hearing impairment in the U.S.population:National Health and Nutrition Examination Survey 1999 -2004[J].Diabetes Care,2010,33(4):811 -816.
[6]Xu H,Duan J,Wang W,et al.Reactive oxygen species mediate oxidized low-density lipoprotein-induced endothelin-1 gene expression via extracellular signal-regulated kinase in vascular endothelial cells[J].J Hypertens,2008,26(5):956 -963.
[7]李 榕,王文清,張海鋒,等.高血脂通過氧化/硝基化雙重作用介導大鼠內皮功能失調[J].中國病理生理雜志,2010,26(8):1494 -1497.
[8]Franz P,Hauser-Kronberger C,Egerbacher M,et al.Localization of endothelin-1 and endothelin-3 in the cochlea[J].Acta Otolaryngol,1997,117(3):358 -362.
[9]Scherer EQ,Wonneberger K,Wangemann P.Differential desensitization of Ca2+mobilization and vasoconstriction by ETAreceptors in the gerbil spiral modiolar artery[J].J Membr Biol,2001,182(3):183 -191.
[10]Settergren M,Pernow J,Brismar K,et al.Endothelin-A receptor blockade increases nutritive skin capillary circulation in patients with type 2 diabetes and microangiopathy[J].J Vasc Res,2008,45(4):295 -302.
[11]陳 靜,秦 炯,韓 穎,等.一氧化氮和內質網應激[J].中國病理生理雜志,2008,24(11):2272 -2275.
[12]Cohen RA.Role of nitric oxide in diabetic complications[J].Am J Ther,2005,12(6):499 -502.
[13]王 劍,邱建華.一氧化氮和心鈉素對耳蝸血流的影響[J].中華耳科學雜志,2006,4(3):234-237.

