卵巢上皮癌中血管生成擬態和E-鈣黏蛋白表達及其臨床意義
俞 嵐, 武世伍, 宋文慶, 周 蕾, 承澤農
(蚌埠醫學院第一附屬醫院病理科,安徽省感染與免疫重點實驗室,安徽 蚌埠 233030)
卵巢癌是女性生殖道惡性腫瘤中死亡率最高的一種,70%的患者就診時已屬晚期,5年生存率低于30%。腫瘤血管生成擬態(vasculogenic mimicry,VM)指的是在沒有內皮細胞的參與下,細胞表型出現轉化,通過自身變形和基質重塑而直接形成特有的微循環管道,通道內無內皮細胞襯覆。擬態血管生成使卵巢癌更具侵襲性和轉移性。VM結構中癌細胞之間以及癌細胞與基質間黏附作用的存在是通過細胞黏附分子(cellular adhesion molecules,CAMs)發揮關鍵性的作用,其中E-鈣黏蛋白(E-cadherin,E-cad)是黏附分子中的重要成員,其表達程度的變化直接關系到腫瘤的生物學行為。本研究通過對80例上皮性卵巢癌(epithelial ovarian cancer,EOC)根治性手術病例標本VM及E-cad水平的檢測,探討其表達與卵巢癌侵襲、轉移以及預后的關系。
材料和方法
1 材料
1.1 一般資料 收集蚌埠醫學院第一附屬醫院病理科2000年1月~2002年12月存檔石蠟包埋EOC組織標本80例(術前未行放、化療)和卵巢良性上皮性腫瘤組織標本20例,所有病例均有完整的臨床、病理及隨訪資料,入選病例隨訪至患者死亡或截止2010年11月,隨訪時間為7~96個月。根據國際抗癌聯盟(International Union Against Cancer,UICC)2002版腫瘤PTNM分期標準進行分期,早期(FIGOⅠ、Ⅱ期)卵巢癌40例,晚期(FIGOⅢ、Ⅳ期)卵巢癌40例;漿液性癌70例,黏液性癌10例;有腹腔臟器及淋巴結轉移者38例,有腹水者21例。年齡19~76歲,中位年齡50.2歲,≥50歲33例,<50歲47例;腫瘤平均最大長徑(diameter,D)為5.3 cm,D≥5.0 cm 48例,D<5.0 cm 32例。選擇20例良性上皮性卵巢腫瘤患者手術切除標本作為良性對照組。復閱上述患者的病理切片,選取存檔的患者手術標本石蠟塊進行切片,厚度4 μm。
1.2 試劑 鼠抗人 CD34單克隆抗體(克隆號QBEnd/10)以及鼠抗人E-cad單克隆抗體[克隆號:MM(36B5)],ElivisionTMPlus試劑盒以及DAB顯色試劑盒均購自福州邁新生物技術開發公司。過碘酸Schiff(periodic acid-Schiff,PAS)染色液為蚌埠醫學院第一附屬醫院病理科配制。
2 方法
2.1 免疫組織化學ElivisionTMPlus法 將石蠟標本以4 μm厚連續切片,烤干,于二甲苯溶液及不同濃度的乙醇中脫蠟至水。免疫組化染色操作步驟按試劑盒說明書進行。采用已知陽性片作對照,以PBS液代替Ⅰ抗作空白對照。
2.2 CD34和PAS套染 CD34免疫組化染色,DAB顯色后,水流沖洗1 min終止顯色反應,將切片置于0.5%高碘酸溶液中氧化5~8 min。流水沖洗2 min,再用蒸餾水洗1次,于暗處置于Schiff液中染色10~20 min,然后用0.5%偏重亞硫酸鈉液滴洗2次,每次1 min,流水沖洗2 min;此后依次蘇木素淺染細胞核、鹽酸乙醇分化、返藍、脫水透明以及中性樹膠封片。
2.3 微血管密度(microvessel density,MVD)計數CD34主要表達在血管內皮細胞的細胞漿和胞膜,從而可以通過CD34的陽性表達來進行MVD計數,參照文獻[1]來計數。
2.4 結果判定 CD34和E-cad均以細胞膜和細胞漿出現棕黃色顆粒為陽性。采取二次計分法:每例標本隨機計數5個高倍視野(×400),計數每個高倍視野中陽性細胞所占百分比并計分。首先將染色強度計分:0分為無色,1分為淡黃色,2分為棕黃色,3分為棕褐色。再將陽性細胞百分比計分,0分為陰性,1分為陽性細胞<10%,2分為11% -50%,3分為51%-75%,4分為>75%。用染色強度得分和細胞數得分的乘積作為判斷表達結果,若積分≤2為陰性,>2為陽性。免疫組化結果由高年資病理醫師讀片評定。
3 統計學處理
采用SPSS 17.0統計軟件進行數據分析。VM和E-cad表達陽性組與陰性組生存分析用Kaplan-Meier法,組間比較用log-rank檢驗,多因素分析采用Cox回歸多因素模型,VM和E-cad在EOC組織中表達與卵巢良性上皮性腫瘤組織、各臨床及病理因素的相關性采用Fisher精確概率法檢驗。
結 果
1 卵巢EOC及良性上皮性腫瘤組織中VM及E-cad蛋白的表達
EOC組織中可檢測到VM的存在,在蘇木精-伊紅(hematoxylin-eosin,HE)染色切片中查見由腫瘤細胞圍繞形成的管腔樣結構,腔內可見紅細胞,見圖1A;通過 CD34和 PAS套染,VM表現為PAS陽性染色但CD34陰性的管腔樣結構,具有VM的腫瘤細胞附近不見壞死的腫瘤細胞,血管則表現為CD34及PAS染色均為陽性的管腔樣結構;而CD34及PAS染色均為陰性的管腔樣結構則并非VM,見圖1B、C、D。E-cad主要表達于卵巢癌細胞漿,呈棕黃色,見圖1E,但是有VM存在的EOC組織中E-cad多為陰性表達,見圖1F。EOC組及良性上皮性腫瘤組中VM檢測陽性率分別為57.4%(46/80)及0%(0/20),E-cad蛋白陽性表達率分別為48.7%(39/80)及75.0%(15/20),2組差異均顯著(P <0.05),見表1。

Figure 1.VM and E-cad expression in EOC(×400).A:HE staining(black arrows indicated VM);B~D:CD34 and PAS double staining(black arrows in B and C indicated VM,with PAS-positive and CD34-negative staining;red arrows in B,C and D indicated capillary,with positive staining of CD34 and PAS;the yellow arrow in D indicated the structure with negative staining of CD34 and PAS);E~F:immunohistochemical staining of E-cad was positive in E and negative in F.圖1 EOC中的VM和E-cad表達
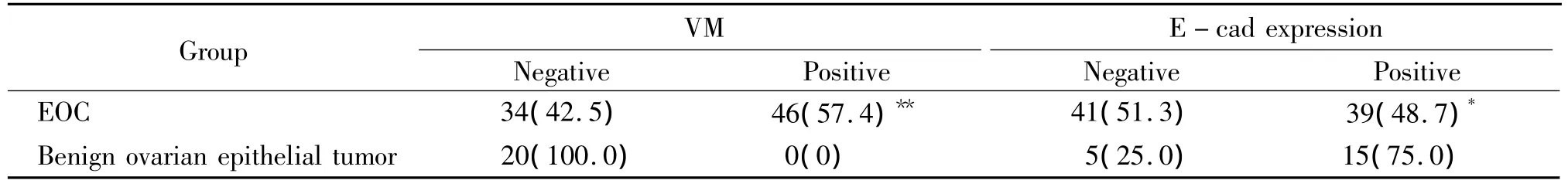
表1 EOC及卵巢良性上皮性腫瘤組織中VM和E-cad蛋白表達Table 1.VM and E -cad expression in EOC and benign epithelial tumor tissues[n(%)]
2 EOC中VM及E-cad表達與臨床病理指標的關系
VM及E-cad表達陽性率與患者的年齡、腫瘤的大小、組織學類型以及患者有無腹水之間差異均無顯著(P>0.05)。EOC的分化越低,VM越多,差異顯著(P<0.05);PTNM分期Ⅰ-Ⅱ期VM陽性率為27.9%(12/43),Ⅲ-Ⅳ期VM陽性率為91.9%(34/37),VM組的PTNM分期與無VM組的PTNM分期相比差異顯著(P<0.05);VM組的患者更易發生腹腔臟器及淋巴結轉移(P<0.05),見表2。EOC的分化越高,E-cad表達越強;伴有腹腔臟器及淋巴結轉移的病例中E-cad表達降低,差異均顯著(P<0.05)。Ⅰ-Ⅱ期腫瘤中E-cad的陽性率為72.1%(31/43),Ⅲ-Ⅳ期腫瘤中E-cad的陽性率為21.6%(8/37),兩者之間差異顯著(P<0.05),見表2。
3 EOC中VM與E-cad表達的關系
Spearman相關分析顯示,在EOC中VM與E-cad的表達呈負相關(r= -0.578,P<0.01),見表3。
4 多因素分析
將病理組織分化(分為高分化組、中分化組與低分化組)、年齡(分為≥50歲組與<50歲組)、PTNM分期(分為Ⅰ-Ⅱ期組與Ⅲ-Ⅳ期組)、腫瘤直徑(分為≥5.0 cm組與<5.0 cm組)、腹腔臟器及淋巴結轉移(分為有轉移組與無轉移組)、腹水(分為有腹水組與無腹水組)、VM(分為表達陽性組與陰性組)、MVD(因為MVD的均值為22.99±12.40,故以MVD<22為陰性;MVD≥22為陽性)和E-cad(分為表達陽性組與陰性組)等因素引入Cox模型進行多因素分析,結果顯示:VM、E-cad表達、PTNM分期和淋巴結轉移是影響EOC根治術后患者預后的獨立因素,見表4。
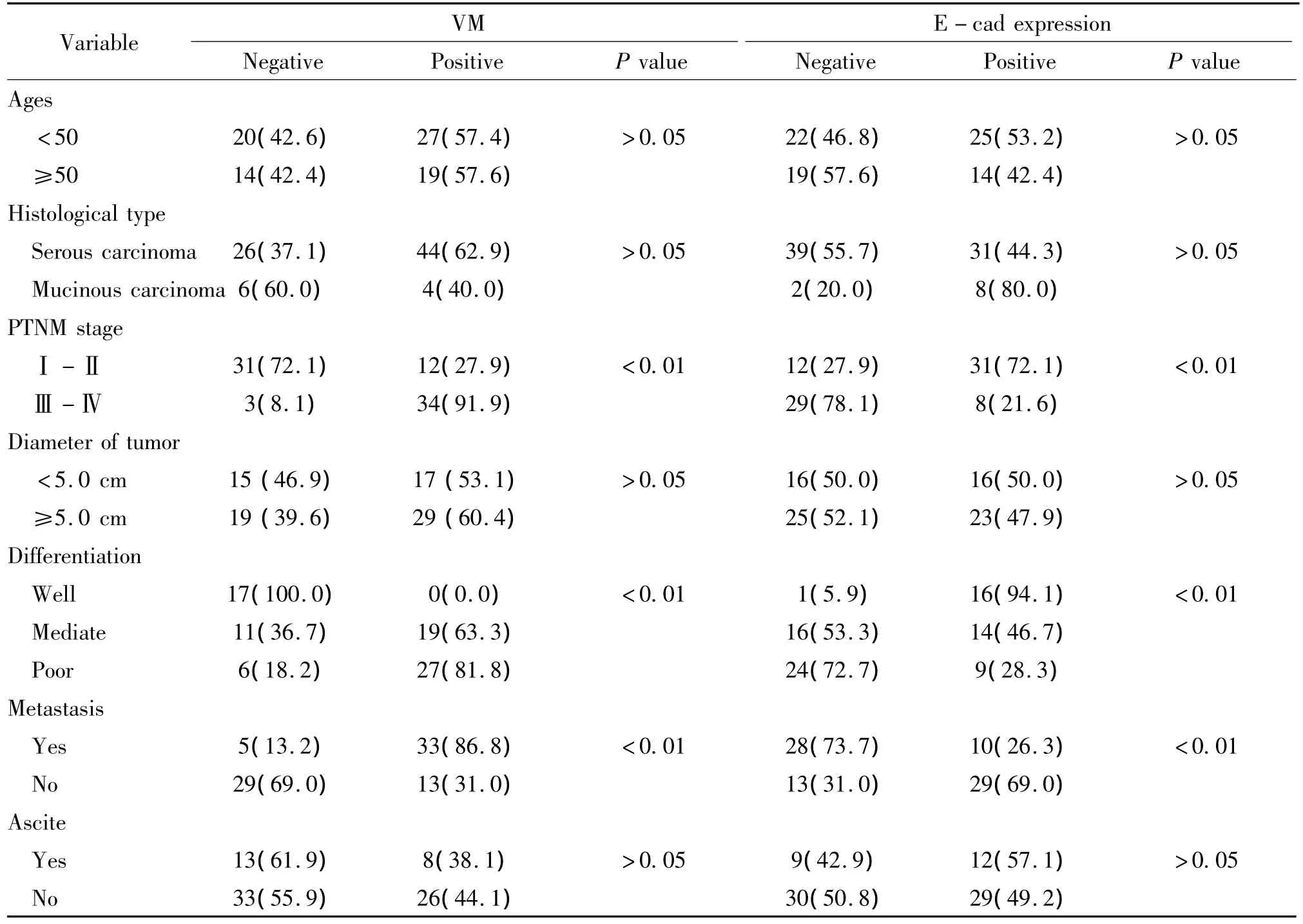
表2 80例EOC組織中VM和E-cad的表達與臨床病理因素的關系Table 2.Correlation of VM and E-cad expression to clinicopathologic indexes of 80 cases of EOC[n(%)]
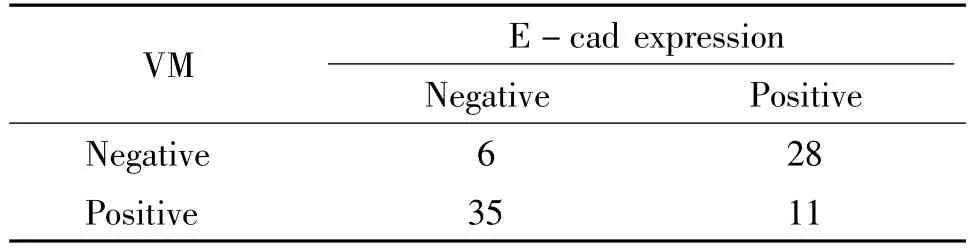
表3 EOC中VM與E-cad表達之間的關系Table 3.Correlation of VM to E-cad expression in EOC
5 生存率分析
本組病例總的5年生存率為40.0%。Kaplan-Meier生存分析顯示VM陽性組與陰性組5年生存率分別為4.3%和88.2%,差異顯著(P<0.01);E-cad陽性組與陰性組5年生存率分別為71.8%和9.8%,差異顯著(P<0.01),生存曲線見圖2。
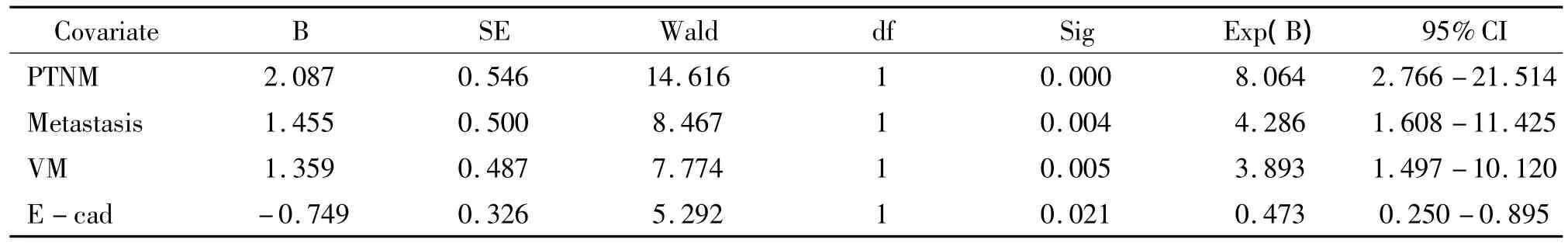
表4 80例EOC患者多因素分析Table 4.Multivariate survival analysis of 80 patients with EOC
討 論
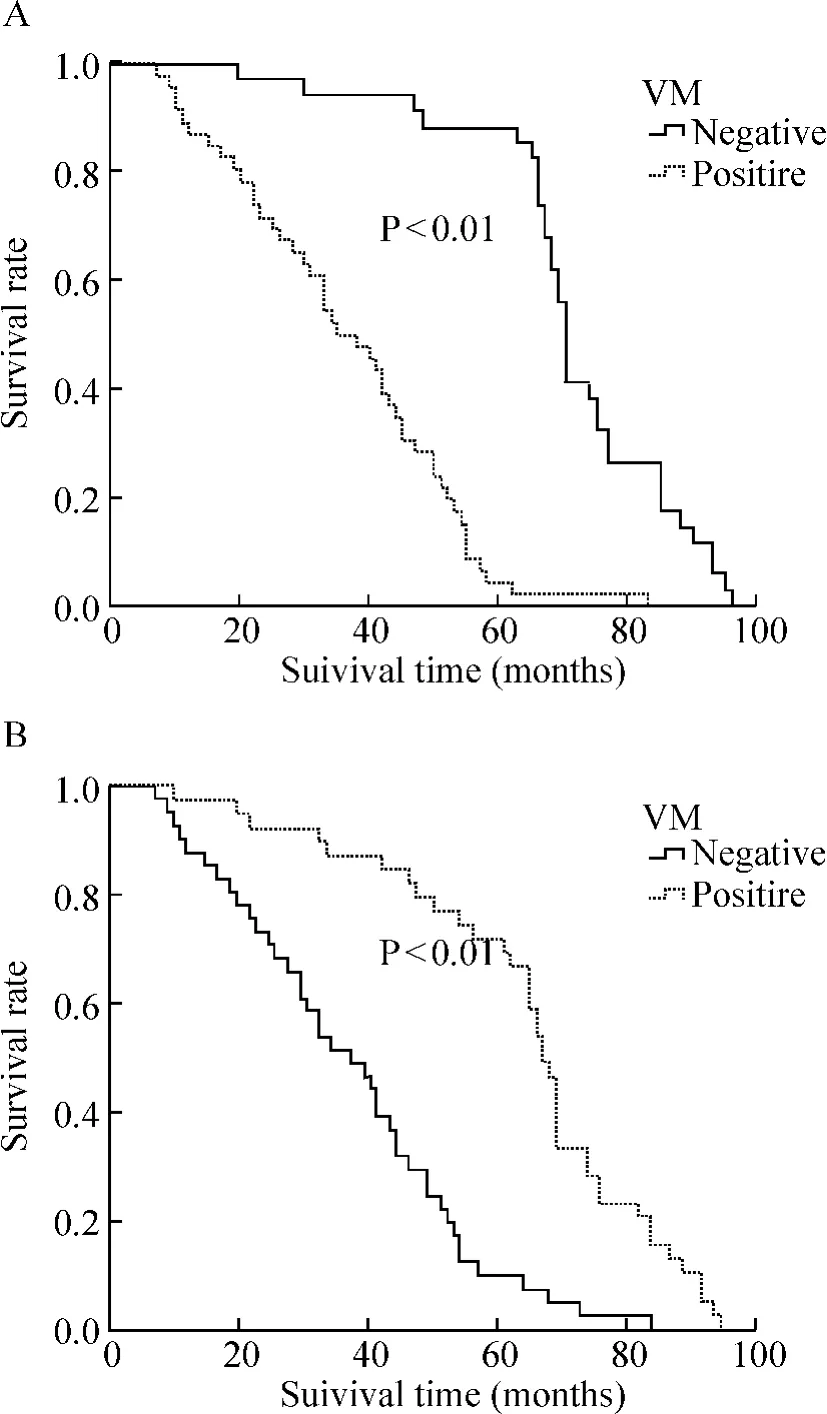
Figure 2.Survival curves of EOC patients with positive or negative VM(A)and E-cad expression(B).圖2 VM和E-cad表達陽性或陰性對EOC患者生存率的影響
卵巢癌由于發病隱匿,早期難以察覺,就診時多處臨床晚期,腫瘤都多已發生不同程度的轉移,手術難以根治,且術后常有復發。因此,卵巢癌被認為是預后最差的婦科惡性腫瘤之一。卵巢癌的腫瘤血管生成具有多樣性[2],存在血管生成(angiogenesis)、血管形成(vasculogenesis)和VM 3種方式。這些血管新生方式與腫瘤的轉移、復發等惡性生物行為密切相關。VM是1999年Maniotis等[3]在研究高侵襲性葡萄膜黑色素瘤微循環時發現的一種獨特的腫瘤血液供應方式,Folberg等[4]對VM定義為:由侵襲性腫瘤細胞而非內皮細胞連接、以細胞外基質成分為分隔而形成的微循環管道。隨后,VM相繼在卵巢癌、肝癌、前列腺癌以及橫紋肌肉瘤[5-7]等高度惡性的腫瘤中被發現,且研究表明,VM的存在與侵襲性腫瘤的轉移和預后不良密切相關[8]。VM管道直接由腫瘤細胞圍成,腫瘤細胞與血流之間僅有一層PAS陽性的基底膜樣物相隔,無血管內皮細胞屏障,因此腫瘤細胞釋放的蛋白水解酶能夠更容易地溶解基底膜樣物而使腫瘤細胞直接進入血液,從而有利于腫瘤的侵襲和轉移。也有學者對VM的存在持否定態度,他們認為VM是腫瘤組織內出血和壞死所致的假象,Shirakawa等[9]以充分的證據表明VM 是腫瘤組織內的一個功能性微循環,而并非出血壞死的腫瘤組織形成的腔隙,血管造影顯示VM內有血流通過,從而證實VM為血管樣結構,同時其研究發現,7.9%的人乳腺癌組織中存在VM現象,具有VM的患者更易發生血道轉移而且生存期較短。Hoffmeyer等[10]認為,腫瘤細胞高表達E-cad和ras相似基因家族成員 A(ras homolog gene family,member A,RhoA),且對于I型膠原有更強的親合力,可能是炎性乳腺癌發生VM的機制之一。Sood等[11]發現在卵巢癌也存在VM現象,在含有基質膠(Matrigel)或I型膠原的三維培養體系中,高侵襲性卵巢癌細胞(SKOV3和EG)能形成VM管網狀結構,其中缺乏內皮細胞或成纖維細胞,而低侵襲性卵巢癌細胞沒有VM現象。趙秀蘭等[6]通過對肝細胞肝癌中VM的研究發現,不同分化程度的肝癌中均可有VM的存在,但低分化者VM陽性率高于高分化者。Folberg等[12]認為,VM結構由于缺乏內皮細胞襯覆,管壁上的腫瘤細胞容易脫落進入管道中,進入血管向遠處轉移,因此與腫瘤的轉移及不良預后密切相關。
本實驗通過對80例卵巢EOC組織的檢測,在46例病例中發現了符合VM標準的管道結構,證實了在EOC中確實有VM的存在。VM存在的區域很少出現壞死,且VM的檢出率與腫瘤細胞分化程度、腫瘤轉移與否及臨床分期等密切相關。即伴有VM存在的EOC具有低分化、臨床分期晚以及更容易發生轉移等特點,這與上述國內外的文獻報道基本一致。
鈣黏蛋白是一組 Ca2+依賴性跨膜糖蛋白,E-cad是家族中的主要成員,其基因定位于16q22.1。E-cad普遍存在于各類上皮組織中,是上皮細胞的標志物,主要分布于同種上皮細胞側面的黏附小帶處,在極化上皮細胞之間的黏附起主要作用[13]。E-cad介導細胞間的黏附連接,在胚胎發育、形態學發生、細胞分化、上皮極性與完整性的維持方面起著重要作用,是重要的細胞 -細胞間粘附分子。E-cad異常表達是分子離散的基礎,其表達的減少及確實與人類各種腫瘤侵潤和轉移的關系較為密切。Fujioka等[14]的研究表明,卵巢上皮性癌E-cad表達較正常卵巢表面上皮下降,高分化卵巢上皮性癌E-cad表達高于中、低分化癌(P<0.05),與原發灶相比,60%周圍轉移病變出現E-cad表達下降。Faleiro-Rodrigues等[15]指出卵巢腫瘤惡性程度越高,E-cad陽性表達率越低,E-cad表達與卵巢癌的FIGO分期(P<0.05)、組織亞型(P<0.01)、腹膜轉移(P<0.01)和殘余病灶大小(P<0.01)有關。
本研究結果顯示E-cad的表達與EOC的分化程度、轉移情況及臨床分期等因素呈現相關性,即隨著E-cad表達的降低,EOC出現分化降低、臨床分期晚以及更容易發生轉移的特點。并且本研究發現,在EOC中,隨著E-cad表達率的降低,VM的陽性率顯著升高,兩者呈現負相關性(r=-0.578,P<0.01)。這一結果提示在EOC的VM形成過程中,E-cad可能起到某種關鍵性作用。我們推測,隨著E-cad表達的減少,不僅使細胞間附著變得松散,也使得細胞內骨架缺少相鄰細胞因黏附而形成的固定作用,從而獲得自身變形并形成細胞間腔隙的能力,從而促進VM的形成。
本研究多因素分析顯示,VM、E-cad表達、PTNM分期和腹腔臟器及淋巴結轉移是影響EOC患者的獨立預后因素。進一步的生存分析提示VM陽性組比VM陰性組有更低的5年生存率,這與文獻報道結果相同;此外,E-cad陽性組的5年生存率顯著高于陰性組,提示E-cad的表達對于EOC患者的生存率及生存期預后的估計可能有一定的指導意義。
[1]Kumda T,Tsuneyama K,Hatta H,et al.Improved 1 -h rapid immunostaining method using intermitten microwave irradiation:practicability based on 5 years application in Toyama Medical and Pharmaceutical University Hospital[J].Mod Pathol,2004,17(9):1141 -1149.
[2]堯良清,顧漪萍,豐有吉,等.卵巢癌血管生成的多樣性[J].中國病理生理雜志,2008,24(1):195-197.
[3]Maniotis AJ,Folberg R,Hess A,et al.Vascular channel formation by human melanoma cells in vivo and in vitro:vasculogenic mimicry[J].Am J Pathol,1999,155(3):739-752.
[4]Folberg R,Maniotis AJ.Vasculogenic mimicry[J].APMIS,2004,112(7-8):508-525.
[5]Sood AK,Seftor EA,Fletcher MS,et al.Molecular determinants of ovarian cancer plasticity [J].Am J Pathol,2001,158(4):1279-1288.
[6]趙秀蘭,杜 靜,張詩武,等.肝細胞肝癌中血管生成擬態的研究[J].中華肝臟病雜志,2006,14(1):41-44.
[7]Danny R,Gray I,Wendy J,et al.Short- term human prostate primary xenografts:an in vivo model of human prostate cancer vasculature and angiogenesis[J].Cancer Res,2004,64(3):1712 -1721.
[8]Yue WY,Chen ZP.Does vasculogenic mimicry in astrocytoma?[J].J Histochem Cytochem,2005,53(8):997-1002.
[9]Shirakawa K,Kobayashi H,Sobajima J,et al.Inflammatory breast cancer:vasculogenic mimicry and its hemodynamics of an inflammatory breast cancer xenograft model[J].Breast Cancer Res,2003,5(3):136 -139.
[10]Hoffmeyer MR,Wall KM,Dharmawardhane SF.In vitro analysis of the invasive phenotype of SUM 149,an inflammatory breast cancer cell line[J].Cancer Cell Int,2005,5(1):11.
[11]Sood AK,Fletcher MS,Coffin JE,et al.Functional role of matrix metalloproteinases in ovarian tumor cell plasticity[J].Am J Obstet Gynecol,2004,190(4):899 -909
[12]Folberg R,Maniotis AJ.Vasculogenic mimicry[J].APMIS,2004,112(7-8):508-525.
[13]Yagi T,Takeichi M.Cadherin superfamily genes:functions,genomic organization,and neurologic diversity[J].Genes Dev,2000,14(10):1169-1180.
[14]Fujioka T,Takebayashi Y,Kihana T,et al.Expression of E -cadherin and β - catenin in primary and peritoneal metastatic ovarian carcinoma[J].Oncol Rep,2001,8(2):249-255.
[15]Faleiro-Rodrigues C,Macedo-Pinto I,Pereira D,et al.Association of E - cadherin and β - catenin immunoexpression with clinicopathologic features in primary ovarian carcinomas[J].Hum Pathol,2004,35(6):663 -669.

