Prohibitin在低膽固醇培養人前列腺癌細胞系PC-3中表達上調及其可能機制*
董 培, 李永紅, 堯 凱, 劉卓煒, 周芳堅
(華南腫瘤學國家重點實驗室,中山大學腫瘤防治中心泌尿外科,廣東 廣州 510060)
高脂肪/膽固醇等“西方飲食”同前列腺癌的發病和進展密切相關[1]。高血清膽固醇水平能夠促進前列腺癌的發展。然而,循證醫學證據表明,采用膽固醇合成抑制藥物如羥甲基戊二酰輔酶A(hydroxymethylglutaryl coenzyme A,HMG-CoA)還原酶抑制劑并不能降低前列腺癌整體風險率[2],具體機制尚未明確。我們研究發現,低膽固醇培養前列腺癌PC-3細胞中prohibitin(PHB)表達升高。本實驗通過構建PHB基因啟動子調控的真核表達載體,轉染前列腺癌PC-3細胞,分析其轉染活性并進一步驗證其膽固醇敏感活性,為進一步研究其在膽固醇影響前列腺癌進展的基因研究提供基礎。
材料和方法
1 材料
螢光素酶報告基因載體pGL3-Basic為Pro-mega產品,前列腺癌細胞系PC-3細胞為中山大學腫瘤防治中心實驗室保存。DNA聚合酶、Xho I、Hind III和T4 DNA連接酶為New England Biolabs產品;脂質Lipofectamine 2000為Invitrogen產品;質粒純化試劑盒及膠回收試劑盒為Qiagen產品,Luciferase Assay System為Promega產品。
2 方法
2.1 細胞培養及分組 實驗分為對照組和實驗組,對照組PC-3細胞株傳代培養于100 mm細胞培養皿中,加入10 mL DMEM+10%FBS培養液置于37℃、5%CO2培養24 h。實驗組棄去培養液,加入12 mL DMEM+10%脂蛋白缺乏血清(lipoproteindeficient fetal bovine serum,LPDS)+50 μmol/L甲羥戊酸鹽(mevalonate)和50 μmol/L司伐他汀(simvastatin)培養液。繼續放入37℃、5%CO2培養箱培養48 h。
2.2 Real-time PCR定量檢測 PHB mRNA 培養48 h后,Trizol一步法提取總RNA后,按說明書操作反轉錄成cDNA。根據GenBank中人PHB基因序列號(NM_002634)的mRNA序列,根據引物設計原則,運用Oligo 6引物設計軟件設計。選定核苷酸號為131-305的序列,上游引物5'-GGAGGCGTGGTGAACTCTG -3',下游引物 5'- CTGGCACATTACGTGGTCG A G-3',擴增片段長度為175 bp。以GAPDH為內參照引物,上游引物 5'-TGAACGGGAAGCTCACTGG -3',下游引物 5'-TCCACCACCCTGTTGCTGTA-3',擴增片段長度為317 bp。反應體系加入SYBR? Green PCR Master Mix,按照試劑盒要求配置。混合樣品均勻加入至ABI MicroAmp光學96孔反應板中,蓋上蓋子密封,離心、去除氣泡。每份樣本重復3次以減小加樣誤差。在ABI PRISM 7900HT擴增儀上設置95℃預變性5 min,95 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,循環35次,4 ℃終止反應。基因表達結果分析運用2-ΔΔCt法分析。
2.3 PHB基因啟動子引物的設計和合成 根據GenBank中人 PHB promoter(GenBank accession#DQ406856)的mRNA序列,運用人17染色體基因DNA為模板參照文獻設計:正向引物 5'-GCAACTCGAGGGAGAAACCCCGTCTCTAC-3'(下劃線核苷酸部分為Xho I內切酶位點),前面采取4個堿基進行硫代修飾,反向引物 5'-GCAAAAGCTTCCTCACAAGTCGGACTCACGC -3'(下劃線核苷酸部分為Hind III內切酶位點),前面采取4個堿基進行硫代修飾。同時選擇低密度脂蛋白受體(low-density lipoprotein receptor,LDLR)為陽性對照,根據GenBank中LDLR promoter(GenBank accession#L29401)的堿基序列,以人總染色體DNA為模板參照文獻設計:正向引物5'-CTCGAGCTTCACGGGTTAAAAGCCGATGTCACA-3'(下劃線核苷酸部分為 Xho I內切酶 位點)。反向引物5'-AAGCTTATTGCACTCGGGGCCCACGTCATTTA-3'(下劃線核苷酸部分為Hind III內切酶位點)。經過BLAST軟件進行序列同源性分析,確認靶向基因的特異性后進行實驗。引物由北京奧科生物技術公司合成。
2.4 PCR擴增及鑒定 采用Platinum Pfx DNA polymerase(Invitrogen)PCR反應體系,按照試劑盒要求配置。要求配置94℃預變性2 min,94℃ 15 s,55℃ 30 s,68 ℃ 1 min/kb,循環 35次,72 ℃10 min,4℃終止反應。合成產物用基因序列測序證實,并用紫外分光光度計測定產物的濃度及純度并紀錄。
2.5 pGL3重組質粒的構建 用Xho I和Hind III內切酶雙酶切 PCR產物,得到PHB-Pro、LDLR-Pro和pGL3-Basic載體,凝膠電泳后從凝膠中提取純化DNA,回收的片段用T4 DNA連接酶16℃連接過夜,將連接產物轉化E.coli DH5α感受態細胞,在Amp抗性平板上篩選重組質粒。用SacⅠ和HindⅢ雙酶切鑒定并送公司DNA測序。測序正確的重組質粒命名為pPHB-1192、pLDLR-234。
2.6 重組質粒的活性分析 分別將pPHB-1192、pLDLR-234及陰性對照質粒pGL3-Basic轉染前列腺癌細胞系PC-3,以未轉染質粒的細胞為未轉染對照組(NM),同步進行實驗。轉染后繼續37℃、5%CO2培養箱內孵育48 h后,更換細胞培養液為普通培養基對照組、低膽固醇培養基+膽固醇組(低膽固醇培養基+10 mg/L膽固醇+1 mg/L 25-羥基膽固醇(LPDS+CHO)和低膽固醇培養基組(LPDS)。繼續放入37℃、5%CO2培養箱培養48 h。裂解細胞,加入螢光素酶檢測試劑,Luminometer Model(Promega)上每孔自動加入100 μL Luciferase Assay Reagent檢測螢光值。
3 統計學處理
結 果
1 低膽固醇對PC-3細胞PHB mRNA表達的影響
在低膽固醇培養條件下,PC-3細胞內的PHB表達明顯上調,與對照組相比較有顯著差異(P<0.01),見圖 1。
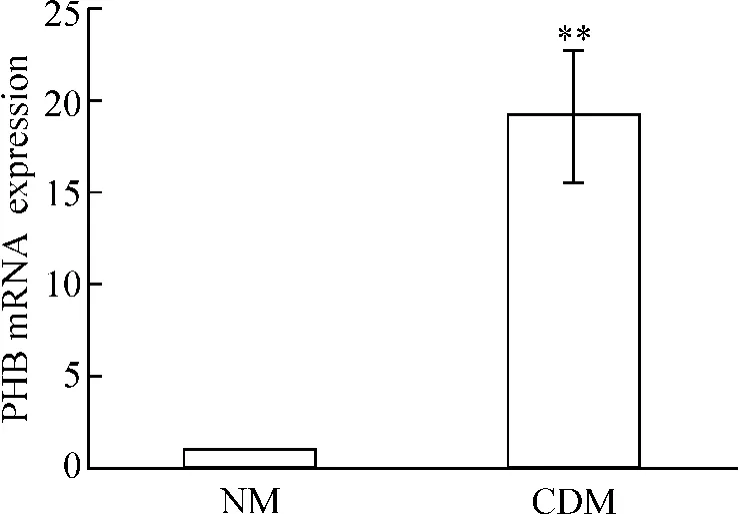
Figure 1.Expression of PHB mRNA increased after CDM treatment.**P < 0.01 vs NM control group.圖1 CDM誘導PC-3細胞PHB mRNA表達
2 重組質粒pPHB-1192和pLDLR-234的鑒定
經Xho I和Hind III雙酶切后分別可見到大小約全長為1192 bp和234 bp的PHB-Pro和LDLRPro基因片段,約6000 bp處可見pGL3-Basic片段,結果與設計相符,測序結果與目的基因組一致,見圖2。
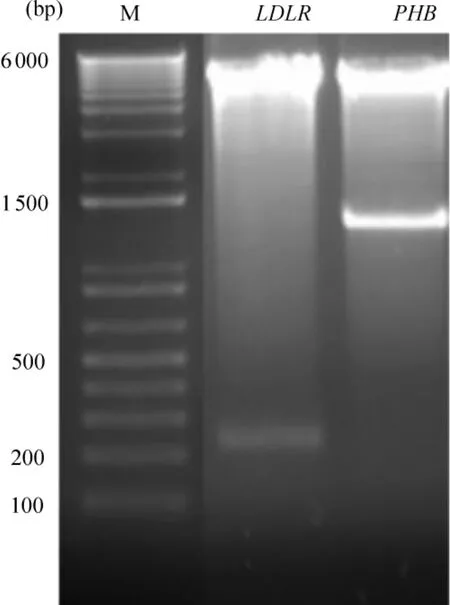
Figure 2.Gel electrophoresis result after plasmid was digested by Xho I and Hind III.M:DNA marker.圖2 雙酶切后電泳結果
3 重組質粒螢光素酶活性分析
螢光檢測結果顯示,同空白對照組pGL3比較,實驗組pPHB-1192 luciferase表達顯著增強,兩組比較有顯著差異(P<0.05),表明轉染效率高。同普通培養基組相比較,低膽固醇培養基組luciferase表達顯著升高,兩組比較有顯著差異(P<0.05)。在低膽固醇培養基組中加入膽固醇,其luciferase表達顯著降低,兩組比較有顯著差異(P<0.05),表明低膽固醇誘導PHB在PC-3細胞中表達,見表1。
表1 重組質粒在不同培養基培養的PC-3細胞中螢光素酶表達的比較Table 1.Comparison of luciferase expression of recombinant plasmids in PC-3 cells cultured in different media(.n=3)
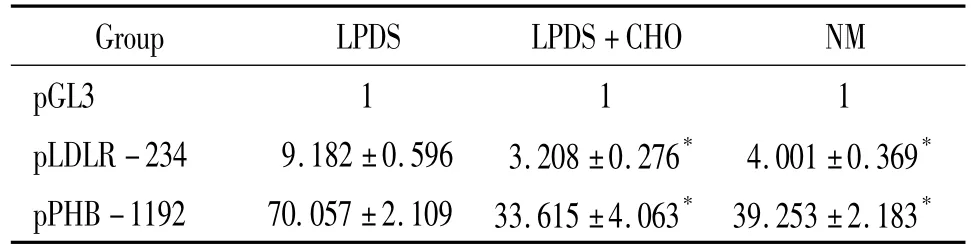
表1 重組質粒在不同培養基培養的PC-3細胞中螢光素酶表達的比較Table 1.Comparison of luciferase expression of recombinant plasmids in PC-3 cells cultured in different media(.n=3)
*P <0.05 vs LPDS in the same group.
Group LPDS LPDS+CHO NM pGL3 1 1 1 pLDLR -234 9.182 ±0.596 3.208 ±0.276* 4.001 ±0.369*pPHB -1192 70.057 ±2.109 33.615 ±4.063* 39.253 ±2.183*
討 論
研究發現,肥胖和多種疾病進展有關,進展期的前列腺癌膽固醇升高,高脂肪/膽固醇等“西方飲食”同前列腺癌的發病和進展密切相關[3]。尚未清楚為什么高膽固醇可改變信號分子和導致腫瘤細胞增生,目前研究表明是腫瘤細胞膜上的膽固醇變化導致固醇調節元件結合蛋白(sterol regulatory element-binding protein,SREBP)信號轉導,使前列腺癌表現出更強的侵襲性。細胞保持膽固醇的動態平衡的能力在很大程度上受到SREBP轉錄因子控制。這些SREBP由3個相關的轉錄因子組成:SREBP-1a、SREBP-1c、SREBP-2。SREBP-1a和 SREBP-1c定位于染色體17q11.2,由SREBP-1基因的不同啟動子編碼產生。SREBP-1a主要調控膽固醇和脂肪酸合酶,如HMG-CoA以及甘油三酯代謝的LDLR的基因轉錄;SREBP-1c選擇調控脂肪酸、甘油三酯。SREBP-2定位于22q13,主要調控膽固醇合成的甲羥戊酸基因如法呢基焦磷酸合酶和HMG-CoA還原酶[4]。
Heemers等[5]使用2個獨立的前列腺癌細胞系(LNCaP和MDA–Pca-2a)并且給予雄激素刺激,證實了在雄激素依賴的前列腺癌細胞系中普遍存在受雄激素協調刺激的LDLR和HMG-CoA表達,并且包括了SREBP途徑活化作用。Ettinger等[6]通過對前列腺癌LNCaP異種移植的裸鼠腫瘤模型研究發現,去勢后SREBP-1a、-1c和-2呈中等程度升高。在雄激素抵抗期(第21-28 d),SREBP-1a和1c表達較去勢前顯著升高。雄激素刺激導致固醇調節元件結合蛋白裂解激活蛋白(SREBP cleavageactivating protein,SCAP)增加。SCAP水平升高增加成熟SREBP產生和刺激脂肪生成基因表達。SCAP在去勢治療后降低而在雄激素抵抗期顯著升高。Montgomery等[7]分別對于人體原位及轉移前列腺癌及裸鼠移植的前列腺癌標本進行研究證實,雄激素抵抗的前列腺癌組織內的類固醇生成酶如FASN、CYP17A1、HSD3B1、HSD17B3、CYP19A1 和 UGT2B17均高于原位前列腺癌。
PHB基因是一種有效的腫瘤抑制基因,因其具有明顯的抗細胞增殖、抗腫瘤作用而得名。PHB能抑制細胞增殖,這種作用是細胞周期特異性的,主要在G期-S期之間發揮檢查點的作用,抑制核轉錄因子E2F的轉錄活性,調控Ras-MAPK信號轉導途徑,對于細胞生存至關重要[8]。PHB作為雄激素信號的目標蛋白,能夠抑制雄激素受體介導的轉錄和雄激素依賴的前列腺癌細胞增殖。Gamble等[9]研究發現在雄激素刺激增殖的前列腺癌LNCaP細胞中PHB表達下調超過50%,過度表達PHB抑制雄激素刺激的LNCaP細胞增殖,而抑制其表達則促進細胞增殖,提示PHB具有調控前列腺癌細胞增殖作用。此后研究證實,PHB作為雄激素受體(androgen receptor,AR)的核共遏制物,可能在前列腺癌進展為雄激素非依賴過程中發揮作用[10]。
研究發現,低氧條件下小鼠肝細胞膜和線粒體PHB水平依次增加,提示其在細胞感受外界環境氧變化、相關的細胞內信號轉導及低氧時細胞內的調節機制中發揮保護作用[11]。另外,PHB能夠抑制E2F介導的轉錄,從而保護人RAMOS B淋巴細胞免受DNA拓撲異構酶I抑制劑喜樹堿誘導的細胞凋亡[12]。在雌激素拮抗劑治療的乳腺癌細胞中同樣發現,PHB和共阻遏物 Brg1/Brm的高表達,PHB與E2F1和p53共定位到細胞核并能增強E2F1和p53介導的轉錄活動[13],從而發揮抗凋亡作用。這些研究表明,PHB通過抑制E2F介導的細胞轉錄發揮抑制細胞增殖的作用,從而使腫瘤細胞逃避雌激素拮抗劑誘導的細胞凋亡,最終導致激素非依賴性進展。
本研究以前列腺PC-3細胞為細胞模型,采用real-time PCR證實,在普通培養基中PC-3細胞中PHB mRNA低水平正常表達,在膽固醇缺乏條件作用48 h后,PHB表達顯著上調。克隆PHB啟動子基因片段并構建轉染質粒,并以LDLR啟動子質粒作為陽性對照,結果表明,PHB啟動子質粒在前列腺癌PC-3細胞中顯示出良好的轉錄活性,且在低膽固醇培養細胞中顯著表達上調。PHB上調抑制腫瘤細胞增殖,從而促進腫瘤細胞逃避抗腫瘤藥物和不良因素導致的細胞凋亡,這可能是前列腺癌內分泌治療有限、雄激素抵抗進展的重要原因之一。
由于本實驗僅在體外檢測了前列腺癌雄激素非依賴PC-3細胞中PHB表達情況,下一步實驗需要對多種前列腺癌細胞株進行檢測,并進一步分析PHB中膽固醇敏感作用位點,同時需模擬體內環境,構建實驗動物模型,為理解前列腺癌發生、發展和臨床前列腺癌治療和預防提供理論依據。
[1]Freedland SJ,Williams CD,Masko EM.Adiponectin and prostate cancer mortality:to be or not to be skinny?[J].Clin Chem,2010,56(1):1 -3.
[2]Zadra G,Priolo C,Patnaik A,et al.New strategies in prostate cancer:targeting lipogenic pathways and the energy sensor AMPK[J].Clin Cancer Res,2010,16(13):3322-3328.
[3]Davies BJ,Smaldone MC,Sadetsky N,et al.The impact of obesity on overall and cancer specific survival in men with prostate cancer[J].J Urol,2009,182(1):112 -117.
[4]Horton JD,Shah NA,Warrington JA,et al.Combined analysis of oligonucleotide microarray data from transgenic and knockout mice identifies direct SREBP target genes[J].Proc Natl Acad Sci USA,2003,100(21):12027 -12032.
[5]Heemers H,Maes B,Foufelle F,et al.Androgens stimulate lipogenic gene expression in prostate cancer cells by activation of the sterol regulatory element-binding protein cleavage activating protein/sterol regulatory elementbinding protein pathway[J].Mol Endocrinol,2001,15(10):1817-1828.
[6]Ettinger SL,Sobel R,Whitmore TG,et al.Dysregulation of sterol response element-binding proteins and downstream effectors in prostate cancer during progression to androgen independence[J].Cancer Res,2004,64(6):2212 -2221.
[7]Montgomery RB,Mostaghel EA,Vessella R,et al.Maintenance of intratumoral androgens in metastatic prostate cancer:a mechanism for castration-resistant tumor growth[J].Cancer Res,2008,68(11):4447 -4454.
[8]Rajalingam K,Wunder C,Brinkmann V,et al.Prohibitin is required for Ras-induced Raf-MEK-ERK activation and epithelial cell migration[J].Nat Cell Biol,2005,7(8):837-843.
[9]Gamble SC,Odontiadis M,Waxman J,et al.Androgens target prohibitin to regulate proliferation of prostate cancer cells[J].Oncogene,2004,23(17):2996 -3004.
[10]Gamble SC,Chotai D,Odontiadis M,et al.Prohibitin,a protein downregulated by androgens,represses androgen receptor activity[J].Oncogene,2007,26(12):1757 -1768.
[11]孫魯寧,張靜萍,孫搖嬌,等.低氧培養小鼠肝細胞膜蛋白的蛋白質組學研究[J].中國病理生理雜志,2011,27(2):338-342.
[12]Fusaro G,Wang S,Chellappan S.Differential regulation of Rb family proteins and prohibitin during camptothecininduced apoptosis[J].Oncogene,2002,21(29):4539-4548.
[13]Wang S,Zhang B,Faller DV.BRG1/BRM and prohibitin are required for growth suppression by estrogen antagonists[J].EMBO J,2004,23(11):2293 -2303.

