心肌營養素1誘導骨髓間充質干細胞分化為心肌樣細胞*
彭朝權, 高 雅, 項 鵬, 楊 珂, 鄒麗媛, 吳 曉
(1中山大學附屬第三醫院心內科,廣東 廣州 510630;2中山大學干細胞與組織工程研究中心,廣東 廣州 510080)
缺血性心臟病是全球高發的疾病之一,其本質是心肌細胞的不可逆喪失。目前臨床積極進行溶栓、介入等再灌注治療,但仍缺乏針對已經梗死心肌細胞再生的根本性治療方法,梗死心肌形成無收縮功能的瘢痕組織,導致心功能改變,最終導致心衰。干細胞的發現與再生醫學的發展為心肌細胞的再生帶來了新的希望,其中,成體骨髓間充質干細胞(mesenchymal stem cells,MSCs)易于獲取、擴增,具有多分化潛能,且免疫源性較低[1],甚至具有免疫抑制作用[2],是心肌細胞再生有前途的種子細胞。近年來,以5-氮雜胞苷(5-azacytidine,5-Aza)為先驅和代表,將MSCs誘導分化為有功能、乃至有電活動的心肌細胞的研究始終在進行[3]。新的誘導劑大致分為如下幾類:(1)細胞因子類,如血管內皮生成因子,胰島素樣生長因子,肝細胞生長因子,堿性成纖維細胞生長因子等;(2)炎癥因子類如白細胞介素-6,腎素、血管緊張素-Ⅰ、血管緊張素-Ⅱ等;(3)中醫藥類如黃芪甲甙、雙地龍、丹參酚酮、淫羊藿等。
心肌營養素1(cardiotrophin 1,CT-1)是白細胞介素-6細胞因子家族的一員,最早發現其促進細胞肥大的作用,在先天性心臟病、心肌病、進行性心力衰竭和心肌梗死等病理過程中均有過度表達。而CT-1誘導大鼠MSCs向心肌樣細胞分化的研究亦在進行[4],其結果提示:CT-1可輔助5-Aza提高誘導率,但未能獨立將MSCs誘導為心肌細胞。因此,本研究將探討CT-1在MSCs誘導分化為心肌細胞中的作用,明確其誘導功效。
材料和方法
1 材料
1.1 動物 小型豬1頭,6月齡,體重26 kg,雌性,南方醫科大學動物實驗中心提供(實驗動物合格證明編號No.0038589)。
1.2 主要器材 超凈工作臺,調溫低速離心機(Eppendorf),微型高速離心機(Eppendorf),Shel Lab 2323-2 CO2孵箱(Shel Lab),倒置顯微鏡(Olympus),電子天平,恒溫水浴箱(Shel Lab),純水儀,搖床,骨髓穿刺包等。
1.3 主要試劑 CT-1(Invitrogen),5-Aza(Sigma),1073 g/L Ficoll人淋巴細胞分離液(Pharmacia),鼠抗豬α-actin單克隆抗體(Santa Cruz),羊抗豬心肌特異性肌鈣蛋白T(cardiac specific troponin T,cTnT)多克隆抗體(Abcam),TRITC標記的羊抗小鼠 IgG(Protein Tech Group),Hoechst染色液,DMEM-F12培養基,胎牛血清,胰蛋白酶,肝素鈉注射液,Triton X-100,速眠新及4%多聚甲醛等。
2 方法
2.1 原代骨髓MSCs的分離、培養及擴增 全麻后,穿刺小型豬髂后上棘多點吸取約40-50 mL骨髓液(等量 PBS稀釋,肝素抗凝);加入 Ficoll液,2000 r/min離心20 min;吸取白膜層,加入等量PBS,1100 r/min離心4 min;去上清,加入用含 10%FBS的L-DMEM培養基重懸,按(2-3)×105/cm2的濃度接種于6孔板,置37℃、5%CO2、飽和濕度的孵箱培養。細胞80% -90%融合時,0.25%的胰蛋白酶消化,按1∶2比例傳代擴增至第4-6代,取對數生長期MSCs,消化離心,按1×107/L接種于24孔板,37℃、5%CO2、飽和濕度下培養。加入DMSO 250 μL,振蕩10 min。
2.2 MSCs分化能力的鑒定
①成骨誘導 將細胞按2×104/cm2密度接種于6孔板,生長至80%時,加成骨誘導液誘導,約12 d可見細胞聚集為鈣化結節,逐漸增多增大,21 d后鈣化結節行茜素紅染色。
②成脂誘導 將細胞按2×104/cm2密度接種于6孔板,生長至80%時,加成脂誘導液A誘導,3 d后換液并再予成脂B液誘導,如此循環約至14 d行油紅O染色。
2.3 多組誘導分化 將MSCs均勻接種于12孔板,每張板上分為4組,每組共3孔,組內處理方法相同,A:空白對照組(無血清培養基);B:5-Aza組(含10 μmol/L 5-Aza的無血清培養基);C:CT-1組(含0.1 μg/L CT-1的無血清培養基);D:合用組(10 μmol/L 5 -Aza+0.1 μg/L CT -1 的無血清培養基)。當細胞增殖至每孔面積的80%時,加入上述濃度誘導液作用24 h,用原10%胎牛血清培養基的L-DMEM換液,于 37℃、5%CO2的孵育箱中培養,不加任何干擾因素,隔3 d換液,觀察細胞形態。免疫熒光檢測以及計算細胞熒光陽性率:取誘導后28 d的細胞行α-actin和cTnT免疫熒光染色,并計數誘導后28 d各組細胞的陽性染色率。(1)0.01 mol/L PBS洗滌;(2)4%多聚甲醛固定,0.01 mol/L PBS洗滌;(3)0.2%Triton X-100穿透半小時,0.01 mol/L PBS洗滌;(4)滴加10%正常山羊血清封閉細胞;(5)棄血清后分別加入Ⅰ抗α-actin,cTnT(0.01 mol/L PBS 1∶200稀釋),陰性對照組用0.01 mol/L PBS替代;(6)濕盒中保存,4℃過夜;(7)予0.01 mol/L PBS洗滌;(8)在避光條件下加入TRITC結合1 h,予0.01 mol/L PBS洗滌;(9)Hoechst染色法染細胞核10 min,予0.01 mol/L PBS洗滌;(10)熒光顯微鏡下觀察,分別觀測藍色、紅色熒光。計數每個視野內的細胞數(N)和紅色熒光陽性細胞數(Ni);計算MSCs分化為心肌樣細胞的轉化率(Ni/N×100%)。
3 統計學處理
應用SPSS 13.0統計軟件對數據進行分析,數據以均數±標準差()表示。
結 果
1 西藏小型豬MSCs的培養情況
接種到6孔板的原代細胞,被大量紅細胞覆蓋,24 h后首次換液,隱約可見孔底少量貼壁細胞,1周可見多個長梭形細胞集落,見圖1A,核圓居中,含1-3個核仁。約12 d首次按2×104/cm2密度傳代,細胞貼壁后形態如前,約9-12 d密集生長至80%-90%,見圖1B,傳代繼續培養。

Figure 1.Morphology of the MSCs under an inverted microscope(×100).A:6 d after inoculation,spindle-shaped cells were observed;B:12 d after inoculation,MSCs reached 80% -90%.圖1 相差顯微鏡下MSCs形態學觀察
取第4代細胞行成骨誘導,約12 d可見細胞聚集為鈣化結節,逐漸增多增大,21 d后鈣化結節茜素紅染色陽性,見圖2A。進行成脂誘導,7 d后,細胞已由長梭形變為多角形,細胞體積逐漸增大,胞質內有圓球形半透明脂滴形成,部分細胞胞核擠向一側,第14 d行油紅O染色,胞核周圍紅染,見圖2B。
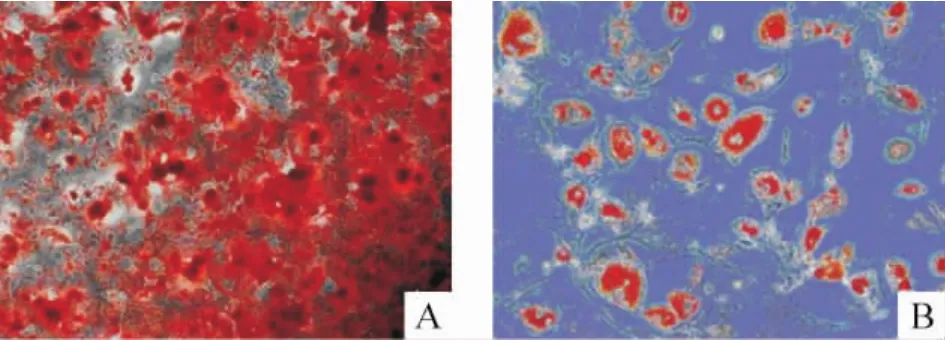
Figure 2.Osteogenic and adipogenic differentiation.A:alizarin red staining for osteogenesis on day 21,showing orange-red calcium nodules(×200);B:oil red O staining for adipogenesis on day 14(×400).These results indicate that MSCs are multipotent.圖2 MSCs成骨成脂分化結果
2 MSCs向心肌細胞誘導分化
誘導劑誘導后第14 d起,可見除空白對照組外,各組均有部分細胞形態變寬,體積逐漸增大,約21 d起,可見細胞生長減慢,細胞回縮變短,細胞聚集生長趨勢,細胞排列具有明顯的方向性,具有短棒狀結構及位于中心的細胞核,核/漿比例明顯降低,見圖3。培養至28 d,上述傾向仍明顯,但各組均有部分細胞形態漸趨扁平,胞核扁圓,出現空泡,并有少量細胞失去規則形態,核仁消失,細胞死亡。

Figure 3.Morphology of MSCs 28 d after induction with 5-Aza(×100).圖3 5-Aza誘導后28 d光鏡下觀察
3 細胞免疫熒光結果
按每組1個孔選3個400倍視野計數3次,取Hoechst法藍染的細胞核數為MSCs細胞總數,取明亮以及可見紅色熒光的細胞為陽性細胞。在熒光顯微鏡下,分別觀察各組藍色、紅色熒光的表達,并合成于同一幅圖片中,記錄其紅色熒光表達率。免疫熒光染色結果顯示,陰性對照組及空白對照組可見極少量紅色熒光光點,略呈圓形,形狀較正常MSCs小,有些周圍未見顯示藍色熒光的細胞核,提示可能為雜質所導致的假陽性,見圖4A、E。CT-1組、5-Aza組和合用組均可見部分細胞顯示紅色熒光,與顯示藍色熒光的細胞核重合。其中,合用組紅色熒光細胞數最多,見圖4B、C、D、F、G、H。其中 CT -1 組具有較典型的紅色熒光細胞的表達。
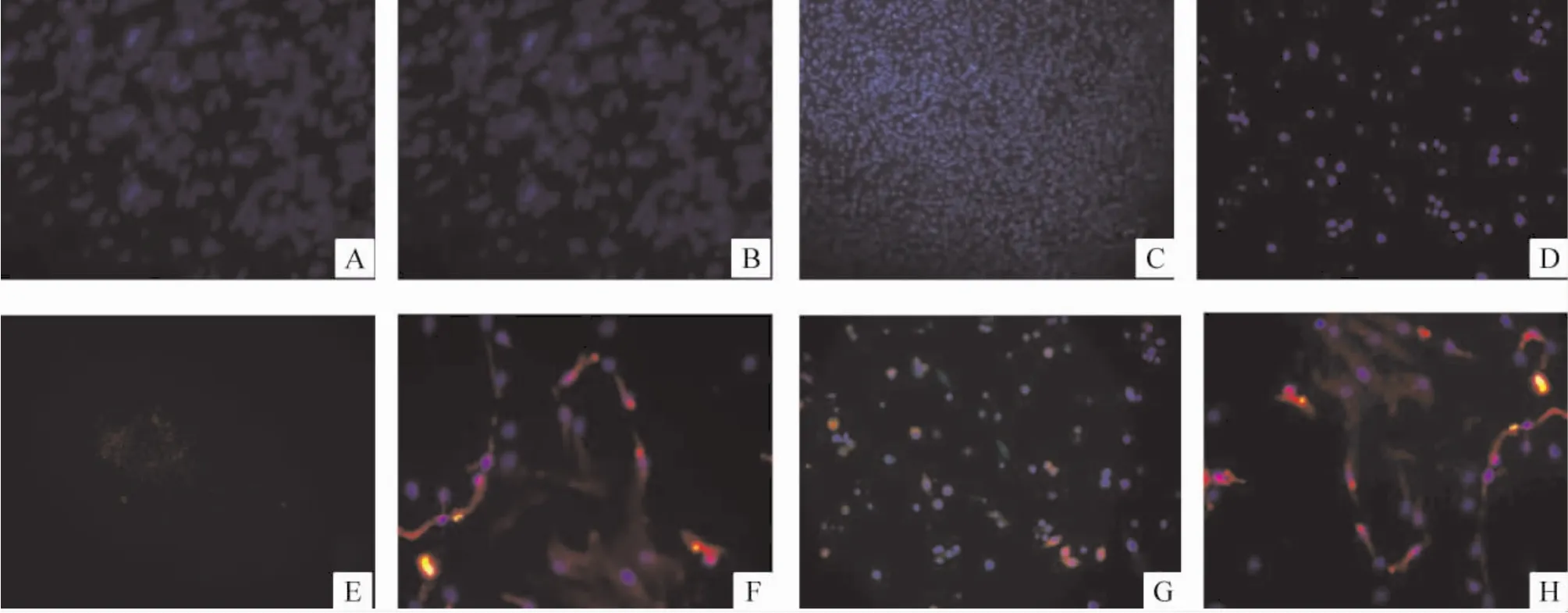
Figure 4.Immunofluorescence staining results in each group(×100).A:Hoechst nuclear dye in control group;B:Hoechst nuclear dye in CT-1 group;C:Hoechst nuclear dye in 5-Aza group;D:Hoechst nuclear dye in CT-1 and 5-Aza group;E:red fluorescence in control group;F:red fluorescence in CT-1 group;G:red fluorescence in 5-Aza group;H:Red fluorescence in CT-1 and 5-Aza group.圖4 各組細胞免疫熒光染色結果
4 各組分化為心肌細胞陽性率比較
由圖5可見,合用組的誘導分化心肌樣細胞αactin陽性率為29.90% ±4.76%,明顯大于5-Aza組(17.73% ±2.35%,P<0.01)、CT-1組(6.63%±0.55%,P<0.01)和空白對照組(1.62% ±0.09%,P<0.01);5-Aza組明顯大于CT-1組(P<0.01)和空白對照組(P<0.01);CT-1組明顯大于空白對照組(P<0.05)。
cTnT紅色熒光染色結果顯示,合用組的誘導分化心肌樣細胞cTnT陽性率為36.50% ±4.09%,明顯大于5-Aza組(14.37% ±1.65%,P<0.01)、CT-1組(7.50% ±0.61%,P<0.01)和空白對照組(1.12% ±0.23%,P<0.01);5-Aza組明顯大于CT-1組(P<0.01)和空白對照組(P<0.01);CT-1組明顯大于空白對照組(P<0.01)。
討 論
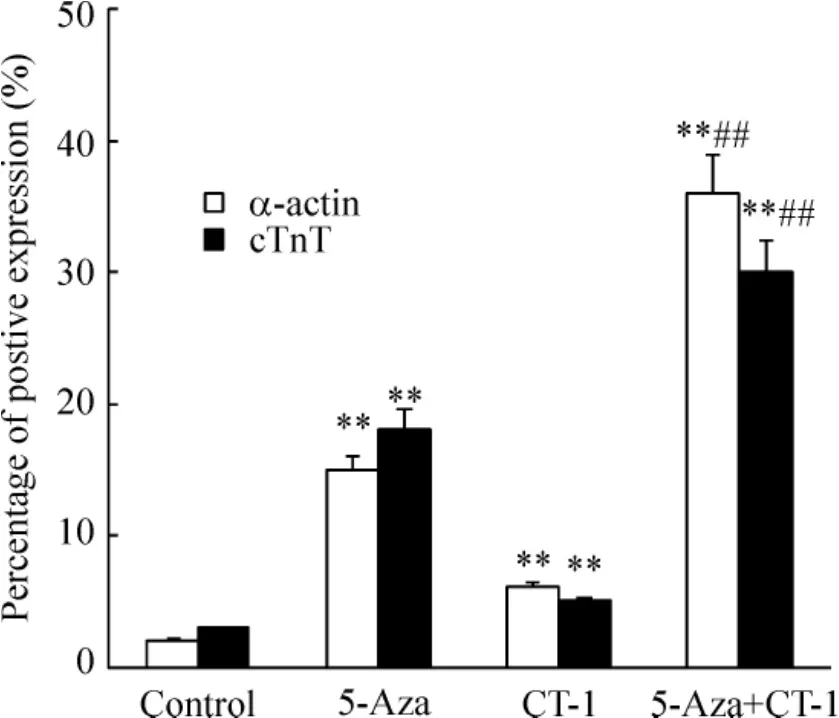
Figure 5.The percentage of positive expression of α - actin and cTnT in each group..n=3.**P<0.01 vs contnol;##P<0.01 vs CT-1 or 5-Aaz group.圖5 各組誘導分化細胞α-actin和cTnT陽性表達率
干細胞和前體細胞再生潛能的發現為從根本上治療心肌梗死和預防心梗后心衰提供了可能性,因此心肌細胞再生的實驗研究與臨床探索均在蓬勃開展[5]。MSCs易于獲取、分離、擴增,以及弱的免疫抗原性,尤其是易于外源基因的導入[6],且可保持其未分化特性,為作為基因載體治療遺傳缺陷性疾病奠定了基礎。要提高MSCs的療效,經基因修飾過度表達血管生成因子[7]、生長因子或干細胞歸巢因子等細胞因子作為旁分泌因子均為目前的研究熱點。動物實驗發現經過修飾的MSCs治療急性心肌梗死,比單純的細胞治療組和基因治療組能更好地改善心肌灌注、修復心臟功能[8]。另外,由于豬的心臟功能與結構均與人類相似度最高,是最常用的大型動物。因此,本課題選擇西藏小型豬MSCs為研究對象,為進一步的在體實驗打下基礎。此外,本實驗通過對細胞貼壁率及細胞活力觀察,表明我們分離到的西藏小型豬MSCs的存活能力很強,細胞穩定,存活率高,細胞生長狀況好。而對其分化潛能的測定方面,成骨與成脂均獲得較好的誘導效果,提示其具有良好的分化潛能。
CT-1是IL-6細胞因子家族的一員,能促使體外心肌細胞肥大,遂命名為心肌營養素 1[9]。在1995年研究高血壓心肌細胞肥大時被首次發現[10],后來CT-1又被發現在多種心臟病理過程中,均有過度表達,乃至于一段時間內被作為心血管疾病生物標記物被研究,進一步研究提示其水平的升高或許是機體的一種保護性反應,在對保持心臟正常功能及心臟疾病的發生、發展方面有重要意義[11]。gp130是IL-6細胞因子家族共有的信號轉導分子,為I型膜蛋白分子,由3部分組成:與配體結合的胞外區、有激酶活性的胞內區和跨膜區。gp130蛋白含918個氨基酸,其中信號肽和跨膜區各22個殘基,胞外區和胞漿區分別含597和277個殘基[12]。在心肌細胞,CT-1通過2條途徑起作用:一條是通過激活蛋白激酶/信號轉導子和轉錄激活子信號轉導通路(JAK/STAT3)途徑引起心肌肥大和保護心肌[9,12]。CT-1先與心肌細胞上的跨膜受體gp130/LIFR結合,gp130和白血病抑制因子受體β亞基酪氨酸磷酸化,促進二聚體,并與其特異性α受體結合,從而激活與受體相連的JAK1、JAK2和Tyk2等,并使信號轉導子與轉錄激活物3(STAT3)酪氨酸磷酸化形成二聚體,再轉位至核內與靶基因增強子元件結合激活轉錄,產生一系列與心肌肥厚有關的效應。Liao等[13]的研究亦表明,在心肌缺血-再灌注后注射CT-1能明顯對抗心肌缺血引起的損傷,這種保護作用通過蘇氨酸磷酸化激活蛋白激酶信號轉導通路(MAPK通路)的抑制而被拮抗,應用的MAPK特異性抑制劑PD98059能夠阻止MAPK的激活,阻斷CT-1促進心肌細胞生存的作用,導致細胞活力喪失。而有研究認為,MAPK途徑與分化終末的細胞存活有關[14]。亦有研究發現,當MAPK通路受抑制的同時,STAT3過度表達所誘導的心肌細胞肥大、部分mRNA的表達以及蛋白的合成也被抑制,說明這2條信號轉導通路在心肌細胞肥大中發生了“交叉對話”,互相影響,互相聯系,形成復雜的網絡系統,進而表現為CT-1的多種生物學功能[15]。
Makino等[3]將從小鼠骨髓中分離出的MSCs連續傳代,得到永生型細胞,在5-Aza的作用下誘導分化,1周后觀察到約30%MSCs細胞形態發生改變,細胞體積變大,向同一方向延展成棒狀,2周后與周圍細胞相連。3周后通過閏盤與相鄰細胞連接,形成微管樣結構。此后國內外多次報道并證實相關結論。從而為MSCs誘導分化成為心肌細胞用于細胞移植與基因治療提供了實驗依據。但上述相關報道的動物模型多為以嚙齒類動物如大鼠、小鼠。
關于大型動物模型西藏小型豬MSCs經5-Aza誘導分化為心肌細胞的報道尚不多見。因此本課題選擇5-Aza作為陽性對照的誘導劑,并在預實驗中嘗試了從2.5 μmol/L到20 μmol/L等多種濃度,驗證10 μmol/L的誘導濃度下,細胞的形態變化較明顯,且細胞毒性較小;而當濃度為15 μmol/L及以上時,加入誘導劑24 h內,部分細胞即出現皺縮,喪失貼壁狀態,聚集成團脫落。因此實驗組均選擇10 μmol/L的誘導濃度。本課題的結果證實了5-Aza對于西藏小型豬MSCs的誘導分化能力。另外,亦有研究表明:部分未經化學誘導的MSCs經長期傳代后,持續培養,生長至融合時亦可出現肌管樣結構,因而認為MSCs具有長期傳代增殖后,可自發出現肌源性轉化的生物學生長特性,而非必然是誘導的結果[16]。因此本課題在設置空白對照組的同時,亦設置了相應的陰性對照組,并選擇了第6代細胞進行誘導。實驗結果表明,空白對照組的誘導陽性率與陰性對照組的誘導陽性率相比較,其差異無統計學意義,說明第6代MSCs持續培養28 d時,未出現明顯的自發性肌源性轉化。而5-Aza組的MSCs出現了部分細胞表達心肌細胞特異性抗原,說明5-Aza能夠將小型豬MSCs誘導成為心肌樣細胞。但是,對于所謂“心肌樣細胞”的認定,如有條件,可行電鏡觀察細胞的超微結構,并進一步從分子生物學水平研究細胞表達的情況,并研究細胞的電生理活動情況及細胞之間的聯系。
本課題選擇CT-1作為一種有前途的誘導劑進行研究,并以5-Aza作為陽性對照,研究CT-1誘導西藏小型豬MSCs分化為心肌樣細胞中的作用。CT-1說明書中以0.1 μg/L作為其毒性作用濃度的上限,因此在預實驗中,我們設置了0.1 μg/L、0.05 μg/L、0.025 μg/L濃度組。在誘導作用1 d后,各組均未出現明顯的細胞中毒及死亡情況。在連續培養28 d后,各組死亡及狀態差的比例未觀察到明顯的差異。因此,在正式實驗中,確定0.1 μg/L作為誘導濃度。在最終的誘導結果中,CT-1組的誘導率與空白對照組有顯著差異,證實了0.1 μg/L的CT-1能夠單獨在體外誘導西藏小型豬MSCs轉化為心肌樣細胞,誘導后的細胞獲得部分心肌細胞特異性蛋白(α-actin、cTnT)的表達。而在合用組中,CT-1(0.1 μg/L)與 5 - Aza(10 μmol/L)合用能夠顯著提高西藏小型豬MSCs轉化為心肌樣細胞的誘導率。CT-1能夠將西藏小型豬MSCs誘導分化為心肌樣細胞,其誘導率高于空白對照組(P<0.05),但低于5-Aza組(P<0.01);而CT-1與5-Aza的合用誘導液誘導分化的效率與單獨的5-Aza組比較,效率顯著提高,其差異顯著(P<0.01)。因此我們認為CT-1和5-Aza均可以誘導MSCs向心肌樣細胞分化,這為下一步用CT-1修飾MSCs移植治療急性心肌梗死提供實驗依據。
[1]Ozawa K,Sato K,Oh I,et al.Cell and gene therapy using mesenchymal stem cells[J].J Autoimmun,2008,30(3):121-127.
[2]Laflamme MA,Chen KY,Naumova AV.Cardiomyocytes derived from human embryonic stem cells in pro-survival factors enhance function of infarcted rat hearts[J].Nat Biotechnol,2007,25(9):1015 -1024.
[3]Makino S,Fukuda K,Miyoshi S,et al.Cardiomyocytes can be generated from marrow stromal cells in vitro[J].Clin Invest,1999,103(5):697 -705.
[4]陳新云,曾 智,饒 莉,等.心臟營養素-1對骨髓間充質干細胞分化為心肌樣細胞的作用[J].四川大學學報(醫學版),2009,40(1):85-89.
[5]Segers VF,Lee RT.Stem -cell therapy for cardiac disease[J].Nature,2008,451(7181):937 -942.
[6]Caplan A.Adult mesenchymal stem cells for tissue engineering versus regenerative medicine[J].J Cell Physiol,2007,213(2):341–347.
[7]陳柏齡,陳東平,張志堅,等.Ang-1基因修飾的骨髓間充質干細胞移植治療腦梗死的實驗研究[J].中國病理生理雜志,2009,25(2):241-247.
[8]Breitbach M,Bostani T,Roell W,et al.Potential risks of bone marrow cell transplantation into infarcted hearts[J].Blood,2007,110(4):1362-1369.
[9]Heinrich PC,Behrmann I,Muller-Newen G,et al.Interleukin-6 type cytokine signalling through the gp130/Jak/STAT pathway[J].Biochem J,1998,334(Pt 2):297–314.
[10]Pennica D,King KL,Shaw KJ,et al.Expression cloning of cardiotrophin 1,a cytokine that induces cardiac myocyte hypertrophy[J].Proc Natl Acad Sci USA,1995,92(4):1142-1146.
[11]Clerico A.The increasing impact of laboratory medicine on clinical cardiology[J].Clin Chem Lab Med,2003,41(7):871-883.
[12]Wollert KC,Taga T,Saito M,et al.Cardiotrophin-1 activates a distinct form of cardiac muscle cell hypertrophy.Assembly of sarcomeric units in series via gp130/leukemia inhibitory factor receptor 2 dependent pathways[J].J Biol Chem,1996,271(16):9535-9545.
[13]Liao R,Pfister O,Jain M,et al.The bone marrow–cardiac axis of myocardial regeneration[J].Prog Cardiovasc Dis,2007,50(1):18 -30.
[14]Sheng Z,Knowlton K,Chen J,et al.Cardiotrophin -1(CT-1)inhibition of cardiac myocyte apoptosis via a mitogen-activated protein kinase-dependent pathway.Divergence from downstream CT-1 signals for myocardial cell hypertrophy[J].J Biol Chem,1997,272(9):5783–5791.
[15]Calabrò P,Limongelli G,Riegler L,et al.Novel insights into the role of cardiotrophin-1 in cardiovascular diseases[J].J Mol Cell Cardiol,2009,46(2):142 -148.
[16]Liu Y,Song J,Liu WX,et al.Growth and differentiation of rat bone marrow stromal cells:does 5-azacytidine trigger their cardiomyogenic differentiation?[J].Cardiovas Res,2003,58(2):460 -468.

