尾加壓素Ⅱ對心肌成纖維細胞表型轉換的影響
邵志凌,何學心,向謹逸
(1.武漢鐵路局社會保險管理處,武漢 430071;2.華中科技大學同濟醫學院藥學院,武漢 430030;3.華中科技大學同濟醫學院分子生物學系,武漢 430030)
心肌纖維化指心肌間質膠原纖維過量積聚或成分發生改變[1],是導致心功能不全、心律失常及慢性心力衰竭難以逆轉的最主要病理損傷之一[2]。心肌成纖維細胞(cardiac fibroblasts,CFs)是心肌間質主要構成細胞,其增殖、表型轉換為肌成纖維細胞并合成分泌大量膠原纖維蛋白。尾加壓素Ⅱ(urotensinⅡ,UⅡ)最早是1985年自硬骨魚的脊髓尾部神經分泌系統分離出來的一種生長抑素樣環肽,屬于神經肽范圍[3]。目前研究已證實,UⅡ能促進CFs增殖[4],但筆者尚未見UⅡ對其表型轉換作用的報道。筆者在本研究以培養的新生乳鼠心肌成纖維細胞為實驗模型,觀察不同濃度UⅡ對I型膠原蛋白分泌及其表型轉換的標志蛋白α-平滑肌肌動蛋白(α-smooth muscle actin,α-SMA)表達的影響,并研究其對細胞外調節蛋白激酶(extracellular regulated protein kinases,ERK)磷酸化的作用,旨在進一步探討UⅡ誘導心肌纖維化的作用機制。
1 材料與方法
1.1 材料 1 d齡新生SD乳鼠,由華中科技大學同濟醫學院實驗動物中心提供,動物許可證號:Scxk(鄂)2004-0007。UⅡ、抑肽酶(aprotinin)和亮肽酶素(leupeptin)均為Sigma公司產品、達爾伯克必需基本培養基(Dulbecco's minimum essential medium,DMEM)培養基、胰蛋白酶和胎牛血清(Gibco公司),小鼠抗大鼠p-ERK1/2單克隆抗體(Santa Cruz公司)。I型膠原(Col I)ELISA試劑盒(上海森雄)。其余試劑為國產分析純。垂直電泳儀及轉膜系統(Biorad公司),細胞顯像系統(德國LEICA DC200)。
1.2 方法
1.2.1 細胞培養和試驗分組 取1d齡的SD乳鼠,在無菌條件下開胸剪取心室肌,剪碎心肌,0.1%胰蛋白酶消化后,加入含10%胎牛血清的DMEM培養液制成細胞懸液,調整細胞密度為105個·mL-1,采用差速貼壁1 h,獲得成纖維細胞。繼續培養細胞至近融合狀態時按1∶2傳代。傳代后成纖維細胞純度達到95%。實驗用第2或第3代的細胞。按照處理因素不同,分為4組,對照組,給予0.9%氯化鈉溶液,UⅡ低、中、高劑量組分別給予 10-10,10-9,10-8mol·L-1UⅡ。
1.2.2 酶聯免疫吸附測定(enzyme-linked immunosorbent assay,ELISA)法檢測細胞上清液中Ⅰ型膠原含量 CFs均勻接種到100mL培養瓶中,放置在37℃、5%二氧化碳(CO2)及飽和濕度條件下培養箱中進行培養。待細胞將近長滿培養瓶底時,吸出培養液,對照組換用無血清培養液。繼續培養48 h后收集上清液,ELISA法檢測各組I型膠原含量。
1.2.3 免疫熒光 成纖維細胞用3.7%多聚甲醛固定。以0.3%的Triton X-100破膜后與異硫氰酸熒光素(fluorescein isothiocyanate,FITC)標記的 α-SMA 抗體孵育。熒光顯微鏡下觀察免疫熒光標記的成纖維細胞α-SMA表達。
1.2.4 免疫印跡法檢測 ERK磷酸化和 α-SMA表達 常規裂解細胞提取總蛋白,檢測 p-ERK1/2和 α-SMA表達。取蛋白50 μg加入上樣緩沖液煮沸3 min變性,經SDS-PAGE凝膠電泳,再電轉移至聚二氟乙烯(polyvinylidene difluoride,PVDF)膜,封閉后與 1∶1 000稀釋的一抗4℃孵育過夜,與1∶20 000稀釋的二抗室溫孵育l h,再與ECL溫浴l min后曝光、顯影和定影,最后對結果進行吸光度掃描分析。
2 結果
2.1 UⅡ對心肌成纖維細胞上清液Ⅰ型膠原含量的影響 心肌成纖維細胞經不同濃度UⅡ刺激24 h后,ELISA結果顯示隨UⅡ濃度升高,各組I型膠原合成量升高,與對照組比較差異有統計學意義(P<0.05或P<0.01),見圖1。
2.2 UⅡ對心肌成纖維細胞α-SMA表達的影響 用刺激因素處理24 h后,免疫熒光法測定心肌細胞α-SMA表達見圖2。經不同濃度UⅡ作用后,細胞質內α-SMA明顯濃集增粗。進一步以免疫印跡法測定α-SMA表達,見圖3,結果亦提示UⅡ能明顯提高α-SMA表達,且各濃度組和對照組比較均差異有統計學意義(P<0.05 或 P<0.01)。

圖1 4組心肌成纖維細胞Ⅰ型膠原分泌結果A.對照組;B.UⅡ低劑量組;C.UⅡ中劑量組;D.UⅡ高劑量組;與對照組比較,*1P<0.05,*2P<0.01Fig.1 Effects of U Ⅱ on the type I collagen of 4 groupsA.control group;B.low dose of UⅡ group;C.medium dose of U Ⅱ group;D.high dose of UⅡ group;Compared with the control group,*1P<0.05,*2P<0.01

圖2 4組心肌成纖維細胞α-SMA表達的免疫熒光圖A.對照組;B.UⅡ低劑量組;C.UⅡ中劑量組;D.UⅡ高劑量組Fig.2 EffectsofU IIon α-SMA expressionby immunocytochemistry in 4 groupsA.control group;B.low dose of UⅡ group;C.medium dose of UⅡ group;D.high dose of UⅡ group
2.3 UⅡ對心肌成纖維細胞ERK磷酸化的影響 為進一步探討UⅡ誘導心肌成纖維細胞表型轉換的機制,用免疫印跡法檢測各組p-ERK1/2表達,結果顯示UⅡ顯著提高p-ERK1/2表達,與對照組比較均差異有統計學意義(P<0.05 或 P<0.01)。見圖4。
2.4 ERK阻斷劑PD98059對UⅡ促進CFs表型轉換的影響 為進一步證實ERK通路在UⅡ誘導心肌成纖維細胞表型轉換中起重要作用,檢測ERK阻斷藥PD98059(2×10-5mol·L-1)對 α-SMA 的表達,結果顯示UⅡ(10-8mol·L-1)能顯著提高CFs表型轉換標志蛋白α-SMA的表達,以上效應能被PD98059明顯減弱,統計學處理差異有統計學意義。見圖5。
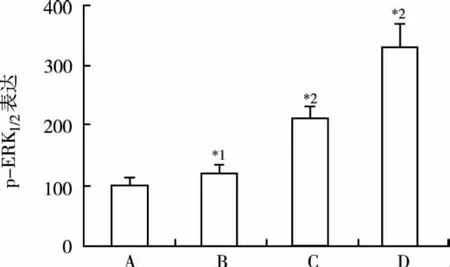
圖4 UⅡ對ERK磷酸化的影響A.對照組;B.UⅡ低劑量組;C.UⅡ中劑量組;D.UⅡ高劑量組;與對照組比較,*1P<0.05,*2P<0.01Fig.4 Effects of UⅡ on ERK phosphorylation in 4 groupsA.control group;B.low dose of UⅡ group;C.medium dose of UⅡ group;D.high dose of U II group;Compared with the control group,*1P<0.05,*2P<0.01
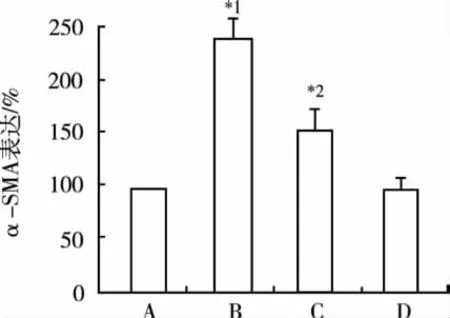
圖5 PD98059對UⅡ促進CFs表型轉換的影響A.對照組;B.UⅡ組;C.UⅡ+PD98059組;D.PD98059 組;與對照組比較,*1P<0.05,與 U Ⅱ組比較,*2P<0.05Fig.5 Effects of PD98059 on phenotypic transition of cardiac fibroblasts enhanced by UⅡA.control group;B.U Ⅱ group;C.U Ⅱ+PD98059 group;D.PD98059 group;Compared with the control group,*1P<0.05;Compared to the U Ⅱ group,*2P<0.05
3 討論
CFs是合成和分泌心臟細胞外基質的主要細胞類型,受刺激后活化,發生表型和功能的改變,成為表達α-SMA的肌成纖維細胞、過度增殖并產生大量的細胞外基質,如Col I等[1-2]。心肌組織、冠狀動脈粥樣硬化斑塊以及脂質沉積的平滑肌細胞和巨噬細胞富含UⅡ,提示UⅡ可能影響心血管的穩態調節和病理過程[5]。此外,研究報道充血性心力衰竭、心肌肥大患者的血漿UⅡ濃度顯著增高[6-8]。UⅡ還有刺激體外培養的新生鼠心肌纖維原細胞的原骨膠原αI、αⅢ和纖維原mRNA表達水平上升[9]。但目前尚無UⅡ對心肌成纖維細胞表型轉換的影響的相關報道。
本研究利用體外培養的新生乳鼠心肌成纖維細胞,結果顯示,各濃度UⅡ作用后,心肌成纖維細胞上清液中Ⅰ型膠原含量顯著提高、胞內α-SMA表達明顯增高濃集。以上結果提示UⅡ能促進心肌成纖維細胞表型轉換。進一步研究UⅡ能促進心肌成纖維細胞表型轉換的機制。本實驗發現UⅡ能夠明顯上調ERK活性。ERK是絲裂原活化的蛋白激酶MAPKs之一。ERK途徑是細胞生長、分化與存活等過程的重要信號轉導機制。ERK通過磷酸化下游效應分子使它們活化,繼而激活作用于下游的轉錄因子,調節相關基因轉錄,從而導致心肌成纖維細胞表型轉換[10-12]。而給予PD98059后,α-SMA表達明顯下調,進一步確定ERK通路在UⅡ誘導心肌成纖維細胞表型轉換中起重要作用
綜上所述,UⅡ可以明顯地促進CFs表型轉換為肌成纖維細胞,并分泌大量I型膠原。ERK途徑在其機制占有重要地位。后續研究將著重于UⅡ對ERK下游信號分子的影響。
[1]LEASK A.Potential therapeutic targets for cardiac fibrosis:TGFbeta,angiotensin,endothelin,CCN2,and PDGF,partners in fibroblast activation[J].Circ Res,2010,106(11):1675-1680.
[2]PORTER K E,TURNER N A.Cardiac fibroblasts:at the heart of myocardial remodeling[J].Pharmacol Ther,2009,123(2):255-278.
[3]COULOUARN Y,LIHRMANN I,JEGOU S,et al.Cloning of the cDNA encoding the urotensinⅡprecursor in frog and human reveals intense expression of the urotensinⅡgene in motoneurons of the spinal cord[J].Proc Natl Acad Sci USA,1998,95(26):15803-15808.
[4]CHEN Y L,LIU J C,LOH S H,et al.Involvement of reactive oxygen species in urotensin Ⅱ-induced proliferation of cardiac fibroblasts[J].Eur J Pharmacol,2008,593(1-3):24-29.
[5]LEHMANN F,CURRIER E A,CLEMONS B,et al.Novel and potent small-molecule urotensinⅡreceptor agonists[J].Bioorg Med Chem,2009,17(13):4657-4665.
[6]RUSSELL F D.Urotensin Ⅱ in cardiovascular regulation[J].Vasc Health Risk Manag,2008,4(4):775-785.
[7]DESAI N,SAJJAD J,FRISHMAN W H.Urotensin Ⅱ:a new pharmacologic target in the treatment of cardiovascular disease[J].Cardiol Rev,2008,16(3):142-153.
[8]DO REGO J C,LEPRINCE J,SCALBERT E,et a1.Behavioral actions of urotensin-II[J].Peptides,2008,29(5):838-844.
[9]PAPADOPOULOS P,BOUSETTE N,GIAID A.Urotensin-II and cardiovascular remodeling[J].Peptides,2008,29(5):764-769.
[10]PHAN S H.Biology of fibroblasts and myofibroblasts[J].Proc Am Thorac Soc,2008,5(3):334-337.
[11]HINZ B,PHAN S H,THANNICKAL V J,et al.The myofibroblast:one function,multiple origins[J].Am J Pathol,2007,170(6):1807-1816.
[12]SATO M,HIRAYAMA S,LARA-GUERRA H,et al.MMP-dependent migration of extrapulmonary myofibroblast progenitors contributing to posttransplant airway fibrosis in the lung[J].Am J Transplant,2009,9(5):1027-1036.

