林可霉素生物合成基因簇中調控基因lmbU的功能研究
陳 林,王增亮,趙群飛,高淑紅,葉蕊芳
(1.華東理工大學 生物反應器工程國家重點實驗室,上海 200237;2.中國科學院上海有機化學研究所,上海 200032)
林可霉素(Lincomycin)是由林可鏈霉菌(Streptomyceslincolnensis)產生的第一代林可酰胺類抗生素,主要用于治療革蘭氏陽性菌所引起的感染。因其對組織和細胞穿透力強,應用方便(不需皮試),廣泛應用于臨床[1,2]。我國自1975年工業生產林可霉素以來,通過菌種選育和工藝改進,生產水平不斷提高,但仍然與國際先進水平存在較大的差距。
近年來,隨著基因組學和DNA重組技術的快速發展,人們可以合理、定向且高效地對微生物細胞內生物合成相關的基因進行遺傳改造。相比盲目、隨機的傳統誘變方法(如自然選育、誘變育種、原生質體融合等),合理的遺傳改造更能特異地提高目標產物的產量和純度。
遺傳改造的關鍵是在基因和蛋白功能水平上認識和理解復雜天然產物的生物合成和調控機制。早在20世紀90年代,35 kb包含完整林可霉素生物合成基因簇的DNA序列就已被克隆[3,4],但到目前為止,對林可霉素生物合成基因功能的相關研究仍然很少,基本上都局限在序列比對和生物信息學分析基礎上進行的推測。
根據對林可霉素生物合成基因的生物信息學分析,推測該基因簇中的基因lmbU是林可霉素生物合成的調控基因。作者采用同框敲除和基因倍增的方式對S.lincolnensisN9的lmbU基因功能進行初步的研究,為遺傳改造林可霉素生產菌以提高林可霉素的產量做出有益的探索。
1 實驗
1.1 菌種與質粒
林可鏈霉菌S.lincolnensisN9,自行保藏;大腸桿菌E.coliDH5α、E.coliET12567(pUZ8002)[5]、克隆質粒pSP72、溫敏性質粒pKC1139[6]、整合型載體pSOK804[7][含有接合轉移復制子oriT和安普霉素Apramycin抗性基因aac(3)IV]、質粒pLL6214(攜帶紅色糖多孢菌紅霉素強啟動子ermE*),中科院上海有機化學研究所生命有機化學國家重點實驗室。分子生物學常規操作方法參照文獻[8]。
1.2 培養基
LB(Luria-Bertani)培養基:10.0 g胰蛋白胨,10.0 g酵母抽提物,5.0 g氯化鈉,蒸餾水定容至1 L。固體培養基另加20.0 g瓊脂。
TSB培養基:30 gTSB,蒸餾水定容至1 L。
MS培養基:20.0 g黃豆餅粉,20.0 g甘露醇,20.0 g瓊脂粉,自來水定容至1 L。
1.3 重組質粒pLIN-DU、pLIN-U的構建
1.3.1 引物設計
根據2008年6月公布的S.lincolnensisATCC 25466林可霉素生物合成基因簇序列信息(Accession No.EU 124663)設計相關引物。PCR克隆基因lmbU左臂所用引物為UL-F:5′-ATAGAATTC(EcoRⅠ)CCTGGAGGTAGTGGAACGCG-3′,UL-R:5′-ATAAAGCTT(HindⅢ)GGCACATCGCGTCGGAGTAC-3′;PCR克隆基因lmbU右臂所用引物為UR-F:5′-ATAAAGCTT(HindⅢ)GTCGCTGTACCGGGTCTGAC-3′,UR-R:5′-ATATCTAGA(XbaⅠ)CGACAGGCTCAGGAATCGGC-3′。
同時,為了利用lmbU基因自身的啟動子,設計引物時往基因lmbU上游延伸了200 bp左右。獲取基因lmbU的上游引物LIN-4-F:5′-GCTCTAGA(XbaⅠ)GCAATGATGCTGGTTCCGCCAAGC-3′和下游引物LIN-4-R:5′-CCCAAGCTT(HindⅢ)ACTAGT(SpeⅠ)GTGGAGGTGATGGCTGGTGGGCAG-3′。
1.3.2 質粒構建過程
PCR擴增反應在Eppendoff熱循環儀上進行,條件為:94 ℃預變性4 min,94 ℃變性1 min,62 ℃退火1 min,72 ℃延伸2 min,30個循環,72 ℃繼續延伸10 min;采用1%的瓊脂糖凝膠電泳回收目標條帶;將EcoRⅠ/HindⅢ酶切后的左臂UL(1.77 kb)、HindⅢ/XbaⅠ酶切后的右臂UR(1.74 kb)、XbaⅠ/HindⅢ酶切后lmbU基因片段(0.95 kb)分別連入pSP72相應位點后獲得重組克隆質粒pCLDU-1、pCLDU-2、pCLU-1,由英駿生物技術有限公司測序驗證。
用限制性酶EcoRⅠ/HindⅢ和XbaⅠ/HindⅢ分別從測序正確的克隆質粒pCLDU-1和pCLDU-2上酶切下左臂UL和右臂UR,克隆至EcoRⅠ/XbaⅠ酶切后的pKC1139質粒上,獲得重組質粒pLIN-DU(如圖1所示)。同理,用限制性酶XbaⅠ/HindⅢ從測序正確的克隆質粒pCLU-1上酶切下lmbU基因片段,克隆至XbaⅠ/HindⅢ酶切后的pLL6214質粒上,獲得質粒pCLU-2;再用EcoRⅠ/HindⅢ酶切下1.44 kb含紅霉素啟動子和lmbU基因的目的片段,克隆至EcoRⅠ/HindⅢ酶切后的pSOK804載體上,獲得重組質粒pLIN-U(如圖2所示)。

圖1 重組質粒pLIN-DU的構建

圖2 重組質粒pLIN-U的構建
1.4 突變菌的獲得與驗證
將構建正確的重組質粒pLIN-DU、pLIN-U分別轉化到大腸桿菌E.coliET12567(pUZ8002)中,通過屬間接合轉移[9]方式導入到S.lincolnensisN9。獲得接合子之后,用于中斷lmbU基因的接合子在Am抗性篩選條件下37 ℃培養,利用pKC1139質粒上的溫敏性復制子,促使質粒與鏈霉菌基因組發生第一次同源重組,然后置于無抗條件下30 ℃松弛培養2~3代,使兩者發生第二次同源重組,獲得發生雙交換后的突變菌LIN-DU;用于倍增lmbU基因的接合子依照pSOK804載體上的整合特點可直接視為突變菌LIN-U。
獲得突變菌后,用引物DU-F:5′-GGTCATG GAGGCGGATGTTG-3′ 和DU-R:5′-CGGTGA CCCAAAGGGCAAGA-3′以及引物PermE-F:5′-GAATTCGGTACCAGCCCGACCCGAG-3′和LIN-4-R對突變菌LIN-DU、LIN-U分別進行PCR驗證。
1.5 突變菌的發酵驗證
突變菌發酵采用二級培養的方法。以出發菌S.lincolnensisN9為對照,于30 ℃、220 r·min-1下搖瓶發酵,在種子培養基中培養2 d后轉接入二級發酵培養基,發酵7 d。為判斷不同基因型對林可霉素生物合成造成的差異,對于突變菌和出發菌采用相同的發酵條件,盡量減少發酵過程對其表型的影響。
1.6 分析與檢測
發酵液效價測定采用杯碟法。
LC-MS檢測條件:采用Phenomenex Luna 5u C18色譜柱(4.6 mm×250 mm);檢測波長為210 nm;流動相為5 mmol·L-1乙酸銨水溶液∶甲醇(40∶60);恒梯度洗脫,流速為0.6 mL·min-1;進樣量為20 μL。
2 結果與討論
2.1 重組質粒pLIN-DU、pLIN-U的驗證
獲得重組質粒pLIN-DU、pLIN-U后,分別用XhoⅠ和BglⅡ兩組單酶切體系、EcoRⅠ/HindⅢ和XbaⅠ/HindⅢ兩組雙酶切體系進行酶切驗證,結果如圖3所示。
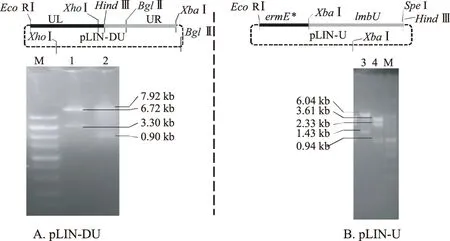
M.DNA Marker DL5000 1,2.pLIN-DU 3,4.pLIN-U
用XhoⅠ單酶切pLIN-DU會形成大小分別為6.72 kb和3.30 kb的目標條帶,用BglⅡ單酶切pLIN-DU會形成大小分別為7.92 kb和0.90 kb的目標條帶。由圖3A可知,lmbU左右臂拼接的片段(UL和UR)成功插入質粒pKC1139中。
用EcoRⅠ/HindⅢ雙酶切pLIN-U會形成大小分別為6.04 kb和1.43 kb的目標條帶;而用XbaⅠ/HindⅢ雙酶切pLIN-U會形成大小分別為3.61 kb、2.33 kb和0.94 kb的目標條帶。由圖3B可知,外源重組基因片段ermE*+lmbU成功插入載體pSOK804中。以上驗證結果表明重組質粒pLIN-DU、pLIN-U均可用于后續遺傳操作。
2.2 突變菌LIN-DU、LIN-U的PCR驗證

圖4 突變菌LIN-DU的同框敲除示意圖
重組質粒pLIN-DU導入出發菌S.lincolnensisN9中會與染色體發生兩次同源重組(原理如圖4所示)從而使得lmbU基因內部序列缺失195 bp。因此,可通過在基因lmbU左右臂內部設計一對引物DU-F和DU-R對突變菌進行PCR驗證。若是野生型或回復突變型菌株,染色體上lmbU基因是完整的,PCR擴增的條帶大小約為1.10 kb左右;而突變菌LIN-DU染色體上lmbU基因內部序列有缺失,PCR只能擴增出大小約為0.90 kb左右的條帶。PCR驗證結果如圖5所示。
而重組質粒pLIN-U導入出發菌S.lincolnensisN9中后,外源重組片段ermE*+lmbU會隨著載體pSOK804與染色體上特異位點的整合而一并插入菌株染色體中。可利用外源重組片段ermE*+lmbU兩端的引物PermE-F和LIN-4-R對突變菌的總DNA進行PCR驗證。若是質粒成功導入出發菌株,則會擴增出大小約為1.66 kb的目標條帶,而出發菌株S.lincolnensisN9則不會。PCR驗證結果如圖5所示。

M.DNA Marker DL5000 1.突變菌LIN-DU的總DNA 2,3.出發菌S.lincolnensis N9的總DNA 4.突變菌LIN-U的總DNA
由圖5可知,PCR驗證實驗結果與預想的完全一致,突變菌LIN-DU中lmbU基因內部序列發生了缺失、突變菌LIN-U中成功倍增了lmbU基因,均可用于后續的發酵驗證。
2.3 突變菌LIN-DU、LIN-U的發酵驗證
對照菌N9、突變菌LIN-DU、LIN-U發酵液效價測定結果如圖6所示。由圖6可知,對照菌N9的效價為3204 U·mL-1,突變菌LIN-DU、LIN-U的效價分別為100.30 U·mL-1、3219 U·mL-1。由于突變菌LIN-DU杯碟法測其效價非常低,又對其發酵液進行了LC-MS測定,結果如圖7所示。由圖7可知,突變菌LIN-DU仍產生微量的林可霉素A(質荷比為407),但產量較出發菌株S.lincolnensisN9明顯下降,僅為出發菌株的1/30。

圖6 對照菌N9、突變菌LIN-DU、LIN-U發酵液效價測定結果

圖7 突變菌LIN-DU和對照菌S.lincolnensis N9 LC-MS圖譜對比
以上表型結果表明,lmbU為林可霉素生物合成的正調控基因,但單獨倍增lmbU基因對于林可霉素產量和組分比例影響不顯著。
2.4 討論
有文獻報道,lmbU基因敲除能夠使S.lincolnensis野生菌株失去林可霉素生物合成能力,lmbU基因是林可霉素生物合成的關鍵基因[10]。作者通過序列分析,發現lmbU基因與幾種抗生素產生菌中調節基因具有很高的同源性。
本研究通過對lmbU基因的同框敲除,發現得到的突變菌的林可霉素產量明顯下降,LC-MS分析表明其仍能產生微量的林可霉素,證明lmbU基因是負責林可霉素生物合成的正調控基因。同時嘗試對lmbU基因進行倍增以提高林可霉素的產量,結果表明得到的突變菌的林可霉素產量沒有明顯提高。可能lmbU基因并非是途徑特異性的調節基因,而是處于一個相對復雜的調控環境中,有待于進一步探索和研究。
3 結論
研究了林可霉素生物合成基因簇中調控基因的功能。通過構建重組質粒pLIN-DU和pLIN-U分別對林可霉素工業生產菌株Streptomyceslincolnensis的lmbU基因進行同框敲除和基因倍增,獲得相應突變菌LIN-DU和LIN-U后,對突變菌發酵液進行生物效價測定和LC-MS分析,探討lmbU基因對林可霉素產量和組分的影響。結果發現,基因敲除突變菌LIN-DU的林可霉素生物合成能力大幅削弱;基因倍增突變菌LIN-U的林可霉素生物合成相對出發菌株沒有明顯變化。表明lmbU基因對林可霉素生物合成具有正向調控作用。
參考文獻:
[1] 張永信,吳永樂,吳菊芳,等.國產克林霉素的抗菌作用和臨床療效[J].上海醫藥,1998,19(9):8-11.
[2] Spizek J,Rezanka T.Lincomycin,clindamycin and their applications[J].Appl Microbiol Biotechnol,2004,64(4):455-464.
[3] Peschke U,Schmidt H,Zhang H Z,et al.Molecular characterization of the lincomycin-production gene cluster ofStreptomyceslincolnensis78-11[J].Mol Microbiol,1995,16(6):1137-1156.
[4] Koberska M,Kopecky J,Olsovska J,et al.Sequence analysis and heterologous expression of the lincomycin biosynthetic cluster of the type strainStreptomyceslincolnensisATCC25466[J].Folia Microbiol,2008,53(5):395-401.
[5] Flett F,Mersinias V.High efficiency intergeneric conjugal transfer of plasmid DNA fromEscherichiacolito methyl DNA-restricting streptomycetes[J].Microbiol Lett,2006,155(2):223-229.
[6] Bierman M,Logan R,O′brien K,et al.Plasmid cloning vectors for the conjugal transfer of DNA fromEscherichiacolitoStreptomycesspp.[J].Gene,1992,116(1):43-49.
[7] Bohdan O,Roman Makitrinskyy,Suzanne W,et al.Identification and characterization ofStreptomycesghanaensisATCC14672 integration sites for three actinophage-based plasmids[J].Plasmid,2009,61(3):171-175.
[8] 薩姆布魯克 J,拉塞爾 D W.分子克隆實驗指南(第三版)[M].北京:科學出版社,2002:96-105.
[9] 王增亮,趙群飛,高淑紅,等.Streptomyceslincolnensis新遺傳操作方法的建立以及lmbQ基因功能研究[J].生物技術通報,2010,(11):186-190.
[10] 呂彩霞,楊捷,葉江,等.林可霉素生物合成基因lmbU的敲除及其遺傳回補[J].華東理工大學學報(自然科學版),2008,34(1):60-65.

