重組運動發酵單胞菌發酵木糖產乙醇的研究
周 穩,付 烈,王俊卿,熊 平,汪浩勇
(湖北工業大學生物工程學院,湖北 武漢 430068)
燃料乙醇作為能源具有污染小、可再生等諸多優點,各國均致力于提高燃料乙醇生產效率的研究[1]。釀酒酵母是目前發酵生產燃料乙醇的主要菌種,但其生長慢、發酵周期長、耐乙醇能力較差,難以用于高濃度乙醇的發酵生產[2]。而運動發酵單胞菌具有發酵周期短、糖類轉化率高、耐乙醇能力強以及遺傳改造簡單等特點,是良好的燃料乙醇生產菌種[3]。
大腸桿菌能利用戊糖和己糖,但缺乏相關高效率乙醇代謝酶,幾乎不產生乙醇[4]。運動發酵單胞菌只能利用葡萄糖、果糖以獨特的ED途徑生成乙醇[5]。自然界最豐富的是纖維素[6],其水解液的主要成分為己糖(葡萄糖、半乳糖)以及大量的戊糖等,其中木糖是戊糖最主要的成分。如果運動發酵單胞菌能發酵纖維素水解液生產廉價的燃料乙醇,對解決未來能源短缺具有重大意義和潛在價值[7,8]。
作者通過基因工程手段用大腸桿菌的木糖代謝基因xylA、xylB、tktA、talB構建木糖代謝和利用轉座載體pXT,轉座運動發酵單胞菌而使其獲得發酵木糖產乙醇的新代謝途徑,獲得了能同時利用葡萄糖和木糖高效生產乙醇的基因工程重組菌。
1 實驗
1.1 菌株、試劑和培養基
1.1.1 菌株(表1)

表1 4種實驗菌株
ZM-CP4來自ZM ATCC31821;ZM-hym和大腸桿菌E.coliDH5α,由作者所在實驗室保藏;運動發酵單胞菌不能合成兩種氨基酸:賴氨酸和甲硫氨酸[9]。作者所在實驗室前期已構建了含有賴氨酸合成酶基因(YfdZ)、甲硫氨酸合成酶基因(MetB)和熱休克蛋白基因(Hsp)的轉座載體pHYM,通過轉座重組原始菌ZM-CP4得到了重組菌ZM-hym。
ZM-xt:用木糖代謝和利用轉座載體pXT轉座重組原始菌ZM-CP4,得到ZM-xt,作為對照菌;
ZM-mtc9xt:用木糖代謝和利用轉座載體pXT轉座重組菌ZM-hym,得到ZM-mtc9xt。
1.1.2 試劑
Pfu DNA聚合酶,NEB公司;T4DNA連接酶和各種限制性內切酶,大連寶生物公司;質粒小量抽提試劑盒和膠回收試劑盒,長沙安比奧生物技術公司;酵母粉,Sigma公司;葡萄糖、木糖、氯化鎂以及各種抗生素等試劑均為國產分析純。
1.1.3 培養基及培養條件
LB培養基:1%蛋白胨,0.5%酵母粉,1% NaCl,固體培養基添加2%瓊脂,121℃滅菌30 min。
ZM培養基:10%葡萄糖,0.1%尿素,1%酵母粉,0.1%磷酸二氫鉀,0.05%硫酸鎂,固體培養基添加2%瓊脂,pH值6.0,115℃滅菌20 min。
發酵培養基:0.1%尿素,1%酵母粉,0.1%磷酸二氫鉀,0.05%硫酸鎂,隨發酵條件添加不同濃度糖溶液,pH值6.0,115℃滅菌20 min。
1.2 方法
1.2.1 DNA操作方法
細菌基因組DNA的提取、PCR產物及DNA片段的純化,質粒DNA提取、酶切、連接、轉化以及各種感受態細胞的制備等參照文獻[10]進行。質粒DNA的小量提取和純化參照試劑盒操作說明。
1.2.2 轉座載體pXT的構建
以大腸桿菌E.coliK12基因組為模板,通過PCR擴增獲得大腸桿菌木糖代謝相關基因xylA、xylB、tktA和talB,其大小分別為1.4 kb、1.5 kb、1.4 kb和2.0 kb。以野生型運動發酵單胞菌基因組DNA為模板,PCR 擴增獲得gap和eno基因啟動子序列片段,其大小分別為0.25 kb和0.2 kb。利用PCR重疊技術,將gap基因啟動子序列和xylA/xylB基因序列融合,片段大小為3.2 kb。將eno啟動子序列和talB/tktA基因序列融合,片段大小為3.6 kb。將克隆的融合片段連接到運動發酵單胞菌轉座載體上構建木糖代謝和利用轉座載體pXT。
1.2.3 轉座
在大腸桿菌中構建好轉座載體pXT后,取10 μL轉座載體與5 μL轉座酶混合,37℃水浴2 h,取3 μL與ZM-CP4或ZM-hym混合,電擊后于ZM培養基中32℃培養4 h后涂板。轉座載體pXT分別轉入ZM-hym和原始菌ZM-CP4獲得基因工程菌ZM-mtc9xt及ZM-xt。
1.2.4 重組菌株篩選
1.2.4.1 木糖平板篩選
將電擊轉座后的細菌加入1 mL ZM培養基培養4 h后,離心去上清,用無菌生理鹽水稀釋,涂布以3%木糖為唯一碳源并含有1‰四環素的固體培養基上,32℃厭氧罐中培養3 d以上。同等條件下以未轉化的原始菌ZM-CP4及ZM-hym作為對照。
挑取木糖板上長出的轉座子接種于50 mL ZM培養基中培養24 h后,抽取基因組DNA,設計4對檢驗引物,分別對木糖代謝基因xylA、xylB、tktA、talB進行PCR鑒定,大小應為0.48 kb、0.73 kb、0.55 kb、0.81 kb。同樣條件下以ZM-CP4及ZM-hym的基因組DNA作為對照。PCR鑒定正確的陽性轉座子加入等體積的40%滅菌甘油,于-80°C冰箱中低溫保存。
1.2.5 發酵實驗
(1)單糖發酵:取PCR鑒定正確的細菌各1 mL接種于9 mL ZM培養基中,24 h后按10%的接種量分別接入含23%葡萄糖或含6%木糖的發酵培養基中,密封,32℃、60 r·min-1振蕩培養60 h,測乙醇產量。
(2)混合糖發酵:取各保藏實驗菌株1 mL接種于9 mL ZM培養基中,24 h后按10%的接種量接入含17%葡萄糖+6%木糖的混合糖發酵培養基中,密封,32℃、60 r·min-1振蕩培養60 h,測乙醇產量。
考察了溫度(32℃、40℃)、培養基中酵母粉濃度(質量體積比,分別為0、0.2%、0.4%、0.6%、0.8%、1.0%)對混合糖發酵的影響。
1.2.6 乙醇產量測定
對照組尿潴留發生率為27.59%,相比于研究組的6.89%高出許多,統計學存在差異(P<0.05),結果如下表1:
乙醇產量采用GC7890F型氣相色譜儀(上海天美有限公司)測定,以異丁醇作為內標物。
2 結果與討論
2.1 重組菌種的初篩與PCR鑒定
重組菌在以3%木糖為唯一碳源的培養基上的生長情況見圖1。
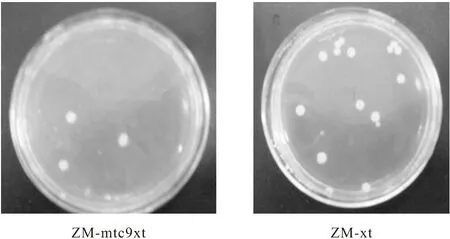
圖1 重組菌在以3%木糖為唯一碳源的培養基上的生長情況
由圖1可知,轉座后的細菌涂布木糖板72 h后,板上長出少量白色菌落,而未轉座的原始菌ZM-CP4及ZM-hym木糖板上未見白色菌落生長。
重組菌基因組DNA的PCR鑒定結果見圖2。

圖2 重組菌基因組PCR鑒定(左:ZM-mtc9xt;右:ZM-xt)
由圖2可知,1%的瓊脂糖凝膠電泳顯示,4對檢驗引物擴增的PCR片段大小分別約為0.5 kb、0.8 kb、0.6 kb、0.8 kb,與設計相符。而原始菌ZM-CP4及ZM-hym基因組DNA的PCR鑒定結果均為陰性,表明兩種重組菌中確實包含木糖代謝基因xylA、xylB、tktA和talB。共獲得76個轉座陽性細菌。
2.2 23%葡萄糖發酵實驗和6%木糖單糖發酵實驗結果
所獲得的76個轉座陽性細菌中,有些不能利用葡萄糖,有些利用葡萄糖發酵乙醇能力大幅度下降。實驗只保留能高效生成乙醇的轉座陽性菌株。經過4輪篩選,共獲得8個能高效利用葡萄糖發酵生成乙醇的轉座陽性菌株,其在23%葡萄糖、6%木糖發酵培養基中發酵產乙醇的情況見圖3、圖4。
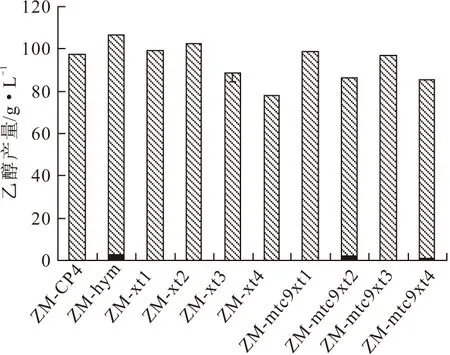
圖3 各菌株23%葡萄糖發酵實驗

圖4 各菌株6%木糖發酵實驗
由圖3可知,在含23%葡萄糖的發酵條件下,重組菌ZM-xt2和ZM-mtc9xt1最高乙醇產量分別為102.7 g·L-1和98.3 g·L-1,而原始菌ZM-CP4和ZM-hym的乙醇平均產量分別為97.2 g·L-1和106.4 g·L-1。雖然重組菌的乙醇產量略低于ZM-hym,但卻高于原始菌ZM-CP4,這可能是由于轉入了新的基因使得細菌的能量代謝負擔加重,乙醇產量有少許下降。但對重組菌高效發酵葡萄糖產乙醇的能力沒有影響。
原始菌ZM-CP4和ZM-hym在木糖發酵培養基內不能生長,而重組菌ZM-xt(1~4)和ZM-mtc9xt(1~4)均能在木糖發酵培養基內正常生長。由圖4可知,在6%木糖發酵培養基中發酵60 h后,ZM-xt(1~4)和ZM-mtc9xt(1~4)均能發酵木糖產乙醇,但各菌株發酵木糖產乙醇的能力各不相同,其中ZM-xt1和ZM-mtc9xt3發酵能力最強,乙醇產量分別為24.9 g·L-1和24.1 g·L-1。
綜上可知,ZM-xt1和ZM-mtc9xt3在6%木糖發酵培養基中乙醇產量最高且能高效發酵23%葡萄糖,因此用ZM-xt1和ZM-mtc9xt3進行后續實驗。
2.3 17%葡萄糖+6%木糖混合糖發酵實驗結果(圖5)
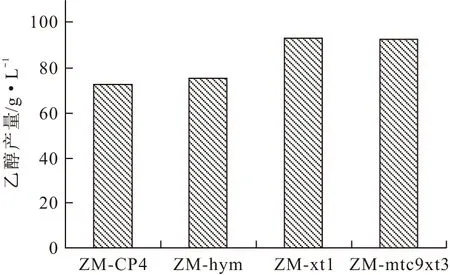
圖5 各菌株17%葡萄糖+6%木糖發酵實驗
由圖5可知,在混合糖發酵條件下,原始菌ZM-CP4和ZM-hym的平均乙醇產量分別為72.7 g·L-1和75.3 g·L-1。ZM-xt1的平均乙醇產量為83.8 g·L-1,與ZM-CP4和ZM-hym相比,分別提高了15%和12%。ZM-mtc9xt3的平均乙醇產量為88.9 g·L-1,與ZM-CP4和ZM-hym相比,分別提高了22%和18%。該結果表明,大腸桿菌的木糖代謝和利用基因,能在運動發酵單胞菌中與運動發酵單胞菌的ED途徑相偶聯,利用木糖產乙醇,提高了混合糖發酵的乙醇產量。
2.4 溫度對混合糖發酵的影響(圖6)
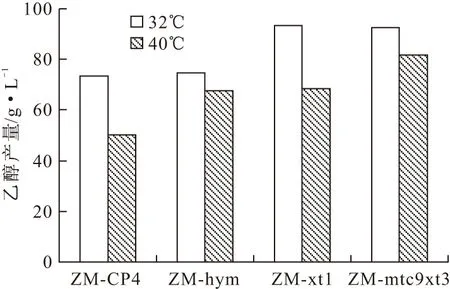
圖6 溫度對混合糖發酵的影響
由圖6可知,在17%葡萄糖+6%木糖混合糖發酵時,與32℃發酵相比,40℃時各菌株的乙醇產量均有所下降。原始菌ZM-CP4與ZM-xt1的平均乙醇產量分別降低了47%和48%,而含有Hsp基因的ZM-hym和ZM-mtc9xt3平均乙醇產量僅分別降低6%和9%。由此可知,含有Hsp基因的重組菌ZM-mtc9xt3對溫度的耐受性顯著提高。
2.5 酵母粉濃度對混合糖的影響(圖7)
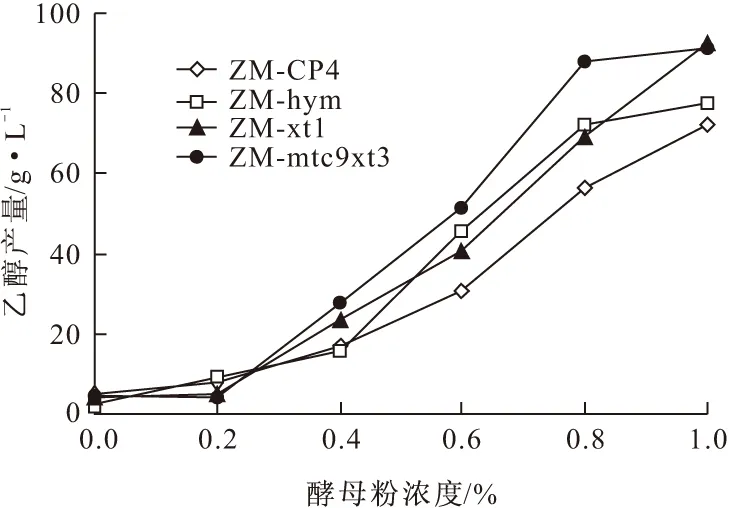
圖7 酵母粉濃度對混合糖發酵的影響
由圖7可知,在酵母粉濃度為0~0.4%時,各菌株的乙醇產量差別不明顯。在酵母粉濃度為0.4%~0.8%時,ZM-mtc9xt3乙醇產量增加了60.4 g·L-1,ZM-hym乙醇產量增加了55.4 g·L-1,ZM-xt1乙醇產量增加了45.6 g·L-1,而原始菌乙醇產量僅增加39.6 g·L-1。含有hym基因的ZM-mtc9xt3乙醇產量分別比ZM-xt1和原始菌ZM-CP4提高了32%和53%。說明在hym基因的作用下,ZM-mtc9xt3比ZM-xt1和原始菌ZM-CP4更能適應在低酵母粉濃度的混合糖發酵培養基中發酵生產乙醇。在酵母粉濃度為0.8%~1.0%時,菌株ZM-xt1和原始菌ZM-CP4乙醇產量才開始迅速增加,而ZM-mtc9xt3和ZM-hym的乙醇產量則增加平緩。但由于混合糖培養基中還含有6%木糖,整合了木糖代謝和利用基因的ZM-mtc9xt3最終乙醇產量比ZM-hym提高了9%。說明在低營養物酵母粉濃度的葡萄糖和木糖混合糖發酵培養基中,ZM-mtc9xt3更能有效地利用各種糖發酵產乙醇。
3 結論
近年來,在關于運動發酵單胞菌發酵木糖產乙醇的相關報道中,研究人員多采用穿梭質粒轉化細菌[11],但其發酵性能不穩定,且需加入各種抗生素維持[12,13]。本實驗首次將外源基因xylA、xylB、tktA和talB通過轉座方式整合到運動發酵單胞菌的基因組DNA上,通過篩選得到能發酵木糖高效產乙醇的重組菌ZM-mtc9xt3,在17%葡萄糖+6%木糖混合糖發酵中乙醇產量為88.9 g·L-1,比原始菌ZM-CP4提高了22%。且所構建的重組菌ZM-mtc9xt3能在較低營養條件和較高溫度下高效發酵產乙醇,更適于工業化應用,有望生產低成本廉價乙醇。
[1] 李盛賢,賈樹彪,顧立文.利用纖維素原料生產燃料酒精的研究進展[J].釀酒,2005,32(2):13-16.
[2] Romero S,Merino E,Bolivar F,et al.Metabolic engineering ofBacillussubtilisfor ethanol production:Lactate dehydrogenase plays a key role in fermentative metabolism[J].Applied and Environmental Microbiology,2007,73(16):5190-5198.
[3] Zaldivar J,Nielsen J,Olsson L.Fuel ethanol production from lingo cellulose:A challenge for metabolic engineering and process integration [J].Appl Microbiol Biotechnol,2001,56(1-2):17-34.
[4] Ingram L O,Conway T,Clark D P,et al.Genetic engineering of ethanol production inEscherichiacoli[J].Appl Environ Microbiol,1987,53(10):2420-2425.
[5] OsmanYehia A,Ingram Lonnie O .Mechanism of ethanol inhibition of fermentation inZymomonasmobilisCP4[J].Journal of Bacteriology,1985,164(1):173-180.
[6] 鮑曉明,高登,曲音波,等.木糖代謝工程的研究進展[J].生物工程學報,1998,14(4):355-358.
[7] Gong C S,Cao N J,Du J,et al.Ethanol production from renewable resourse[J].Adv Biochem Eng Biotechnol,1999,65:207-241.
[8] Aristidou A,Penttil? M P.Metabolic engineering applications to renewable resource utilization[J].Current Opinion in Biotechnology,2000,11(2):187-198.
[9] Seo J S,Chong H,Park H S,et al.The genome sequence of the ethanol ogenic bacteriumZymomonasmobilisZM4[J].Nature Biotechnol,2005,23(1):63-68.
[10] J.薩姆布魯克,D.W.拉塞爾,黃培堂,等譯.分子克隆實驗指南(第三版)[M].北京:科學出版社,2003:27-30.
[11] 高衛華,張敏華,劉成.能利用五碳糖和六碳糖生產乙醇的基因工程菌菌株的構建[J].工業微生物,2004,34(1):56-62.
[12] 張穎,馬瑞強,洪浩舟,等.重組運動發酵單胞菌的構建及木糖利用特性研究[J].生物技術通報,2009,(7):160-165.
[13] Xu Chang,Long Minnan,Wu Xiaobin,et al.Screening and characterization of the high-cellulose-producing strain[J].Front Biol China,2006,1(1):35-40.

