飼用酶與芽孢桿菌協同作用發酵豆粕的相關研究
常 磊 劉永萍 徐聰聰 陳潔梅
豆粕是大豆經提油后得到的副產品,其蛋白質含量高、氨基酸組成平衡,是動物飼養中常用的一種優質植物性蛋白原料,具有很大的利用價值 (趙韋璇,2006;Adetayo,2005)。但動物對大分子豆粕蛋白的吸收明顯沒有對小分子多肽和氨基酸的吸收好 (陳培賽,2008),同時豆粕中存在有多種抗營養因子(ANFs),如脲酶、胰蛋白酶抑制劑、植酸、凝集素、脂肪氧化酶和大豆抗原蛋白等,也影響了營養成分的消化、吸收和代謝,對動物體的健康和生產性能產生不良影響,從而制約了豆粕在畜禽飼養中更有效的應用 (張明峰等,1999;何玉華等,2009)。
一般認為,豆粕發酵主要是利用微生物的作用降解豆粕中的大分子蛋白質以及抗營養因子等,或者是直接利用外源蛋白酶的作用將豆粕進行酶解,從而達到發酵的目的。近年也有少量關于利用微生物和酶的協同作用混合處理豆粕的相關報道(方樂等,2011)。
本研究主要通過比較利用飼用復合酶酶解豆粕、芽孢桿菌發酵豆粕和復合酶加芽孢桿菌協同作用發酵豆粕的結果,得到最佳的發酵工藝條件,以提高豆粕的利用率與營養價值,縮短發酵周期,降低生產成本,為實際生產提供參考。
1 材料與方法
1.1 試驗材料
豆粕:經粉碎機粉碎,由肇慶市益信農業發展有限公司提供。
飼用復合酶(發酵豆粕用):寧夏夏盛實業集團有限公司產品,其中蛋白酶活力為100000 U/g。
營養瓊脂斜面培養基:牛肉膏3 g/l、蛋白胨10 g/l、瓊脂粉 20 g/l、NaCl 5 g/l,pH 值(7.4±0.2);
液體種子培養基:牛肉膏3 g/l、NaCl 5 g/l、蛋白胨10 g/l,pH 值(7.3±0.2);
發酵培養基:發酵基質為豆粕,加適量水混勻后裝于500 ml錐形瓶中,加水量根據具體試驗設計而定。
菌種:1號菌(SN-2-1-D)和 3號菌(ND-1-2-D),均為芽孢桿菌,暨南大學生物工程學系微生物學實驗室保藏菌株。
1.2 方法
1.2.1 液體種子的制備
從活化的營養瓊脂斜面刮取2環菌苔到液體種子培養基,于180 r/min、35℃搖床培養24 h備用。1.2.2 酶解發酵工藝單因素試驗
1.2.2.1 料水比對酶解豆粕酸溶性蛋白含量的影響
在500 ml錐形瓶中裝入100 g豆粕,加入不同量的自來水混勻,使料水比分別為1:0.3、1: 0.4、1:0.5、1: 0.6、1: 0.7、1: 0.8,121 ℃、0.1 MPa條件下滅菌 20 min。加酶量為豆粕量的0.10%,37℃恒溫培養箱保溫酶解24 h,取樣后于60℃烘箱內烘干并粉碎,測定酸溶性蛋白含量。
1.2.2.2 加酶量對酶解豆粕酸溶性蛋白含量的影響
在500 ml錐形瓶中裝入100 g豆粕,加水混勻使料水比為1: 0.6,121℃、0.1 MPa條件下滅菌20 min,冷卻后加入飼用復合酶混勻,加酶量分別為0.05%、0.10%、0.15%、0.20%、0.30%,37℃恒溫培養箱保溫酶解24 h,取樣后于60℃烘箱內烘干并粉碎,測定酸溶性蛋白含量。
1.2.2.3 初始酶解溫度對酶解豆粕酸溶性蛋白含量的影響
在500 ml錐形瓶中裝入100 g豆粕,加水混勻使料水比為1: 0.6,121℃、0.1 MPa條件下滅菌20 min,加酶量為 0.10%,分別在 20、25、30、35、40 ℃的恒溫培養箱中保溫酶解24 h,取樣后于60℃烘箱內烘干并粉碎,測定酸溶性蛋白含量。
1.2.3 酶解發酵工藝正交試驗
在單因素試驗的基礎上,設計3因素(料水比、加酶量、作用溫度)、3水平L9(33)的正交試驗進行酶解條件優化。
1.2.4 酶解時間對豆粕酸溶性蛋白含量的影響
為了更好地研究酶解過程中豆粕酸溶性蛋白含量隨時間的變化情況,同時也為了減少試驗次數,保證試驗精確度,因此,本研究將時間因素進行了單獨分析,即在正交試驗確立的酶解方案基礎上進行獨立的酶解時間分析,并分別于 4、8、12、20、24、36、48、60 h 時取樣,于60℃烘箱內烘干并粉碎,測定酸溶性蛋白含量。
1.2.5 芽孢桿菌發酵對豆粕酸溶性蛋白含量的影響
基于工廠化大池發酵試驗方面的研究,以及實際生產過程中的成本問題,本研究在參考課題組之前已確立菌種發酵條件(陳潔梅,2011)的基礎上做了如下試驗設計:料水比1:0.7,接種量1%(0.5%1號菌+0.5%3號菌),初始發酵溫度35℃,并以此進行發酵試驗研究。考慮到菌種要有一段時間先大量繁殖,故分別于 20、24、36、48、60 h取樣,取樣后于 60 ℃烘箱內烘干并粉碎,測定酸溶性蛋白含量。
1.2.6 飼用復合酶和芽孢桿菌混合發酵試驗
根據前面所確立的最佳發酵條件,進行復合酶加芽孢桿菌的混合發酵試驗,即:料水比為1:0.7,培養基在121℃、0.1 MPa條件下滅菌20 min。加酶量為0.05%,接種量為1%,初始發酵溫度為35℃,分別于12、20、24、36、48、60 h 取樣,取樣后于 60 ℃烘箱內烘干并粉碎,測定酸溶性蛋白含量。
1.2.7 酸溶性蛋白含量的測定
根據NY/T1205—2006中的方法提取豆粕水溶性蛋白。取10 ml水溶性蛋白提取液加入10 ml 15%的三氯乙酸(TCA)溶液,振蕩片刻后靜置10 min,4000 r/min離心5 min,上清液即為酸溶性蛋白提取液。酸溶性蛋白含量的測定采用凱氏定氮法,參照GB/T5009.5—2003。
1.2.8 聚丙烯酰胺變性凝膠電泳(SDS-PAGE)分析
稱取1.2.4中收集的樣品各1.00 g,加入0.03 mol/l Tris-HCl(pH值=8.8)緩沖液20 ml,150 r/min搖床浸提0.5 h,調節pH值8.2以上,繼續于搖床上浸提1 h,后用4000 r/min離心機離心5 min,電泳時取適量上清液與等體積的樣品緩沖液混合,并煮沸10 min使蛋白質變性,配置5%的濃縮膠和12%的分離膠,按條件進行SDS-PAGE電泳分析(歐陽亮等,2008;嚴鶴松,2009)。
同時從實際生產條件出發,為了能夠更加明確直觀地反映豆粕在未滅菌條件下的發酵情況,本研究將豆粕在未滅菌條件下分別進行加酶、接菌以及酶加菌處理,并取48 h后的樣品做SDS-PAGE電泳分析,與未發酵豆粕比較,分析大分子蛋白質的降解情況。
1.2.9 樣品中總酸含量的測定
測定參照陳潔梅等(2011)的方法,總酸含量以乳酸含量表示。
1.2.10 抗營養因子含量的測定
脲酶活性的測定:參照GB/T8622—2006。
凝集素效價的測定:參照戴大章(2005)以及孫冊等(1986)的方法測定。
植酸含量的測定:參照傅啟高等(1997)的方法測定。
脂肪氧化酶含量的測定:參照張小俠等(1997)的方法測定。
2 結果與分析
2.1 酶解發酵工藝單因素試驗
2.1.1 料水比對酶解豆粕酸溶性蛋白含量的影響(見圖1)
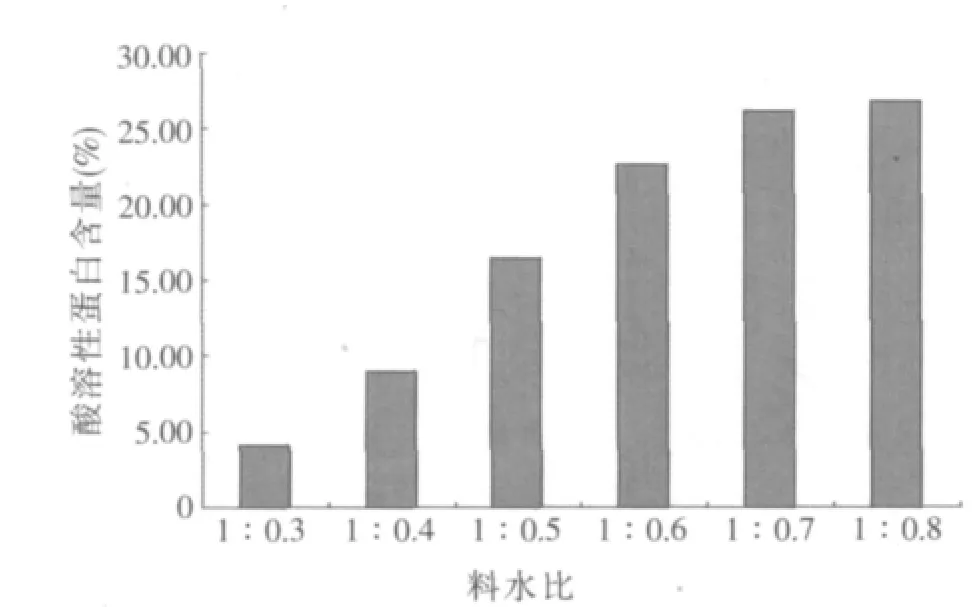
圖1 不同料水比對豆粕酸溶性蛋白含量的影響
圖1結果表明,隨著料水比的增加,樣品中酸溶性蛋白含量呈逐漸增大的趨勢,并在料水比達到1:0.7后開始變緩。根據需要,本研究選擇料水比1:0.5、1:0.6和1:0.7作為多因素正交試驗料水比因素的3個水平。
2.1.2 加酶量對酶解豆粕酸溶性蛋白含量的影響(見圖2)
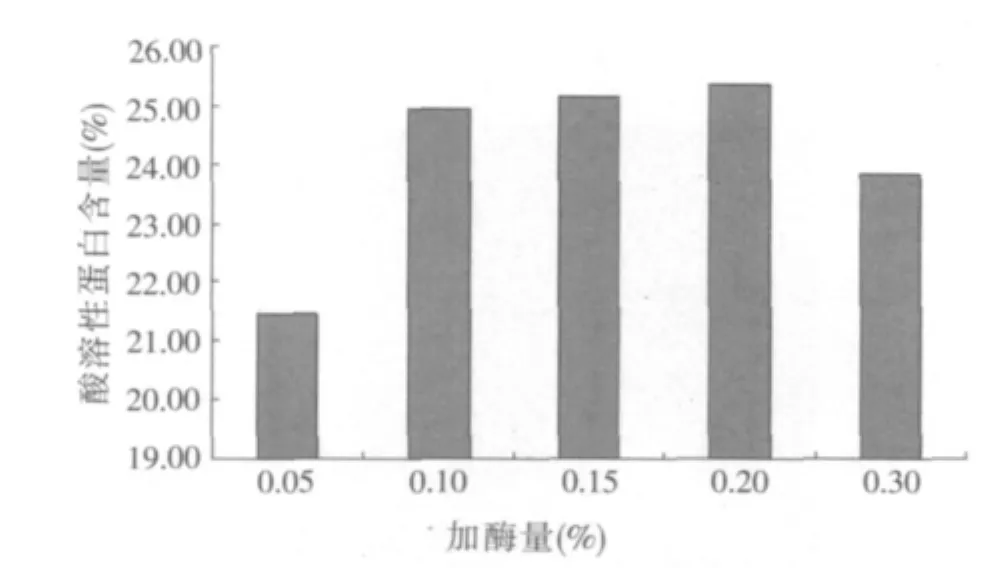
圖2 不同加酶量對豆粕酸溶性蛋白含量的影響
圖2結果表明,當酶添加量<0.10%時,加酶量對酸溶性蛋白含量的升高影響較大;當酶添加量>0.10%時,增加酶的添加量對酸溶性蛋白含量的升高影響不大,這說明酶的添加量有一個逐漸飽和的趨勢。同時也根據實際生產的需要,盡可能降低酶的用量,降低生產成本,所以,選擇加酶量0.05%、0.10%和0.15%作為多因素正交試驗加酶量因素的3個水平。
2.1.3 初始酶解溫度對酶解豆粕酸溶性蛋白含量的影響(見圖3)
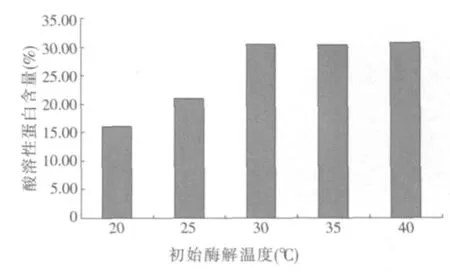
圖3 不同初始酶解溫度對豆粕酸溶性蛋白含量的影響
圖3結果表明,隨著初始酶解溫度的升高,樣品中酸溶性蛋白含量呈逐漸增大的趨勢,至30℃后基本維持不變,所以,本研究選擇初始酶解溫度30、35和40℃作為多因素正交試驗初始酶解溫度因素的3個水平。
2.2 酶解發酵工藝正交試驗
2.2.1 正交試驗直觀結果分析
根據單因素試驗的結果,設計3因素(料水比、加酶量、作用溫度)3水平L9(33)的正交試驗進行酶解條件優化。正交試驗因素水平表如表1所示,實施方案和結果見表2。
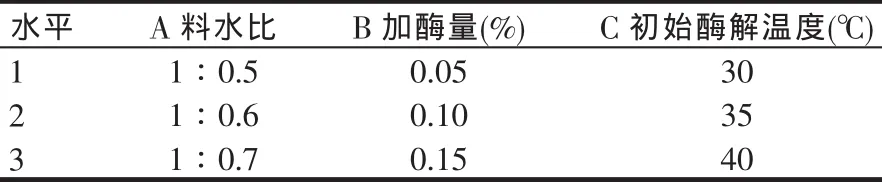
表1 正交試驗因素水平
從表2可以直觀地看出,料水比和初始酶解溫度的極差最大,料水比和初始酶解溫度對發酵樣品中酸溶性蛋白含量影響最大。理論最佳酶解發酵方案為A3B2C3,即料水比為1:0.7、加酶量為0.10%、初始酶解溫度為40℃。
2.2.2 正交試驗方差分析
正交試驗方差分析的結果見表3。從表3可以看出,上述3個因素中,料水比和初始酶解溫度對酶解豆粕中酸溶性蛋白含量的影響極顯著,加酶量影響不顯著。
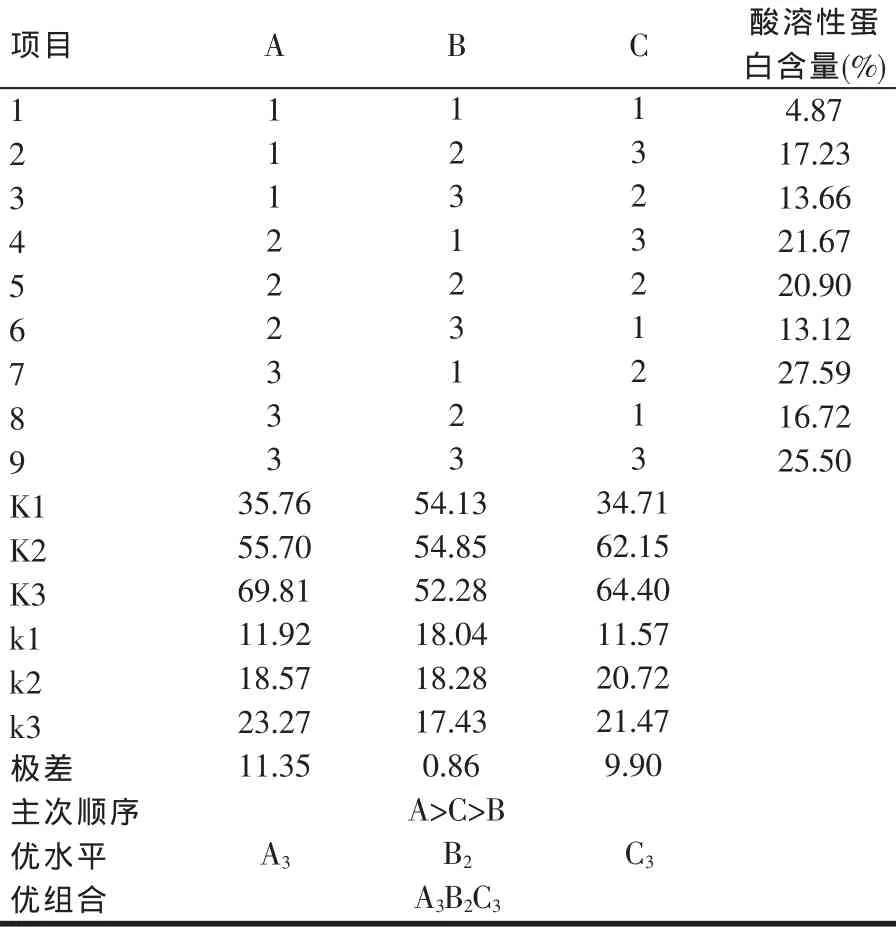
表2 正交試驗實施方案和結果
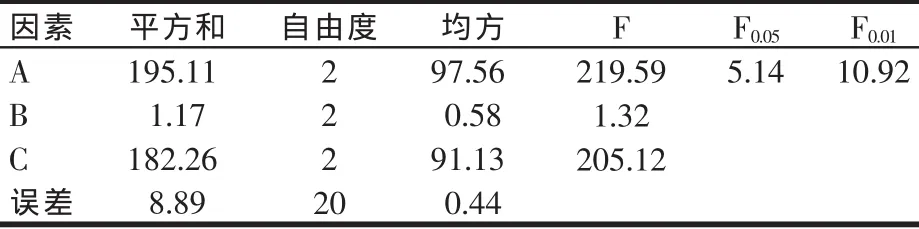
表3 正交試驗方差分析
2.2.3 酶解條件的確定
根據正交試驗所確立的理論最佳酶解方案為A3B2C3,即料水比為 1:0.7、加酶量為0.10%、初始酶解溫度為40℃。考慮到實際生產中要最大限度的降低生產成本,同時結合表3所示的結果,加酶量對酶解豆粕中酸溶性蛋白含量的影響并不顯著,所以,綜合考慮,本研究選擇最少加酶量作為最終的酶解方案,即料水比為1:0.7、加酶量為0.05%、初始酶解溫度為40℃。
2.3 加酶、加菌、酶菌協同作用處理豆粕后樣品中酸溶性蛋白含量的比較
在只加復合酶作用的情況下,酶解時間對豆粕酸溶性蛋白含量影響的結果如圖4中曲線①所示。結果表明,從8~24 h樣品中的酸溶性蛋白含量急劇增加,這是由于酶的作用快速高效,能夠很快地利用底物進行酶解,而隨著酶解時間的延長,其酸溶性蛋白含量呈現持續增高的趨勢,但增速明顯降低。
芽孢桿菌發酵對豆粕酸溶性蛋白含量影響的結果如圖4中曲線②所示。結果表明,36 h后菌種代謝活動旺盛,開始大量利用底物,樣品中酸溶性蛋白含量開始快速增加,隨著發酵時間的延長酸溶性蛋白含量持續增加。
復合酶加芽孢桿菌混合發酵對豆粕酸溶性蛋白含量影響的結果如圖4中曲線③所示。結果表明,12~36 h之間,樣品中酸溶性蛋白含量急劇增加,之后增速變緩,48 h時達到最大值。
圖4的結果表明,利用酶加菌的協同作用處理豆粕,效果優于單獨加酶和單獨加菌的情況,在發酵48 h時酸溶性蛋白含量達到最高,為24.55%,這在實際生產過程中具有較好的指導意義。
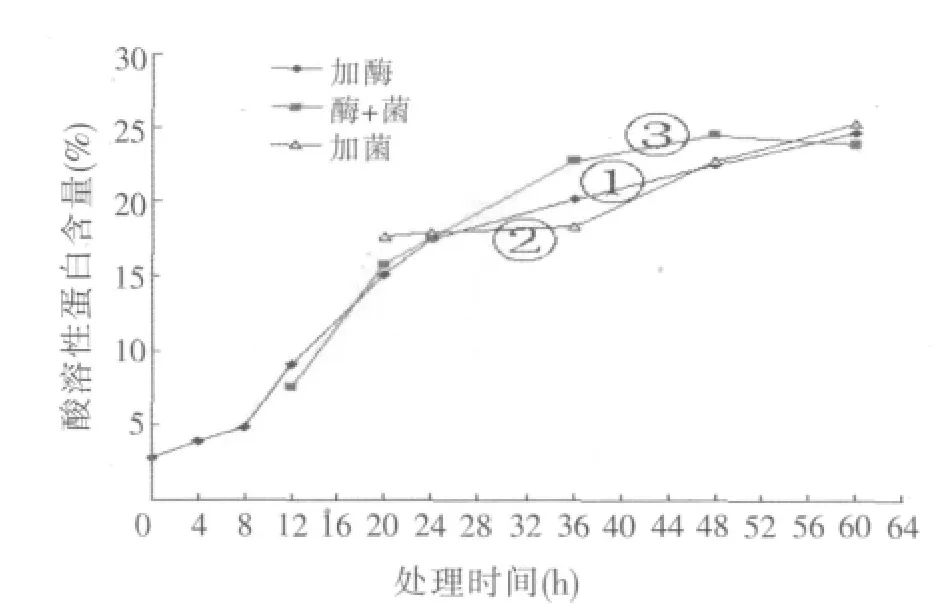
圖4 不同處理豆粕酸溶性蛋白含量隨時間變化趨勢
2.4 聚丙烯酰胺變性凝膠電泳(SDS-PAGE)
酶解樣品大分子蛋白降解后的分子量變化情況如圖5 SDS-PAGE電泳圖譜所示。從圖5可以看出,樣品經滅菌處理后酶解4~12 h,40 kD以上的蛋白質基本上被降解。隨著酶解時間的逐漸延長,大分子蛋白質進一步被降解,36 h后基本上都被降解成分子量為20 kD或以下的小分子。

圖5 不同酶解時間豆粕中大分子蛋白質的降解情況
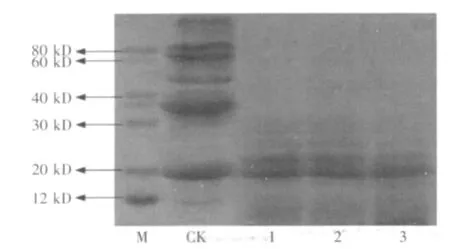
圖6 未滅菌條件下豆粕中大分子蛋白質降解情況
圖6為基質在未滅菌條件下,加酶、加菌、酶加菌處理48 h后樣品中蛋白質分子量的變化情況。結果表明,3種處理均能夠較好降解豆粕中的大分子蛋白質,基本達到滅菌條件下(圖5)蛋白質降解的水平,特別是酶加菌處理(圖6中的3)與滅菌酶解處理相同時間(圖5中的7)的電泳條帶相似,蛋白質降解后分子量基本在20 kD或以下,說明復合酶和芽孢桿菌協同作用處理豆粕有利于抵抗基質未滅菌狀態下雜菌的影響,提高了發酵豆粕的品質。
2.5 發酵豆粕中總酸含量的比較
不同處理的發酵豆粕的總酸含量(以乳酸含量計)見表4。結果表明:基質在滅菌和未滅菌狀態,3種不同處理均能夠提高其總酸含量,其中基質在未滅菌狀態下酶加菌以及加菌處理后所測得的總酸含量比在滅菌狀態下高,推測是雜菌的作用使生成了更多的有機酸。其中酶加菌協同處理(未滅菌狀態)乳酸含量由1.26%提高到4.70%,提高了2.7倍。

表4 不同處理的發酵豆粕中乳酸含量
豆粕經過復合酶和芽孢桿菌的發酵處理以后,可以產生大量的有機酸和芽孢桿菌活菌體,能很好地改善動物消化道的微生態環境,從而提高動物的免疫力,減少腸道病害的發生,在乳豬飼料中使用時,可以大大降低仔豬消化道疾病的發病率,起到預防仔豬下痢的效果(俞曉輝,2008)。
2.6 發酵樣品中抗營養因子含量的測定
處理前后豆粕中抗營養因子含量變化如表5所示。結果表明,在滅菌和未滅菌狀態下,經過3種不同的處理方式,豆粕中的各種抗營養因子均能夠被降解,其中在未滅菌狀態下利用酶加菌處理豆粕,各抗營養因子的降解水平均能達到較好效果,符合實際生產時的需要。
由于豆粕中的胰蛋白酶抑制因子含量與其中的脲酶含量呈正相關關系,通過測定脲酶活性就可間接地知道該豆粕中胰蛋白酶抑制因子含量的高低,所以本研究將豆粕中的脲酶活性作為檢測胰蛋白酶抑制因子的間接衡量指標。
3 討論
酸溶性蛋白指能溶于15%三氯乙酸的分子量較小的多肽或小肽,也包括了游離的氨基酸,易于被動物腸道吸收和消化利用,所以通過檢測處理后樣品中的酸溶性蛋白含量,可以反映出豆粕蛋白質被降解的情況,它是豆粕發酵過程中的一個重要參數。
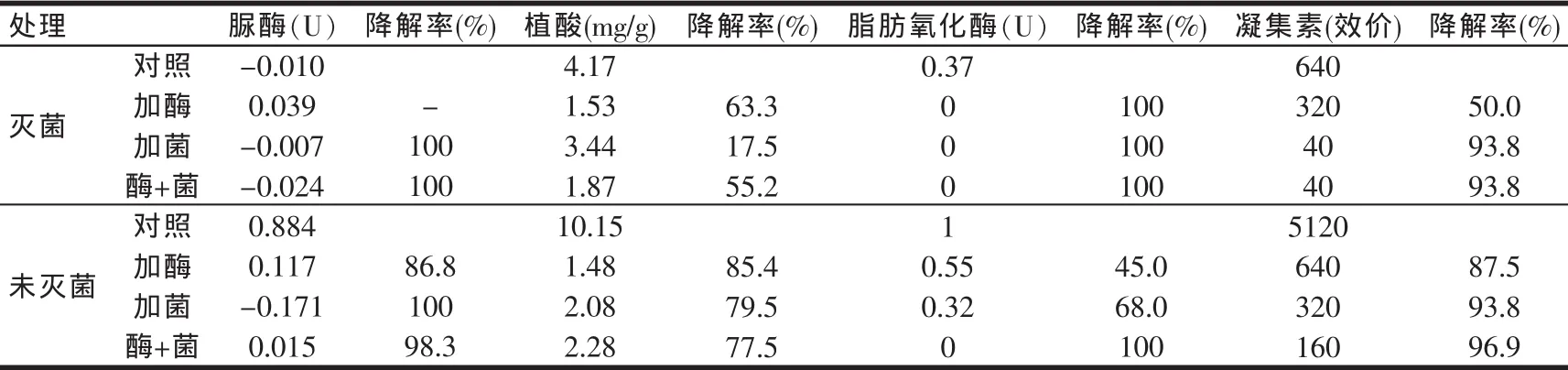
表5 處理前后豆粕中抗營養因子含量的變化
本研究利用芽孢桿菌和復合酶混合發酵豆粕,既能縮短發酵周期,又能利用芽孢桿菌抵抗其他雜菌的影響,提高效率,降低生產成本,還能通過產品中含有的大量的芽孢桿菌活菌體改變動物腸道內的微生態環境,增強飼養動物對疾病的抵抗能力,減少抗生素的使用。
4 結論
以豆粕為原料進行加酶、加菌、酶加菌協同處理試驗,通過發酵條件的優化及對比,在菌液接種量1%(0.5%1號菌+0.5%3號菌)、加酶量0.05%(蛋白酶活性50 U/g),料水比1:0.7,初始發酵溫度40℃,發酵時間48 h的條件下,酸溶性蛋白含量從2.74%提高到24.55%,豆粕中大分子蛋白質基本降解為分子量20 kD或以下的小分子物質,總酸含量(以乳酸計)從1.26%提高到4.70%,主要抗營養因子大部分被降解,其各項指標均達到了發酵豆粕行業的評判標準(葛向陽,2010),這對實際生產具有重要的參考價值。
15篇,刊略,需者可函索)

