臨床輸注條件下核黃素磷酸鈉的光穩(wěn)定性研究
喬麗曼,黃晨,張慧,湯塵塵
(溫州醫(yī)學(xué)院附屬第二醫(yī)院藥劑科,325027)
核黃素磷酸鈉為新型水溶性維生素注射用滅菌粉末,其化學(xué)名稱為核黃素5'-(二氫磷酸酯)單鈉鹽二水合物。臨床主要用于治療各種維生素B2缺乏所致的口角炎、脂溢性皮炎、舌炎、神經(jīng)病變、貧血等。國(guó)內(nèi)外許多研究表明,核黃素及其衍生物還有利尿、防癌、改善心臟功能等作用[1],并且在預(yù)防貧血、白內(nèi)障、偏頭痛等方面有特殊作用[2]。
核黃素磷酸鈉結(jié)構(gòu)中的異咯嗪環(huán)穩(wěn)定性較差,遇光極易降解[3]。有文獻(xiàn)按制劑的臨床研究原則選擇在高壓汞燈(色溫4 100 K,125 W)、紫外線高壓汞燈(色溫>5 000 K,125 W)等的強(qiáng)光照條件下的加速實(shí)驗(yàn)進(jìn)行光穩(wěn)定性研究[4],而針對(duì)核黃素磷酸鈉在臨床輸注條件下的穩(wěn)定性考察,筆者尚未見研究報(bào)道。筆者在本實(shí)驗(yàn)中模擬臨床輸注條件,考察套避光袋和非避光輸液兩種情況下注射用核黃素磷酸鈉的穩(wěn)定性,為臨床選用更穩(wěn)定的輸液提供實(shí)驗(yàn)支持。
1 儀器與試藥
1.1 儀器 高效液相色譜儀(Agilent technologies 1200 series),G1314A紫外檢測(cè)器,色譜柱(十八烷基硅烷鍵合硅膠色譜柱),PHS-3C型精密 PH計(jì),F(xiàn)A1004N電子天平。
1.2 試藥 核黃素磷酸鈉原料藥(山西振東泰盛制藥有限公司,純度:98.7%,批號(hào):0912071),注射用核黃素磷酸鈉(山西振東泰盛制藥有限公司,規(guī)格:每支10 mg,批號(hào):0911241),10%葡萄糖注射液、0.9%氯化鈉注射液(上海百特醫(yī)療有限公司,袋裝,規(guī)格:250 mL),甲醇(天津四友精細(xì)化學(xué)品有限公司一級(jí)色譜純,批號(hào):302086-07550),磷酸二氫鉀(汕頭金沙化工廠,分析純,批號(hào):001201),水(由本院制劑室提供,純化水)。
2 方法與結(jié)果
2.1 色譜條件與系統(tǒng)適應(yīng)性實(shí)驗(yàn) 色譜柱(十八烷基硅烷鍵和硅膠色譜柱,4.6 mm×250 mm,5 μm);檢測(cè)器:紫外檢測(cè)器;流動(dòng)相:甲醇-0.054 mol·L-1磷酸二氫鉀溶液(15∶85);檢測(cè)波長(zhǎng):267 nm;流速:2.0 mL·min-1;進(jìn)樣量:20 μL;柱溫:室溫;按《中華人民共和國(guó)藥典》2005年版(5)附錄進(jìn)行系統(tǒng)適應(yīng)性實(shí)驗(yàn),色譜柱理論板數(shù)為8 000,與雜質(zhì)峰分離度R=6.14,且峰形尖銳,無(wú)雜質(zhì)峰干擾。摸索實(shí)驗(yàn)時(shí),將流速調(diào)整為1.0 mL·min-1,供試液濃度取擬做標(biāo)準(zhǔn)曲線的上限濃度100 μg·mL-1(《中華人民共和國(guó)藥典》2005年版規(guī)定濃度的50%),所得圖譜分別于21,25,33,46,53 min出峰,各峰依次為 3',5,-核黃素二磷酸酯;4',5,-核黃素二磷酸酯;3'-核黃素磷酸鈉;4'-核黃素磷酸鈉;核黃素磷酸鈉。因3',4'-核黃素二磷酸酯濃度過(guò)低,無(wú)法從圖中積分看到。
開始實(shí)驗(yàn)時(shí),考慮到保留時(shí)間不宜過(guò)長(zhǎng),于是將流速調(diào)為2.0 mL·min-1,供試液濃度取擬做標(biāo)準(zhǔn)曲線的中間濃度40 μg·mL-1。此時(shí)與0.9%氯化鈉注射液配伍的圖譜于21,29,34 min出峰,而與10%葡萄糖注射液配伍的圖譜于22,30,35 min出峰,各峰依次為3,-核黃素磷酸鈉;4,-核黃素磷酸鈉;核黃素磷酸鈉。
2.2 線性關(guān)系考察 精密稱取干燥至恒重的核黃素磷酸鈉20 mg,置100 mL棕色容量瓶中,加流動(dòng)相溶解并稀釋至刻度,搖勻,配制成濃度為200 μg·mL-1的儲(chǔ)備液,避光保存。分別精密量取上述儲(chǔ)備液2.5,5.0,10.0,20.0,25.0 mL 加至 50 mL 棕色容量瓶中,加流動(dòng)相稀釋,定容,使?jié)舛葹?10,20,40,80,100 μg·mL-1。按“2.1”項(xiàng)色譜條件,分別精密量取核黃素磷酸鈉對(duì)照品溶液20 μL,連續(xù)進(jìn)樣3次,記錄峰面積,取其平均值。以核黃素磷酸鈉的濃度為橫坐標(biāo)(X),對(duì)應(yīng)峰面積為縱坐標(biāo)(Y)進(jìn)行線性回歸,其線性方程為Y=28.888X+4.211 7,R2=0.999 9。結(jié)果表明,核黃素磷酸鈉在10~100 μg·mL-1濃度范圍內(nèi)與其峰面積呈良好的線性關(guān)系。
2.3 精密度實(shí)驗(yàn) 精密量取避光保存的核黃素磷酸鈉4 mg,加流動(dòng)相稀釋成40 μg·mL-1溶液,連續(xù) 3 d,每天連續(xù)進(jìn)樣5次,每次20 μL,測(cè)定峰面積,根據(jù)峰面積求得日內(nèi)精密度RSD分別為1.24%,1.62%和0.43%(n=5),日間精密度RSD為0.35%(n=3)。根據(jù)高效液相色譜法要求,精密度應(yīng)該不大于2%,實(shí)驗(yàn)結(jié)果符合要求,說(shuō)明本法精密度良好。
2.4 臨床輸注條件下光穩(wěn)定性實(shí)驗(yàn)
2.4.1 與0.9%氯化鈉溶液配伍的光穩(wěn)定性實(shí)驗(yàn)?zāi)M臨床配制與輸注條件,取核黃素磷酸鈉粉針1支(每支10 mg),0.9%氯化鈉溶液1袋(250 mL)。用注射器抽取適量0.9%氯化鈉溶液注入并轉(zhuǎn)移至0.9%氯化鈉溶液袋中,搖勻,得供試液A。模擬患者床旁及走廊的袋高度,將供試液A掛于實(shí)驗(yàn)臺(tái)上,避免陽(yáng)光直射。以輸液配好即時(shí)起(0 h)的含量為100%計(jì)算,分別在0,1,2,4,8,24 h 取樣,且盡量避光操作,進(jìn)樣20 μL,計(jì)算各時(shí)間點(diǎn)相當(dāng)于0 h峰面積的百分含量;同時(shí)使用精密pH計(jì)測(cè)量溶液pH值。連續(xù)3 d重復(fù)實(shí)驗(yàn),將3 d同一處理狀態(tài)下3個(gè)數(shù)據(jù)的平均值作為實(shí)驗(yàn)結(jié)果進(jìn)行討論。配伍后各時(shí)間點(diǎn)的含量變化及百分含量變化結(jié)果,如表1所示。配伍4 h后的圖譜僅在31 min出可積分看到的峰,表明分解產(chǎn)物對(duì)本次測(cè)定無(wú)干擾。
同法操作,另配一袋相同的供試液B,套避光袋,將B溶液掛于實(shí)驗(yàn)臺(tái)平行位置。同樣連續(xù)3 d重復(fù)實(shí)驗(yàn),將3 d同一處理狀態(tài)下3個(gè)數(shù)據(jù)的平均值作為實(shí)驗(yàn)結(jié)果進(jìn)行討論。配伍后各時(shí)間點(diǎn)的含量變化及百分含量變化結(jié)果,如表2所示。
2.4.3 與10%葡萄糖溶液配伍的光穩(wěn)定性實(shí)驗(yàn) 模擬臨床配制與輸注條件,取核黃素磷酸鈉粉針1支(每支10 mg),10%葡萄糖溶液1袋(250 mL)。用注射器抽取適量10%葡萄糖溶液注入并轉(zhuǎn)移至10%葡萄糖溶液袋中,搖勻,得供試液C。模擬患者床旁及走廊的袋高度,將供試液C掛于實(shí)驗(yàn)臺(tái)上,避免陽(yáng)光直射。以輸液配好即時(shí)起(0 h)的含量為100.00%計(jì)算,分別在0,1,2,4,8,24 h 取樣,且盡量避光操作,進(jìn)樣 20 μL,計(jì)算各時(shí)間點(diǎn)相當(dāng)于0 h峰面積的百分含量;同時(shí)使用精密pH計(jì)測(cè)量溶液pH值,連續(xù)3 d重復(fù)實(shí)驗(yàn),將這3 d同一處理狀態(tài)下3個(gè)數(shù)據(jù)的平均值作為實(shí)驗(yàn)結(jié)果進(jìn)行討論。配伍后各時(shí)間點(diǎn)的含量變化及百分含量變化結(jié)果,如表3所示。配伍4 h后圖譜僅在32 min出可積分看到的峰,表明分解產(chǎn)物對(duì)本次測(cè)定無(wú)干擾。
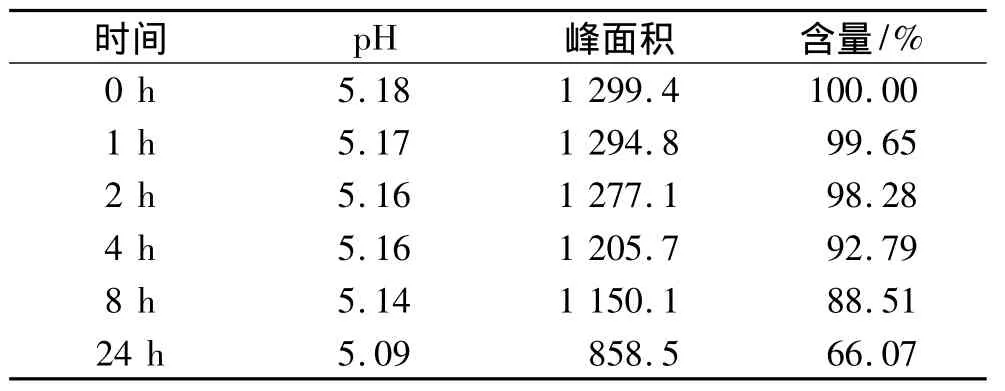
表1 24 h內(nèi)剩余藥物相對(duì)0時(shí)含量百分?jǐn)?shù)(供試液A)
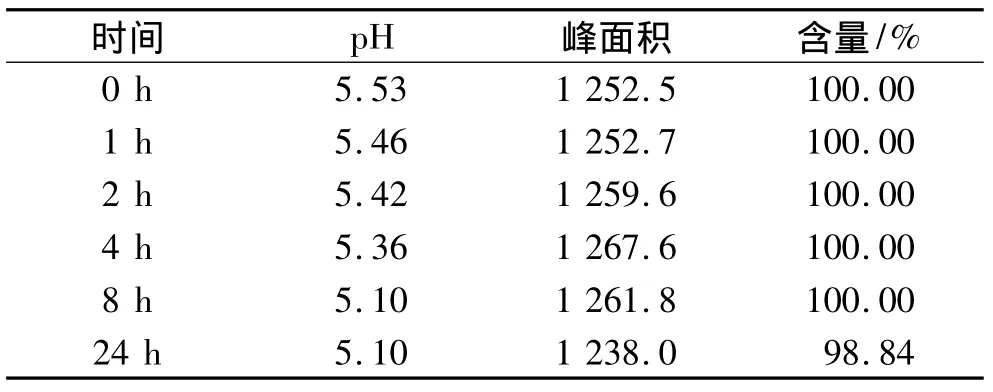
表2 24 h內(nèi)剩余藥物相對(duì)0時(shí)含量百分?jǐn)?shù)(供試液B)
同法操作,另配一袋相同的供試液D,套避光袋,將D溶液掛于實(shí)驗(yàn)臺(tái)平行位置。同樣連續(xù)3 d重復(fù)實(shí)驗(yàn),將3 d同一處理狀態(tài)下3個(gè)數(shù)據(jù)的平均值作為實(shí)驗(yàn)結(jié)果進(jìn)行討論。配伍后各時(shí)間點(diǎn)的含量變化及百分含量變化結(jié)果,如表4所示。
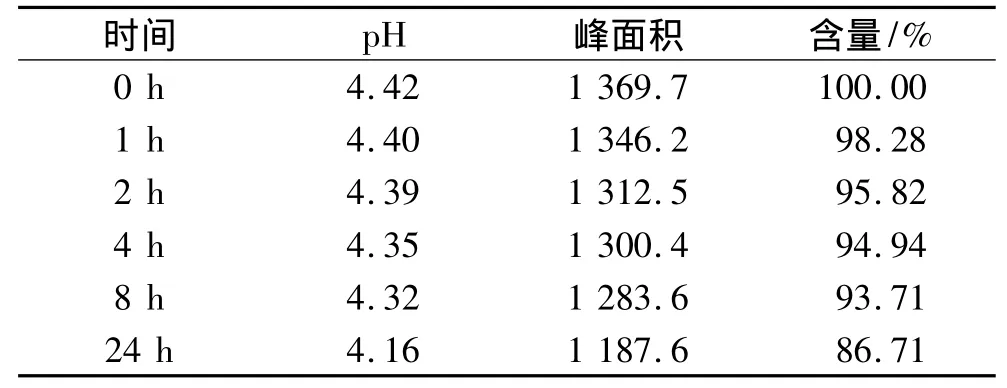
表3 24 h內(nèi)剩余藥物相對(duì)0時(shí)含量百分?jǐn)?shù)(供試液C)
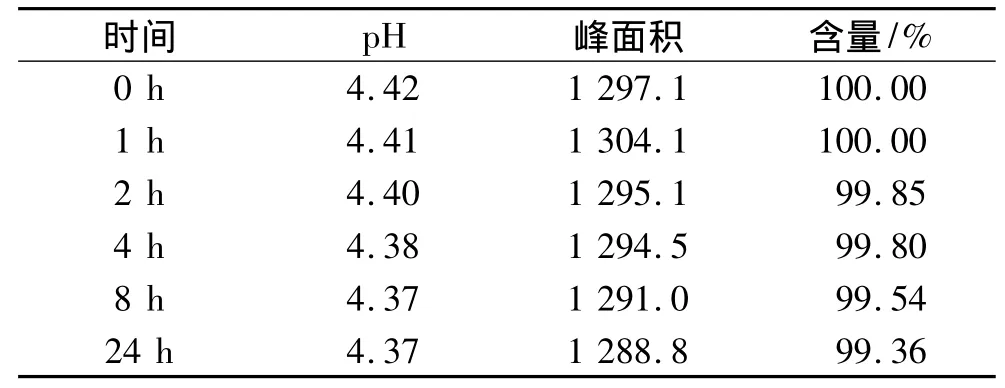
表4 24 h內(nèi)剩余藥物相對(duì)0時(shí)含量百分?jǐn)?shù)(供試液D)
本實(shí)驗(yàn)結(jié)果表明,避光與非避光條件下,核黃素磷酸鈉配伍液的pH均隨著時(shí)間的推移而減小。供試液B和D的實(shí)驗(yàn)數(shù)據(jù)表明,核黃素磷酸鈉配伍液在避光條件下,24 h內(nèi)穩(wěn)定;而供試液A和C的實(shí)驗(yàn)數(shù)據(jù)表明,核黃素磷酸鈉配伍液在非避光條件下,2 h內(nèi)降解程度<5%,超過(guò)2 h則降解程度增大,因此建議臨床除非能保證輸液配好后2 h內(nèi)滴注完成,否則應(yīng)套上避光袋滴注。
目前大部分病區(qū)所用核黃素磷酸鈉注射液是在靜脈藥物配置中心調(diào)配,藥物從配制好到運(yùn)往病區(qū)給患者靜脈滴注的時(shí)間間隔一般超過(guò)2 h,所以建議藥物化好后盡量避光保存,并且在情況允許范圍內(nèi),病區(qū)護(hù)士盡可能的為患者先輸注核黃素磷酸鈉注射液。
3 討論
3.1 色譜條件的選擇 根據(jù)2005年版《中華人民共和國(guó)藥典》(二部)的色譜條件,并參考文獻(xiàn)[6-10],調(diào)節(jié)流速為1 mL·min-1,通過(guò)實(shí)驗(yàn)驗(yàn)證,發(fā)現(xiàn)保留時(shí)間為65 min,保留時(shí)間太長(zhǎng),不利于實(shí)驗(yàn)的進(jìn)行。考慮到色譜柱壓力不可以太大,并參照《美國(guó)藥典》[11]和《英國(guó)藥典》[12],調(diào)整流速為 2 mL·min-1,此時(shí)核黃素磷酸鈉的保留時(shí)間約36 min,柱壓約為280 bar,保證實(shí)驗(yàn)順利進(jìn)行。
3.2 流動(dòng)相過(guò)濾 在進(jìn)行前期實(shí)驗(yàn)時(shí),流動(dòng)相沒(méi)有過(guò)濾,導(dǎo)致實(shí)驗(yàn)多次后,柱壓不斷上升,經(jīng)過(guò)排除各項(xiàng)原因后,最終發(fā)現(xiàn),過(guò)濾器中溶劑出口過(guò)濾芯變黑,證明其被嚴(yán)重污染,所以,流動(dòng)相配制后,一定要過(guò)濾。
3.3 配伍液顏色的變化 避光條件下,核黃素磷酸鈉配伍液的顏色無(wú)肉眼可見變化;而非避光條件下,核黃素磷酸鈉配伍液隨著放置時(shí)間的延長(zhǎng),顏色逐漸變淺,由黃色轉(zhuǎn)變?yōu)榈S色。
3.4 維生素C的保護(hù)作用 有文獻(xiàn)報(bào)道,維生素C對(duì)核黃素有一定保護(hù)作用,可使其降解速度減緩,而目前臨床上相當(dāng)一部分患者在用核黃素磷酸鈉的同時(shí)也有補(bǔ)充維生素C,這樣有利于更有效地利用核黃素磷酸鈉[13]。
[1] 王林靜.核黃素與健康[J].廣東藥學(xué)院學(xué)報(bào),2000,16(3):223-225,228.
[2] [No authors listed]Riboflavin[J].Monograph Altern Med Rev,2008,13(4):334-340.
[3] 劉志強(qiáng),沈向忠,宗儉.高效液相色譜法測(cè)定核黃素制劑含量[J].現(xiàn)代應(yīng)用藥學(xué),1994,16(8):38-39.
[4] 饒桂香,達(dá)明,何靜.維生素B2對(duì)光的穩(wěn)定性研究[J].華西藥學(xué)雜志,1994,9(3):172-175.
[5] 國(guó)家藥典委員會(huì).中華人民共和國(guó)藥典(二部)[M].北京:化學(xué)工業(yè)出版社,2005:193-197.
[6] 鄧潔雄.HPLC測(cè)定核黃素磷酸鈉中核黃素的含量[J].廣東藥學(xué)院學(xué)報(bào),2006,22(1):53-54.
[7] 馮改利,蒙躍龍,李小安,等.HPLC法測(cè)定復(fù)方鋅鐵鈣顆粒中維生素 B2的含量[J].西北藥學(xué)雜志,2006,21(5):776-777.
[8] 李紹波,喬秀明,楊紅.1嬰幼兒配方食品和乳粉中維生素 B2的測(cè)定[J].中國(guó)測(cè)試技術(shù),2006,32(3):128-131.
[9] 楊翠琳,鄧曉莉,詹嬌榕.燈盞花素與4種輸液配伍的穩(wěn)定性探討[J].海峽藥學(xué),2008,20(6):31-32.
[10] 高崢,劉蕾.病毒唑與臨床常用的五種抗菌素在配伍輸液中的穩(wěn)定性探討[J].新醫(yī)學(xué)導(dǎo)刊,2008,7(3):66-67.
[11] United States Pharmacopeial Convention.USP 27 [S].USA:Board of Trustees,2000:1646.
[12] British Pharmacopoeia Commission.Bp 2003 [S]UK:HMSO,2003:1623.
[13] 呂小云.核黃素的光降解及維生素C對(duì)核黃素的保護(hù)效應(yīng)[J].青海醫(yī)學(xué)院學(xué)報(bào),2007,28(3):145-153.

