基于DcR3的樹突細胞疫苗對CD8+T細胞的免疫抑制效應
李樹法 向 菲 李海英 黎姍姍 梁 愿 張 敏
(貴陽市第一人民醫院內分泌科,貴州 貴陽 550002)
誘騙受體3(DcR3)是最近新發現的能與淋巴毒素類似物(LIGHT)、Fas配體(FasL)競爭性結合并抑制其活性的腫瘤壞死因子(TNF)家族成員之一,對LIGHT和Fas兩大系統的調節起重要的作用〔1,2〕。DcR3抑制了LIGHT及FasL介導的凋亡,有助于腫瘤細胞、活化的自身免疫細胞免受機體免疫系統的清除,從而被認為與某些腫瘤、自身免疫病的發病有關,因此是一種具有免疫抑制作用的分子〔3~5〕。本研究擬將DcR3腺病毒轉染到樹突細胞(DC)表面,制備DcR3特異的DC疫苗,觀察該疫苗對同種異體的CD8+T細胞的免疫抑制作用,為自身免疫疾病的治療提供理論基礎。
1 材料與方法
1.1 材料 8月齡Balb/c和C57BL/6小鼠購自重慶醫科大學動物實驗中心。重組DcR3(Ad-DcR3)腺病毒和攜帶β-半乳糖苷酶(LacZ)基因的重組腺病毒(Ad-LacZ)由第三軍醫大學免疫學研究所提供,粒-巨噬細胞集落刺激因子(GM-CSF)、白細胞介素-4(IL-4)和 TNF-α 購自美國 R&D systems,Minneapolis。CD8+T細胞分離試劑盒購自Miltenyi公司。
1.2 方法
1.2.1 小鼠脾臟淋巴細胞懸液制備 頸椎脫臼法處死小鼠,無菌分離小鼠脾臟放于冷Hank液中,剪碎并反復碾磨通過200目的無菌銅網,收集懸液并用紅細胞溶解液去除紅細胞,再用大量Hank's液洗滌細胞2次,1 200 r/min離心10 min,用RPMI1640培養液重懸,計數。
1.2.2 免疫磁珠分選(MACS)純化CD8+T細胞 取4×107細胞,1 200 r/min離心10 min,去上清液后用160μl緩沖液重懸,加40μl抗體Cocktail充分混勻,4℃孵育10 min。加160μl緩沖液,1 200 r/min離心10 min,去上清液,再加入320μl緩沖液、80μl磁性微珠,充分混勻,4℃孵育15 min。用適量緩沖液沖洗,1 200 r/min離心10 min。吸除上清液,用500μl緩沖液重懸細胞,200目篩網過濾成無氣泡的單細胞懸液。將MS細胞分離柱置于MACS磁力架上,先用500μl緩沖液洗柱,再將細胞懸液通過MS柱,1 500μl緩沖液洗滌,收集流出液體,離心收集細胞,計數。
1.2.3 DC的培養及鑒定 取8周齡Balb/c小鼠,脫頸處死,用體積分數為75%的乙醇溶液浸泡5 min,無菌條件下切開皮膚及皮下組織,分離小鼠股骨和脛骨,用濃度為0.01 mol/L的無菌磷酸鹽緩沖液(PBS)清洗3~5次,剪斷股骨和脛骨兩端,用濃度為0.01 mol/L的無菌PBS反復沖洗骨髓腔,制成單細胞懸液,1 000 r/min離心 5 min去掉脂肪層,細胞用濃度為0.01 mol/L的無菌PBS重懸,再緩慢加入等體積Percoll細胞分離液,3 000 r/min離心 30 min,收集單核細胞,用濃度為0.01 mol/L的無菌PBS洗滌2次,再用含血清的DMEM培養基重懸,所得單細胞懸液接種于T-25培養瓶內,并補充GM-CSF和IL-4,置溫度為37℃、CO2氣體體積分數為5%和飽和濕度的培養箱內培養,隔日半量換液補充細胞因子,第7天收獲細胞,即得DC。采用光鏡觀察DC的形態。
1.2.4 重組酶腺病毒對DC的體外轉染 將DC置于6孔培養板中,每孔3×106個細胞,實驗組每孔加入1×109Pfu的Ad-DcR3或Ad-LacZ重組腺病毒1 ml,空白對照組每孔加入1 ml PBS,在37℃5%CO2飽合濕度下繼續培養48 h。
1.2.5 Western印跡檢測DcR3蛋白的表達 收集感染48 h的各組細胞,提取總蛋白。取40μg蛋白樣品進行12%十二烷基硫酸鈉聚丙烯酰胺(SDS-PAGE)電泳,半干轉至聚偏氟乙烯(PVDF)膜上,5%脫脂奶粉封閉2 h以封閉非特異反應物。封閉后的膜與1∶100稀釋的DcR3一抗4℃孵育過夜。Tris緩沖液(TBS)洗膜,與1∶2 000稀釋的二抗孵育120 h。TBS洗膜,化學發光試劑盒反應3 min,膠片曝光,拍照。實驗中以β-actin作為內參。
1.2.6 混合淋巴細胞培養實驗 采用混合淋巴細胞培養,取Balb/c的DC與C57BL/6的CD8+T細胞,調整細胞濃度為1×106個/ml,將兩種細胞混合置于96孔培養板,每孔分別加入細胞各100μl,每組設3個復孔,置入37℃、5%CO2的孵育箱中,分別培養72 h。
1.2.7 淋巴細胞增殖能力檢測 細胞混合培養后,每孔加入0.1 ml濃度為1×103μCi/L的3H-胸腺嘧啶核苷(3H-TdR)溶液,繼續培養12 h,用PBS漂洗細胞3次,甲醛固定10 min,再用4℃預冷的體積分數為5%的三氯醋酸溶液漂洗3次,每孔加入0.5 ml濃度為0.3 mol/L的NaOH溶液,60℃水浴反應30 min,冷卻至室溫,轉移入閃爍瓶中,加入5 ml閃爍液,用液體閃爍計數器計數每分鐘的閃爍次數(cpm),測定DPM值(反映細胞DNA合成速率),重復測定3次。
1.2.8 細胞因子的ELISA檢測 混合淋巴細胞培養72 h后,取培養上清液,用ELISA試劑盒檢測培養液中的γ-干擾素(IFN-γ)水平。具體步驟參照試劑說明書。
1.3 統計學分析 采用SPSS統計軟件對數據進行方差分析、t檢驗。
2 結果
2.1 DC的光鏡觀察結果 用光鏡觀察DC的形態,DC誘導成熟后,細胞呈不規則形,并形成大量的毛刺突出。證明經細胞因子誘導后,可以誘導脾臟單個細胞向DC的分化。見圖1。

圖1 DC的形態觀察結果(×40)
2.2 細胞轉染與Western印跡分析結果 將Ad-DcR3對DC進行轉染,Western印跡分析DcR3的表達情況。Ad-DcR3可介導DcR3的有效表達,而陰性對照則未出現條帶。見圖2。
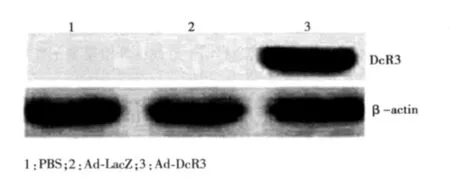
圖2 Western印跡檢測DcR3的表達
2.3 淋巴細胞增殖能力檢測 Ad-DcR3組的CD8+T細胞cpm值為36 000±3 400,Ad-LacZ組為51 000±4 800,PBS組為54 000±6 500。實驗證明轉染Ad-DcR3的DC對同種異體的CD8+T細胞具有抑制增殖的作用(P<0.05)。
2.4 淋巴細胞分泌IFN-γ的檢測 Ad-DcR3組的CD8+T細胞 IFN-γ分泌值為(42.8±5.7)pg/ml,Ad-LacZ組為(98.4±11.9)pg/ml,PBS組為(96.5±10.2)pg/ml。實驗證實轉染Ad-DcR3的DC對同種異體的CD8+T細胞具有抑制細胞因子分泌的作用。
3 討論
DcR3屬于TNF受體(tumor necrosis factor receptor,TNFR)超家族的成員,其開放閱讀框編碼300個氨基酸。其基因定位于20q13.3,含有4個半胱氨酸富集區〔6〕。它是一種表面受體,也是一種凋亡抑制蛋白(IAP),DcR3的配體均是TNF家族成員,包括FasL、LIGHT和TL1A。它可干擾FasL或淋巴毒素β受體介導的凋亡,還可通過阻斷NFR-2和LIGHT之間的雙向信號轉導、TL1A致死亡受體3(death receptor3,DR3)的單向信號轉導,抑制T細胞共刺激〔7~9〕。因而DcR3在腫瘤逃逸及轉移、自身免疫性疾病、移植排斥反應中扮演了重要的角色,可為這些疾病的診斷、治療、療效觀察和預后判斷提供新的思路,故逐漸受到人們的重視。
DC是目前體內功能最強大的專職抗原遞呈細胞,是機體T細胞特異免疫應答的直接啟動和調控者〔10,11〕,其強大的專職性遞呈作用和啟動初始T細胞的能力,日益成為國內外學者研究的熱點。它最大的特點是能夠顯著刺激初始型T細胞增殖活化〔11~13〕,因此DC是機體免疫反應的始動者,在免疫反應的誘導中具有獨特的地位。采用基因修飾方法制備DC疫苗用于主動免疫治療是一種理想的免疫治療方法〔14,15〕。
為了證實DcR3基因修飾DC的免疫效應,本研究將該基因修飾的DC刺激同種異體的CD8+T細胞,采用3H-TdR和ELISA法檢測DC對CD8+T細胞的免疫抑制情況。結果提示DcR3基因修飾DC能抑制同種異體的CD8+T細胞的增殖和細胞因子(IFN-γ)的分泌。因此,重組DcR3腺病毒轉染的DC對CD8+T細胞具有免疫抑制效應,為下一步在自身免疫疾病的防治研究工作提供了工具和理論基礎。
1 Pitti RM,Marslers SA,Lawrence DA,et al.Genomic amplification of a decoy receptor for Fas ligand in lung and colon cancer〔J〕.Nature,1998;396(6712):699-703.
2 Yu KY,Kwon B,Ni J,et al.A newly identified member of tumor necrosis factor receptor superfamily(TR6)suppresses LIGHT-mediated apoptosis〔J〕.JBiol Chem,1999;274(20):13733-6.
3 Wu Y,Han B,Luo H,et al.DcR3/TR6 effectively prevents islet primary nonfunction after transplantation〔J〕.Diabetes,2003;52(9):2279-86.
4 Shi G,Wu Y,Zhang J,et al.Death decoy receptor TR6/DcR3 inhibits T cell chemotaxis in vitro and in vivo〔J〕.JImmunol,2003;171(7):3407-14.
5 Wortinger MA,Foley JW,Larocque P,et al.Fas ligand-induced murine pulmonary inflammation is reduced by a stable decoy receptor 3 analogue〔J〕.Immunology,2003;110(2):225-33.
6 Mild G,Bachmann F,Boulay JL,et al.DCR3 locus is a predictive marker for 5-fluorouracil-based adjuvant chemotherapy in colorectal cancer〔J〕.Int JCancer,2002;102(3):254-7.
7 Wan X,Shi G,Semenuk M,et al.DcR3/TR6 modulates immune cell interactions〔J〕.J Cell Biochem,2003;89(3):603-12.
8 Wan X,Zhang J,Luo H,et al.A TNF family member LIGHT transduces costimulatory signals into human T cells〔J〕.JImmunol,2002;169(12):6813-21.
9 Zhang J,Salcedo TW,Wang X,et al.Modulation of T-cell responses to alloantigens by TR6/DcR3〔J〕.J Clin Invest,2001;107(11):1459-68.
10 Zhang Y,Yang H,Xiao B,et al.Dendritic cells transduced with lentiviral-mediated RelB-specific ShRNAs inhibit the development of experimental autoimmune myasthenia gravis〔J〕.Mol Immunol,2009;46(4):657-67.
11 Kupresanin F,Chow J,Mount A,et al.Dendritic cells present lytic antigens and maintain function throughout persistent gamma-herpesvirus infection〔J〕.J Immunol,2007;179(11):7506-13.
12 Chauvin C,Josien R.Dendritic cells as killers:mechanistic aspects and potential roles〔J〕.J Immunol,2008;181(1):11-6.
13 Morelli AE.The immune regulatory effect of apoptotic cells and exosomes on dendritic cells:its impact on transplantation〔J〕.Am J Transplant,2006;6(2):254-61.
14 Hernando JJ,Park TW,Kuhn WC.Dendritic cell-based vaccines in breast and gynaecologic cancer〔J〕.Anticancer Res,2003;23(5b):4293-303.
15 Lo J,Clare-Salzler MJ.Dendritic cell subsets and type I diabetes:focus upon DC-based therapy〔J〕.Autoimmun Rev,2006;5(6):419-23.

